榄香烯对人胶质瘤U251细胞的放射增敏机制*
2020-05-26关晓燕周卫兵
汪 凤,朱 婷,关晓燕,2,李 玲,周卫兵△
(1中南大学湘雅医院肿瘤科,湖南长沙410008;2中国科学院合肥肿瘤医院肿瘤科,安徽合肥230071;3中南大学湘雅医院分子医学研究中心,湖南长沙410008)
高级别胶质瘤(high-grade gliomas,HGGs)包括WHOⅢ、Ⅳ级胶质瘤,是脑原发性肿瘤中发病率最高、最难治疗的一类肿瘤,因肿瘤无完整的包膜,呈浸润性生长,与脑组织分界不清,手术难以根除。目前标准治疗方案为手术联合术后放疗和(或)同步替莫唑胺化疗[1-2]。放疗能延长患者的无疾病进展生存期[3],但往往因放射抵抗导致复发,降低生存时间。因此通过药物、生物以及物理等手段增强高级别胶质瘤的放疗敏感性已成为近年研究重点之一。
榄香烯(elemene)是从姜科植物温莪术(郁金)中提取出来的萜烯类化合物,主要包括β-榄香烯、γ-榄香烯和δ-榄香烯3种,其中具有明确抗癌活性的成份是β-榄香烯(1-甲基-1-乙烯基-2,4-二异丙烯基环己烷)。1994年榄香烯乳状注射液作为国家二类非细胞毒性抗肿瘤新药上市[4-5],但乳剂存在一些缺陷,如静脉炎发生率高、低温耐受性差等。石药集团对剂型进行改良升级,于2012年上市水针剂型的榄香烯注射液,为无色澄明粘稠液体,均相体系显著降低了使用者静脉炎的发生率,其β-榄香烯含量高达96%以上,杂质含量低且产品稳定性良好。大量研究[6-10]证实,榄香烯能通过血脑屏障,具有广谱、高效、低毒等特点,对包括胶质瘤在内的多种肿瘤表现出抗肿瘤作用。目前榄香烯注射液联用化疗药开展的临床试验涉及恶性胸腹腔积液、多种实体瘤以及脑转移癌等,并取得了一定的疗效[11-12],具有毒副作用小(如对肝、肾功能无明显损害,不发生骨髓抑制)、长期使用无明显耐药性等优点。榄香烯亦具有放射增敏作用,但目前研究主要集中于肺癌,而对于胶质瘤增敏作用的研究未见报道。我们前期发现了榄香烯对U251细胞有放射增敏作用[13],但具体机制尚不清楚,本文将榄香烯对人脑胶质瘤U251细胞株的放射增敏作用机制进行研究。
材料和方法
1 材料
人胶质瘤U251细胞(中南大学细胞分子实验室)。榄香烯注射液[石药集团远大(大连)制药有限公司,国药准字H20110114,规格为每支0.2 g/10 mL];annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司);鼠抗人细胞分裂周期蛋白2(cell division cycle protein 2,Cdc2)、survivin和βactin抗体及羊抗鼠、羊抗兔IgG-HRP抗体(Santa Cruz);兔抗人 p-Cdc2(Thr161)和cyclin B1抗体(Cell Signaling)。
2 仪器与设备
超净工作台(上海申力科学仪器公司);ELx800型酶标仪(BioTek);FACSCalibur流式细胞仪(BD);直线加速器(Siemens)。
3 方法
3.1 细胞培养 人脑胶质瘤U251细胞培养于含10%胎牛血清的DMEM培养液,37℃饱和湿度的CO2培养箱。
3.2 MTT法检测细胞活力 接种对数生长期细胞于96孔培养板(每孔4×103个细胞),设调零组、对照组(0 mg/L)及榄香烯(10、20、40、80和160 mg/L)组,每组设6个重复孔。常规培养24 h后,予以不同浓度药物处理,继续培养24 h后加入MTT液20 μL,孵育4 h后吸弃,再加入DMSO 150 μL,酶标仪490 nm波长处测定吸光度(A490)。细胞相对活力(%)=(榄香烯组A490-调零组A490)/(对照组A490-调零组A490)×100%。设调零组、对照组(0 mg/L+0 Gy)、榄香烯组(40 mg/L+0 Gy)、放疗组(0 mg/L+2、4、6、8 Gy)及联合组(40 mg/L+2、4、6、8 Gy),每组设6个重复孔,予以榄香烯40 mg/L处理24 h后,放疗组及联合组置于直线加速器(200 cGy/min,源皮距100 cm),按设定剂量进行照射。各组继续培养24 h后,予以MTT法检测各组光吸收值A490。放射组细胞相对活力(%)=(放射组A490-调零组A490)/(对照组A490-调零组A490)×100%,去除药物毒性作用联合组细胞相对活力(%)=(联合组A490-调零组A490)/(药物组A490-调零组A490)×100%。
3.3 细胞分组及处理 将3×105个细胞接种于100 mL培养瓶,设对照组(0 mg/L+0 Gy)、放疗组(0 mg/L+3 Gy)、榄香烯组(40 mg/L+0 Gy)及联合组(40 mg/L+3 Gy),每组设6个平行瓶。
3.4 细胞周期及细胞凋亡的检测 收集细胞,予以冰的70%乙醇固定,再加入碘化丙啶(propidium iodide,PI)染料4℃避光染色,流式细胞术检测细胞周期。另收集细胞用预冷的PBS洗涤2次,4℃、300×g离心1 min,细胞用缓冲液(binding buffer)重悬细胞。然后加入annexin V/PI双染色,再加入binding buffer制样,流式细胞术检测各组细胞凋亡。
3.5 Western blot检测蛋白表达的水平 收集各组细胞,加入含10%cocktail蛋白酶抑制剂及磷酸化酶抑制剂细胞裂解液冰上裂解40 min,4℃、14 000×g离心15 min,收集上清,测定蛋白浓度。SDS-PAGE胶分离蛋白,再将凝胶中的蛋白电转移至硝酸纤维素滤膜,I抗 4℃孵育 24~48 h,II抗室温下孵育 1 h。ECL试剂发光压片显影。应用ImageJ软件检测条带灰度,计算各蛋白相对表达量。
4 统计学处理
以SPSS 23.0软件进行数据统计。计量资料以均数±标准差(mean±SD)表示,多组比较采用方差分析+两两比较HSD-q检验,多时点观测资料采用两因素重复测量方差分析+组间两两比较HSD-q检验+时间两两比较差值t检验。以P<0.05为差异有统计学意义。
结 果
1 榄香烯对U251细胞活力的影响
榄香烯处理U251细胞24 h后,各浓度榄香烯处理组的细胞活力均低于对照(0 mg/L)组(P<0.05);U251细胞活力随榄香烯浓度增高而降低,榄香烯对U251细胞活力的抑制作用具有剂量依赖性,半数抑制浓度(IC50)为72.0 mg/L,见图1。

Figure 1.Inhibitory effect of elemene on the viability of U251 cells.Mean±SD.n=6.*P<0.05 vs 0 mg/L group.图1 榄香烯对U251细胞活力的抑制作用
2 榄香烯(40 mg/L)对U251细胞放射敏感性的影响
榄香烯浓度为40 mg/L的联合组中,接受不同剂量放疗的细胞活力均低于榄香烯浓度为0 mg/L的单独放射组(P<0.05),表明40 mg/L榄香烯具有放射增敏作用。鉴于单独放射组细胞活力在3 Gy剂量时出现下降(P<0.05),故选用40 mg/L榄香烯联合3 Gy放疗进行后续研究。见图2。
3 榄香烯对细胞凋亡及细胞周期的作用
榄香烯与放疗在U251细胞的早期凋亡率(P=0.047)、继发性坏死率(P=0.008)、总死亡率(P=0.004)及G2/M期阻滞(P=0.032)方面存在交互作用。放射组细胞早期凋亡率、继发性坏死率和总死亡率相对于对照组有增高趋势,而G2/M期细胞比例降低;榄香烯与放射联合作用进一步提高细胞早期凋亡率、继发性坏死率及总死亡率(P<0.05),G2/M期细胞比例亦显著升高(P<0.05);榄香烯组细胞早期凋亡率、总死亡率及G2/M期细胞比例相对于空白组均显著增高(P<0.05),提示榄香烯通过诱导U251细胞G2/M期阻滞和早期凋亡、提高细胞总死亡率而发挥其放射增敏作用。见图3。

Figure 2.Radiosensitizing effect of elemene on the U251 cells.Mean±SD.n=6.*P<0.05 vs 0 mg/L elemene group.图2 榄香烯对U251细胞的放射增敏效应
4 榄香烯对细胞周期及细胞凋亡相关蛋白表达作用
Western blot结果显示,榄香烯药物治疗与放疗对cyclin B1蛋白存在交互作用(P=0.007)。单独放射组cyclin B1蛋白表达与对照组相比显著提高(P<0.05);与单独放射组相比,联合组cyclin B1表达显著降低,提示榄香烯能够拮抗放疗诱导的cyclin B1表达增高,降低cyclin B1表达。此外,榄香烯可显著降低Cdc2、p-Cdc2(Thr161)和survivin蛋白水平(P<0.05)。见图4。
讨 论
放疗是胶质瘤的重要辅助治疗方式之一,但肿瘤周围存在重要组织器官、肿瘤细胞内在放疗敏感性差、术后肿瘤供血供氧不足而产生放疗抵抗或耐放射性等,常导致疗效下降。所以,通过放疗和放射增敏剂联合使用的方法或可提高疗效。研究发现,榄香烯可抑制多种肿瘤,具有毒副作用小、逆转肿瘤耐药等特点,榄香烯具备临床放射增敏剂的潜能。榄香烯在其它实验[14-16]证明对胶质瘤 U87、C6和U251细胞系体外具有增殖抑制作用。本研究结果显示,榄香烯作用24 h对胶质瘤U251细胞的IC50为72.04 mg/L,表明榄香烯对U251细胞体外亦具有增殖抑制作用,与前期实验[13]实验结果相近。

Figure 3.Flow cytometry was used to analyze the apoptosis and the cell cycle distribution.Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs radiation group.图3 流式细胞术检测细胞凋亡和细胞周期分布的变化
榄香烯可能通过参与调控细胞增殖、凋亡、DNA损伤修复、信号通路活性等途径发挥放射增敏作用。本实验发现榄香烯通过诱导U251细胞G2/M期阻滞和早期凋亡、提高细胞总死亡率而发挥其放射增敏作用。细胞增殖依赖于有丝分裂,并主要由3个检查点(G1/S检查点、G2/M检查点和纺锤体组装检查点)调控细胞有丝分裂周期的不可逆运行[17]。目前,有关G2检查点的应答通路尚未完全阐明,但有研究证实Cdc2活性在此过程中发挥关键作用[18],而且cyclin B-Cdc2复合物形成及Cdc2激活推动细胞G2/M期转换。本研究结果表明,榄香烯能够降低Cdc2蛋白表达,同时拮抗放疗诱导的cyclin B1表达增高,抑制cyclin B1表达,初步证实榄香烯联合放疗可抑制cyclin B-Cdc2复合物形成,导致细胞G2/M期阻滞。Cdc2蛋白活性通过大量磷酸化反应调控,Cdc2蛋白存在一个正性调节位点(Thr161)及2个负性调节位点(Thr14及Tyr15)。磷酸化Cdc2第161位苏氨酸可激活Cdc2,促进细胞G2/M期转换。相反,磷酸化Cdc2两个负性调节位点则抑制Cdc2活性,导致细胞G2/M阻滞。我们进一步研究发现榄香烯能够抑制Cdc2第161位苏氨酸磷酸化,导致p-Cdc2(Thr161)蛋白水平降低,抑制Cdc2活性,进而导致细胞于G2/M期阻滞。大量研究证实,G2期及M期细胞对放疗最敏感,S期细胞对放疗耐受性最强,且G2/M期细胞放射敏感性比S期细胞高近3倍[19]。有研究发现,榄香烯可诱导非小细胞肺癌和卵巢癌细胞发生G2/M期阻滞。另外,陈琦等[6]报道β-榄香烯亦可通过降低cyclin B1和p-Cdc2(Thr161)蛋白水平诱导非小细胞肺癌细胞发生G2/M期阻滞。这些研究进一步证实榄香烯可在不同类型的肿瘤中引起G2/M期阻滞,从而达到放射增敏的作用。
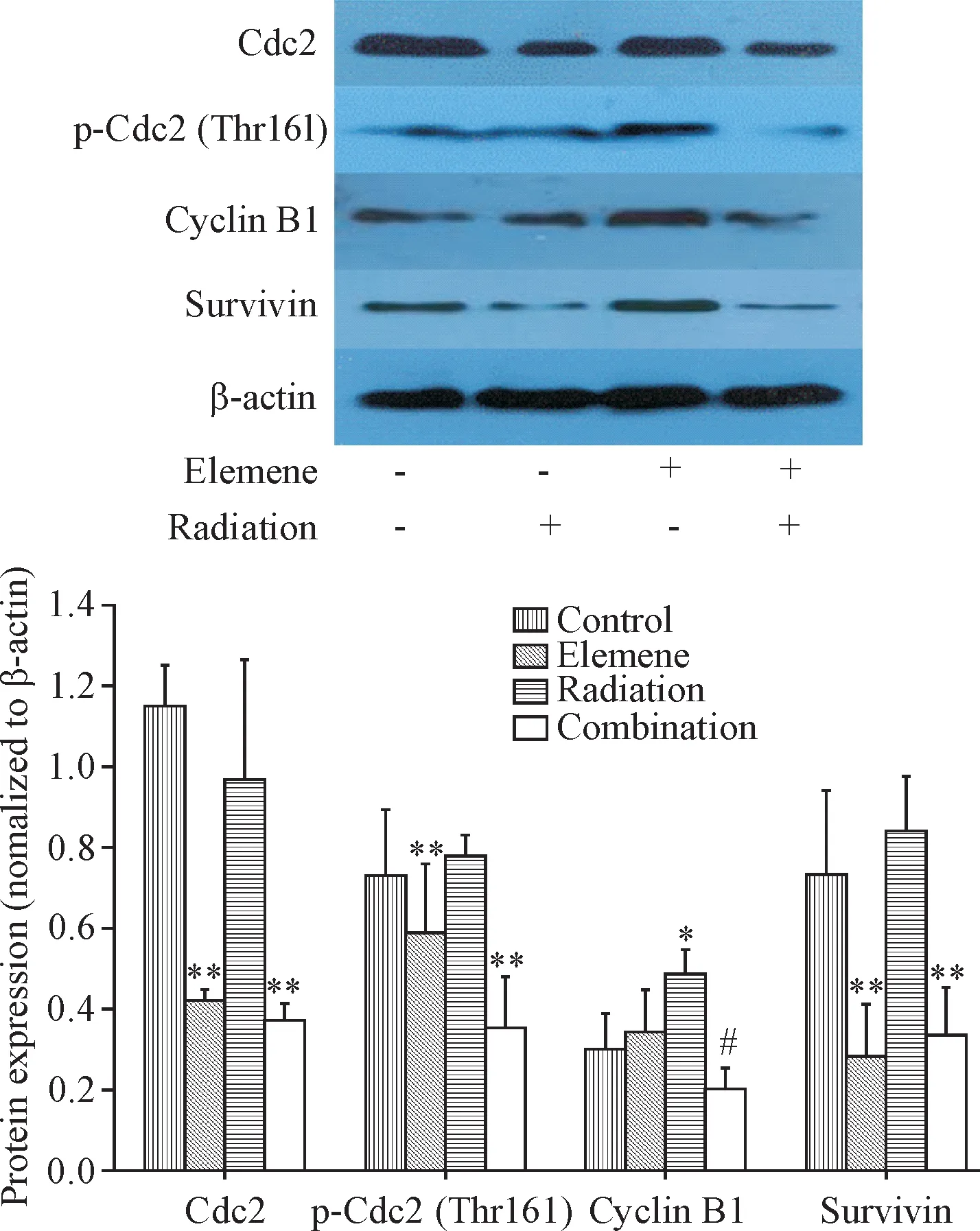
Figure 4.The expression of G2/M check point-related proteins and protein level of survivin.Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs radiation group.图4 G2/M检测点相关蛋白及survivin蛋白表达的变化
既往研究表明,survivin高表达的胶质瘤表现出放射抵抗[20-22]。也有人认为survivin可抑制caspase-3、caspase-7[23-25]和caspase-9[26]的活化而抑制其介导的细胞凋亡;survivin还能与Smac(second mitochondria-derived activator of caspase)/DIABLO(direct inhibitor of apoptosis-binding protein with low pI)结合,发挥抑制细胞凋亡功能[27]。本实验运用Western blot检测survivin蛋白表达,发现榄香烯能显著降低其在胶质瘤U251细胞系中表达,提示榄香烯能够降低U251细胞survivin蛋白表达,诱导细胞凋亡,从而增强放疗作用。但诱导凋亡的具体途径有待进一步研究。
综上所述,榄香烯可抑制人胶质瘤U251细胞活力,增强其放射敏感性;榄香烯可降低Cdc2和cyclin B1蛋白表达,进而抑制cyclin B-Cdc2复合物形成;榄香烯可能抑制Cdc2蛋白磷酸化,降低Cdc2活性,导致细胞G2/M期阻滞,增强细胞放射敏感性;榄香烯还可能通过下调survivin表达,诱导细胞凋亡。
