miR-501靶向BLID介导吉非替尼耐药性非小细胞肺癌的恶性表型
2020-05-25葛凌陈何健徐航娣
葛凌 陈何健 徐航娣


[摘要] 目的 探究miR-501在吉非替尼耐药非小细胞肺癌(NSCLC)中的作用和机制。 方法 采用实时定量聚合酶链式反应(qRT-PCR)检测吉非替尼耐药性NSCLC血清和细胞系PC9/GR中miR-501的表達水平,通过CCK-8、划痕实验和Transwell实验检测miR-501对PC9/GR的恶性表型的影响;利用在线数据库预测miR-501的潜在靶点,并验证其在PC9/GR的具体作用。 结果 与健康对照人群和正常人肺上皮细胞系比较,miR-501在吉非替尼耐药性NSCLC患者血清和PC9/GR中表达水平升高,差异有高度统计学意义(P < 0.01);与mimics NC比较,miR-501 mimics PC9/GR的增殖、迁移和侵袭能力增加,差异有高度统计学意义(P < 0.01);荧光素酶报告基因实验证实BLID是miR-501的直接靶点;与miR-501 mimics+pcDNA3.1比较,miR-501 mimics+pcDNA3.1-BLID PC9/GR的增殖、迁移和侵袭能力下降,差异有高度统计学意义(P < 0.01)。 结论 上调表达的miR-501通过抑制BLID进而促进吉非替尼耐药性NSCLC的增殖、迁移和侵袭能力。因此,miR-501是吉非替尼耐药性NSCLC的潜在靶点。
[关键词] 非小细胞肺癌;miR-501;吉非替尼耐药;BLID
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-7210(2020)04(c)-0018-06
The malignant phenotype of gefitini-resistant non-small cell lung cancer mediated by miR-501 targeted BLID
GE Ling1 CHEN Hejian2 XU Hangdi3
1.Department of Pharmacy, Zhuji Hospital Affiliated to Wenzhou Medical University, Zhejiang Province, Zhuji 311800, China; 2.Department of Respiratory Medicine, Zhuji Hospital Affiliated to Wenzhou Medical University, Zhejiang Province, Zhuji 311800, China; 3.Medical College of Zhejiang University, Zhejiang Province, Hangzhou 310058, China
[Abstract] Objective To explore the role of miR-501 in non-small cell lung cancer (NSCLC) with gefitinib resistance and its underlying mechanism. Methods The expression of miR-501 in NSCLC with gefitinib resistance serum and PC9/GR were evaluated by quantitative real-time polymerase chain reaction (qRT-PCR). The effect of miR-501 on the malignant phenotype of PC9/GR was detected by CCK-8, scratch test and Transwell test. The online database was used to predict the potential target of miR-501 and to verify its specific role in PC9/GR. Results Compared with the healthy control people and the normal lung epithelial cell lines, the expression level of miR-501 in gefitini-resistant NSCLC patients serum and PC9/GR were increased, and the differences were highly statistically significant (P < 0.01). Compared with the mimics NC, the proliferation, migration and invasion capacity of PC9/GR in the miR-501 mimics were increased, and the differences were highly statistically significant (P < 0.01). The luciferase reporter assay confirmed that BLID was a direct target for miR-501. Compared with the miR-501 mimics+pcDNA3.1, the proliferation, migration and invasion of PC9/GR in the miR-501 mimics+ pcdna3.1-blid were decreased, and the differences were highly statistically significant (P < 0.01). Conclusion The upregulation of miR-501 promoted the proliferation, migration, and invasion of geffitini-resistant NSCLC by inhibiting BLID. Therefore, miR-501 is a potential target for gefitinib-resistant NSCLC.
[Key words] Non-small cell lung cancer; miR-501; Gefitinib resistance; BLID
肺癌是呼吸系统最常见的恶性肿瘤,其发病率和死亡率在全球范围内位居第一[1]。在病理分类中,肺癌的主要亚型是非小细胞肺癌(NSCLC)。目前,多种治疗方式均可用于临床治疗NSCLC。分子靶向药吉非替尼的出现为一部分NSCLC患者带来更好的临床收益[2-3]。有研究显示[4],大多数接受吉非替尼治疗的NSCLC患者会出现耐药性。微小RNA(miRNAs)是一类存在于生物体的非编码RNA分子,其长度为21~25个核苷酸,通过结合mRNAs的3′端非翻译区,调节蛋白表达,进而在多种生理和病理过程中发挥作用[5-6]。miR-501是定位于X染色体的miRNA分子,介导胃癌对化疗药物阿霉素的耐药性产生,并且与BLID的抑制表达相关[7]。在结直肠癌中,miR-501介导五氟尿嘧啶耐药性肿瘤细胞的增殖[8]。这些研究均提示,miR-501在肿瘤耐药性中扮演重要角色。近期的一项研究显示[9],miR-501在肺腺癌中显著高表达。Wang等[10]发现,BLID在NSCLC中顯著低表达。基于以上发现,本研究推测miR-501可能在吉非替尼耐药性NSCLC中发挥关键作用。
1 资料与方法
1.1 一般资料
选取2018年1~10月就诊于温州医科大学附属诸暨医院(以下简称“我院”)初诊NSCLC患者6例为初诊NSCLC组和吉非替尼耐药性NSCLC患者6例为吉非替尼耐药性NSCLC组,同期健康体检者6名为健康对照组。三组性别、年龄、体重比较,差异无统计学意义(P > 0.05),具有可比性,见表1。受试对象均被告知本试验的研究目的,并签署知情同意书。涉及的操作经我院医学伦理委员会批准。
表1 三组一般资料比较
1.2 细胞系
正常人肺上皮细胞系BEAS-2B、人NSCLC细胞系PC9和人胚胎肾细胞系HEK-293T均购于美国ATCC公司;吉非替尼耐药性PC9细胞系PC9/GR由PC9细胞系构建,保存于温州医科大学科研实验中心。
1.3 试剂与仪器
胎牛血清FBS(货号:10099)、RPMI-1640培养基(货号:12633012)和DMEM培养基(货号:12491015)购于美国Gibco;miRNeasy Serum/Plasma试剂盒(货号:217184)和miRNeasy Mini试剂盒(货号:217004)购于德国Qiagen;SYBR Premix Ex Taq Ⅱ试剂盒(货号:DRR081A)购于日本Takara;引物、miR-501 mimics、BLID过表达质粒、载有野生型BLID和突变型BLID的载体pGL3购于中国生工;Lipofectamine 3000(货号:L3000015)购于美国Invitrogen;吉非替尼(货号:SML1 657)购于美国Sigma-Aldrich;CCK-8试剂盒(货号:C0038)、RIPA裂解液(货号:P0013B)、BCA蛋白浓度测定试剂盒(货号:P0012)、SDS-PAGE凝胶配制试剂盒(货号:P0012A)、小鼠抗GAPDH单克隆抗体(货号:AF0006)和辣根过氧化物酶耦合二抗(货号:A0208、A0216)购于中国碧云天;Transwell小室(货号:354480)购于美国CORNING;PVDF膜(货号:IPVH00010)购于美国Millipore;兔抗BLID多克隆抗体(货号:ab230129)购于美国Abcam;荧光素酶报告基因检测试剂盒(货号:G7940)购于美国Promega;倒置显微镜(IXplore Standard)购于日本奥林巴斯;实时定量PCR仪(CFX384 TouchTM)、电泳转膜仪(Mini-PROTEAN?誖 Tetra Cell)、化学发光仪(ChemiDoc XRS+)和酶标仪(iMark)购于美国Bio-Rad。
1.4 方法
1.4.1 细胞培养 PC9、PC9/GR和HEK-293T培养于含10%胎牛血清的DMEM培养基,BEAS-2B培养于含10%胎牛血清的RPMI-1640培养基,隔天换液,在5% CO2、37℃条件下进行培养,当细胞密度达到80%时进行传代。
1.4.2 PC9/GR构建和分组 处于对数生长期的PC9加入含有吉非替尼的培养基,浓度从100 nmol/L开始,培养24 h后,弃培养基和漂浮细胞,加入新鲜培养基。当耐药细胞在不含吉非替尼的培养基生长至对数期,提高吉非替尼浓度,反复诱导,直至细胞在1 μmol/L吉非替尼下稳定生长,即得到实验所用PC9/GR。实验分组:①miR-501 mimics+gefitinib组和mimics NC+gefitinib组;②共转染野生型BLID和mimics NC组和共转染野生型BLID和miR-501 mimics组;③pcDNA3.1-BLID组和pcDNA3.1组;④miR-501 mimics+pcDNA3.1-BLID+gefitinib组和miR-501 mimics+pcDNA3.1+gefitinib组。
1.4.3 实时荧光定量PCR 血清miRNA的提取用miRNeasy Serum/Plasma试剂盒,细胞miRNA用miR-Neasy Mini试剂盒提取,经反转录后获得cDNA后,用SYBR Premix Ex Taq Ⅱ试剂盒进行实时荧光定量,程序设定为95℃、10 min,然后40个循环为95℃、30 s,55℃、30 s,72℃、30 s。U6作为微小RNA内参,采用2-ΔΔCt方法计算相对表达。hsa-miR-501:正义链5′-CTGCTCTGCTCGTCCTCTCT-3′,反义链5′-CTCCTGTCCTCACATGAAGA-3′。U6:正义链5′-AGGGG-CCATCCACAGTCTTC-3′,反义链5′-AACGCTTCACGAATTTGCGT-3′。
1.4.4 细胞活力测定 PC9和PC9/GR接种于96孔板,每孔细胞数约8000个,用含有1 μmol/L吉非替尼的培养基培养,在4、24、48 h和72 h测定OD值。将PC9/GR接种于96孔板,每孔细胞数约为6000个,将miR-501 mimics(1.5 μL)、BLID过表达质粒(1.5 μL),利用Lipofectamine 3000转染至PC9/GR培养48 h,然后更换培养基,在4、24、48 h和72 h测定OD值。本研究中,每孔100 μL培养基加入10 μL的CCK-8反应液,培养2 h后于酶标仪测定,波长设定450 nm。miR-501 mimics序列:5′-AGAAUCCUUGCCCGGGUGCAUU-3′。阴性对照mimics NC序列:5′-GUCGGUUCGCAUACUCACUGGA-3′。
1.4.5 细胞划痕实验 将转染了miR-501 mimics、pcDNA3.1-BLID的PC9/GR接种于6孔板,每孔细胞数密度约为2.5×105个,过夜培养后,用移液管尖端进行划痕,用无菌PBS轻轻洗去划下的细胞,加入无血清培养基常规培养,24 h后进行拍照。
1.4.6 Transwell實验 将转染了miR-501 mimics、pcDNA3.1-BLID的PC9/GR在无血清的培养基重悬,Transwell小室的上室接种约2×105个细胞,Transwell小室的下室倒入含血清的培养基。在细胞孵箱培养24 h后,用甲醇固定下室细胞,并用0.5%结晶紫染色20 min,然后在倒置显微镜下观察、拍照并计数。
1.4.7 荧光素酶报告基因实验 荧光素酶报告基因实验在HEK-293T中进行。HEK-293T接种于96孔板,约8000个/孔,将载有野生型BLID的pGL3(1.5 μL)与miR-501 mimics(1.5 μL)、载有突变型BLID的pGL3(1.5 μL)与miR-501 mimics(1.5 μL)、载有野生型BLID的pGL3(1.5 μL)与mimics NC(1.5 μL)、载有突变型BLID的pGL3(1.5 μL)与mimics NC(1.5 μL)分别利用Lipofectamine 3000共转染至HEK-293T内,48 h后用Bio-GloTM Luciferase Assay System检测,分析数值。
1.4.8 蛋白免疫印迹实验 收集PC9/GR,用RIPA裂解,BCA法蛋白浓度定量;蛋白样品用SDS-PAGE凝胶分离,然后转至PVDF膜;PVDF膜用5%脱脂奶粉封闭2 h;抗BLID和GAPDH一抗在-4℃过夜孵育;TBST洗膜后,用辣根过氧化物酶耦合的二抗在室温孵育PVDF膜2 h;ChemDocTM XRS+ System仪器检测目的条带,并用Image Lab软件进行灰度分析。
1.5 统计学方法
采用GraphPad Prism 5软件进行数据分析,计量资料用均数±标准差(x±s)表示,组间比较用非参数t检验,多组数据分析使用单因素方差分析,两两比较采用LSD检验;计数资料以构成比表示,采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 miR-501的表达水平
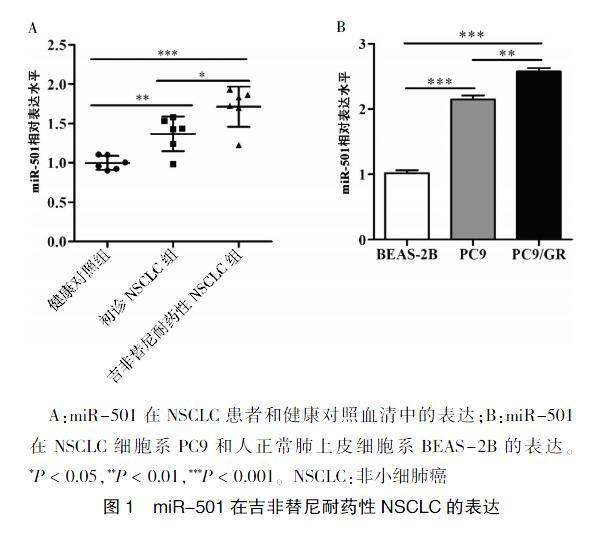
与健康对照组比较,初诊NSCLC组、吉非替尼耐药性NSCLC组血清miR-501表达水平升高(P < 0.01),且吉非替尼耐药性NSCLC组血清miR-501表达水平高于初诊NSCLC组(P < 0.05)(图1A)。此外,qRT-PCR检测细胞系显示,PC9和PC9/GR的miR-501表达水平高于BEAS-2B(P < 0.01),且PC9/GR的miR-501表达水平高于PC9(P < 0.01)(图1B)。
A:miR-501在NSCLC患者和健康对照血清中的表达;B:miR-501在NSCLC细胞系PC9和人正常肺上皮细胞系BEAS-2B的表达。*P < 0.05,**P < 0.01,***P < 0.001。NSCLC:非小细肺癌
图1 miR-501在吉非替尼耐药性NSCLC的表达
2.2 miR-501在PC9/GR中的作用
与4 h比较,PC9/GR正常生长,而PC9的增殖能力明显降低(P < 0.01)(图2A)。miR-501 mimics+gefitinib组PC9/GR增殖能力高于mimics NC+gefitinib组(P < 0.01)(图2B)。miR-501 mimics+gefitinib组细胞迁移能力高于mimics NC+gefitinib组(P < 0.01)(图2C)。Transwell实验结果显示,miR-501 mimics+gefitinib组细胞侵袭能力高于mimics NC+gefitinib组(P < 0.01)(图2D)。
2.3 miR-501的靶点鉴定
与mimics NC组比较,共转染野生型BLID和miR-501 mimics组的荧光素酶活性显著减低(P < 0.01)(图3A)。miR-501 mimics组PC9/GR的BLID蛋白表达水平低于mimics NC组(P < 0.01)(图3B)。
2.4 miR-501/BLID轴在PC9/GR中的作用
将BLID过表达质粒转染至PC9/GR,pcDNA3.1-BLID组BLID的蛋白表达水平显著高于pcDNA3.1组(P < 0.01)(图4A)。miR-501 mimics+pcDNA3.1-BLID+gefitinib组的细胞活力低于miR-501 mimics+pcDNA3.1+gefitinib组(P < 0.01)(图3B)。miR-501 mimics+pcDNA3.1-BLID+gefitinib组PC9/GR的迁移能力和侵袭能力均低于miR-501 mimics+pcDNA3.1+gefitinib组(P < 0.05或P < 0.01)(图4C~D)。
3 討论
肺癌是肿瘤相关性致死的主要恶性疾病,80%~85%的肺癌属于NSCLC[11]。研究发现20%~40%NSCLC患者存在表皮生长因子受体(EGFR)突变[12]。分子靶向药物吉非替尼是一种酪氨酸激酶抑制剂,与EGFR的ATP结合位点竞争性结合,用于携有EGFR突变的NSCLC患者[13]。然而,临床使用发现,接受吉非替尼治疗的NSCLC患者在中位治疗期约10个月后会产生对吉非替尼的耐药性,导致治疗失败[4]。因此,寻找NSCLC吉非替尼耐药靶点有助于为临床治疗NSCLC提供更好的策略。
大量研究证实,miRNAs在NSCLC的耐药性产生中发挥重要作用。Zhang等[14]发现,miR-135a诱导促细胞增殖相关蛋白RAC1上调介导NSCLC细胞的吉非替尼耐药性。临床样本结果提示,携有EGFR突变的NSCLC血清出现miR-214表达显著增高;进一步的细胞学实验结果显示,下调miR-214可抑制厄洛替尼耐药性NSCLC细胞的迁移和侵袭能力,增加其对厄洛替尼的敏感性[15]。这些研究提示,miRNAs具有促进NSCLC耐药性产生的作用。此外,抑制miR-873可促进NSCLC细胞的吉非替尼耐药性[16]。与之类似的是,沉默miR-483-3p的表达诱导EGFR突变型NSCLC细胞出现上皮-间质转化,并降低肿瘤细胞对吉非替尼的敏感性[17],提示不同miRNAs分子在NSCLC的耐药性产生中扮演相反的角色。本研究结果提示,miR-501在吉非替尼耐药性NSCLC患者和细胞系中均出现上调表达。离体实验明确miR-501抑制BLID的表达,进而促进PC9/GR细胞增殖、迁移和侵袭能力。
BLID是凋亡相关蛋白Bcl-2家族分子,在多种肿瘤组织中显著低表达,并参与肿瘤耐药性。在乳腺癌和卵巢癌中,BLID的缺失表达介导肿瘤细胞对PARP抑制剂的耐药性[18]。Goldsmith等[19]研究证实,下调表达的BLID与神经母细胞瘤的治疗反应和耐药性相关。另有研究显示[20],miR-501在阿霉素耐药的胃癌组织和细胞中高表达,通过抑制BLID的表达介导阿霉素的耐药性。该课题组进一步实验明确,miR-501主要来源于阿霉素耐药性胃癌细胞的外泌体[7]。本研究结果与其类似,并发现在PC9/GR细胞中转染BLID过表达质粒可逆转肿瘤细胞的恶性生物学行为。
综上,miR-501具有促进吉非替尼耐药性NSCLC细胞增殖、迁移和侵袭的作用,而且其作用与抑制BLID表达有关。因此,这些结果初步提示miR-501/BLID轴促进吉非替尼耐药性NSCLC细胞增殖、迁移和侵袭能力,而抑制miR-501可能有助于阻断吉非替尼耐药性NSCLC的进展。
[参考文献]
[1] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin,2018,68(6):394-424.
[2] Lee CK,Brown C,Gralla RJ,et al. Impact of EGFR inhibitor in non-small cell lung cancer on progression-free and overall survival:a meta-analysis [J]. J Natl Cancer Inst,2013,105(9):595-605.
[3] Lee CK,Davies L,Wu YL,et al. Gefitinib or Erlotinib vs Chemotherapy for EGFR Mutation-Positive Lung Cancer: Individual Patient Data Meta-Analysis of Overall Survival [J]. J Natl Cancer Inst,2017,109(6):djw279.
[4] Jackman D,Pao W,Riely GJ,et al. Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer [J]. J Clin Oncol,2010,28(2):357-360.
[5] Lu TX,Rothenberg ME. MicroRNA [J]. J Allergy Clin Immunol,2018,141(4):1202-1207.
[6] Rupaimoole R,Slack FJ. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases [J]. Nat Rev Drug Discov,2017,16(3):203-222.
[7] Liu X,Lu Y,Xu Y,et al. Exosomal transfer of miR-501 confers doxorubicin resistance and tumorigenesis via targeting of BLID in gastric cancer [J]. Cancer Lett,2019, 459(1):122-134.
[8] Pan R,Cai W,Sun J,et al. Inhibition of KHSRP sensitizes colorectal cancer to 5-fluoruracil through miR-501-5p-mediated ERRFI1 mRNA degradation [J]. J Cell Physiol,2019,235(2):1576-1587.
[9] Chen S,Zhou YC,Chen Y,et al. Expression profile of miR-501-5p in lung adenocarcinoma patients from Xuanwei area [J]. Nan Fang Yi Ke Da Xue Xue Bao,2017,37(3):354-359.
[10] Wang H,Yan C,Shi X,et al. MicroRNA-575 targets BLID to promote growth and invasion of non-small cell lung cancer cells [J]. FEBS Lett,2015,589(7):805-811.
[11] Travis WD. The 2015 WHO classification of lung tumors [J]. Pathologe,2014,35(2):188.
[12] Zhang YL,Yuan JQ,Wang KF,et al. The prevalence of EGFR mutation in patients with non-small cell lung cancer: a systematic review and meta-analysis [J]. Oncotarget,2016,7(48):78985-78993.
[13] Ning J,Wu Q,Liu Z,et al. Mapping inhibitor response to the in-frame deletions,insertions and duplications of epidermal growth factor receptor (EGFR) in non-small cell lung cancer [J]. J Recept Signal Transduct Res,2016, 36(1):37-44.
[14] Zhang T,Wang N. miR-135a Confers Resistance to Gefitinib in Non-Small Cell Lung Cancer Cells by Upregulation of RAC1 [J]. Oncol Res,2018,26(8):1191-1200.
[15] Liao J,Lin J,Lin D,et al. Down-regulation of miR-214 reverses erlotinib resistance in non-small-cell lung cancer through up-regulation LHX6 expression [J]. Sci Rep,2017,7(1):781.
[16] Jin S,He J,Li J,et al. MiR-873 inhibition enhances gefitinib resistance in non-small cell lung cancer cells by targeting glioma-associated oncogene homolog 1 [J]. Thorac Cancer,2018,9(10):1262-1270.
[17] Yue J,Lv D,Wang C,et al. Epigenetic silencing of miR-483-3p promotes acquired gefitinib resistance and EMT in EGFR-mutant NSCLC by targeting integrin beta3 [J]. Oncogene,2018,37(31):4300-4312.
[18] Issaeva N,Thomas HD,Djureinovic T,et al. 6-thioguanine selectively kills BRCA2-defective tumors and overcomes PARP inhibitor resistance [J]. Cancer Res,2010, 70(15):6268-6276.
[19] Goldsmith KC,Gross M,Peirce S,et al. Mitochondrial Bcl-2 family dynamics define therapy response and resistance in neuroblastoma [J]. Cancer Res,2012,72(10):2565-2577.
[20] Xu YC,Liu X,Li M,et al. A Novel Mechanism of Doxorubicin Resistance and Tumorigenesis Mediated by MicroRNA-501-5p-Suppressed BLID [J]. Mol Ther Nucleic Acids,2018,12(1):578-590.
(收稿日期:2019-12-13 本文編辑:刘永巧)
