过表达烟草NtabKNOX8导致烟叶发育异常
2020-05-25徐方正史素娟毛静静安璐璐刘贯山刘好宝王倩
徐方正 史素娟 毛静静 安璐璐 刘贯山 刘好宝 王倩

摘 要:为探究KNOX (KNOTTED1-like homeobox)家族基因在烟草叶片发育中的功能,从普通烟草(Nicotiana tobacum)红花大金元中克隆获得KNOX家族基因NtabKNOX8,对其进行了生物信息学分析,并通过转基因技术获得了NtabKNOX8过表达材料,对转生长素报告基因DR5::GUS材料与NtabKNOX8过表达材料的杂交F1代叶片进行了GUS染色。结果表明,NtabKNOX8属于KNOX基因家族亚家族Ⅰ;过表达NtabKNOX8导致叶片变宽圆,对称性丧失,叶面皱缩并向叶背面弯曲,主脉明显缩短且脉序发生明显改变,类似掌状网脉,叶形指数变小,叶面积减小,比叶鲜重增大;NtabKNOX8过量表达的烟叶中生长素含量明显增加,且分布更加广泛。推测NtabKNOX8可能通过影响生长素的含量及分布,影响叶片生长发育过程,从而导致了烟叶形态的多重变化。
关键词:KNOX基因;叶片发育;叶形;叶脉;生长素
Overexpression of NtabKNOX8 in Tobacco Causes Abnormal Leaf Development
XU Fangzheng1,2, SHI Sujuan1,2, MAO Jingjing1,2, AN Lulu1,2, LIU Guanshan1, LIU Haobao1, WANG Qian1*
(1. Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Abstract: In order to explore the function of KNOX family genes in tobacco leaf development, a KNOX family gene NtabKNOX8 was cloned from Nicotiana tobacum cv. Honghuadajinyuan and bioinformatics analysis was performed. Transgenic technique was performed to obtain NtabKNOX8 over-expression (OE) lines. And then GUS staining experiments were performed on the leaves of the hybrids (F1) of materials transferred into the auxin reporter DR5::GUS and materials overexpressing NtabKNOX8. The results showed that NtabKNOX8 belongs to the KNOX family subfamily Ⅰ. Compared to the wild type tobacco plants, the NtabKNOX8 OE lines showed round and wrinkled leaves which curved toward the back and lost leaf symmetry. Meanwhile, the midrib of the two OE lines was greatly shortened and the venation changed significantly to palmately-netted venation-like type, with the leaf shape index and the leaf area decreased, leaf specific fresh weight increased. In addition, the auxin content was significantly increased while its distribution was more widely and extensive in the tobacco leaves overexpressing NtabKNOX8. It is suggested that NtabKNOX8 may regulate the growth and development of tobacco leaves by affecting the content and distribution of auxin, which finally leads to multiple changes in tobacco leaves.
Keywords: KNOX gene; leaf development; leaf shape; leaf vein; auxin
植物KNOX(KNOTTED1-like homeobox)家族基因编码一类含有同源异型盒(homeobox,HOX)的转录因子,普遍参与调控植物的生长发育过程[1-2]。根据氨基酸序列、表达模式以及系统发育关系,该家族可分为KNOX Ⅰ和KNOX Ⅱ两个亚家族[3-6]。KNOX Ⅱ亚家族成员参与植物二倍体世代发育[7-8]、次生细胞壁的形成[9-12]和种子的物理休眠[13],而KNOX Ⅰ亚家族基因是植物茎尖分生组织(shoot apical meristem,SAM)产生与维持必需的关键基因[14-15],調控细胞分化,影响叶发育[16-17]、花发育[18] 和果实的形成[19-20]。KNOX Ⅰ亚家族有很多成员过表达会导致植物叶片的异常发育[2]。例如,玉米ZmKN1过表达导致玉米在叶脉附近产生指节状突起[21];拟南芥中过表达ZmKN1(Zea mays KNOTTED1)导致叶原基发育受限,在叶片边缘产生裂片[22];在烟草中过表达水稻OSH15(Oryza sativa homeobox 15)、杨树Pttkn1(Populus tremula×tremuloides KNOTTED1)均导致烟草叶片皱缩、叶的近轴面产生异位芽、叶脉脉序改变等异常发育表型[23-24]。进一步研究发现,KNOX Ⅰ亚家族基因表达量升高所导致的叶片变态发育与生长素含量与分布的变化有关[25-26]。碎米荠KNOX基因的再激活导致其多裂叶叶缘的独立小叶发育位点形成生长素最大值,最终形成多裂叶[25];玉米ZmKN1异位表达的叶片中,生长素响应元件DR5rev驱动红色荧光蛋白基因(DR5rev::mRFPer)的表达比野生型显著增加[26]。
叶片是烟草的商品器官,烟叶的生长发育状况直接影响烤后烟叶的产量和品质,但目前烟草KNOX家族基因在烟叶发育方面的研究非常有限。1997年以来,从枯斑三生烟中陆续克隆了NTH15(Nicotiana tobacum homeobox 15)、NTH1、NTH9、NTH20、NTH22和NTH23等多个烟草KNOX家族基因。除过表达NTH23的烟草发育正常外,其他烟草KNOX家族基因的过表达均导致烟叶的异常发育[27-29]。但该类基因导致的烟叶形态变化趋势及其与生长素之间的关系未见报道。为进一步明确KNOX家族基因在烟叶发育过程中对烟叶形态的影响,本研究从普通烟草(Nicotiana tobacum)红花大金元中克隆到一个KNOX基因,通过转基因试验及表型观察等测定分析其在烟叶发育中的作用,并初步探究其与生长素之间的关系,为了解烟草KNOX家族基因的作用机制提供科学数据。
1 材料与方法
1.1 试验材料及试剂
试验于2018年6月至2019年10月在中国农业科学院烟草研究所进行。供试品种红花大金元和转生长素报告基因DR5::GUS烟草材料(以下简称DR5::GUS)由本课题组自存。
试验所用菌株大肠杆菌DH5α、根癌农杆菌EHA105、载体pCHF3均由本课题组自存。试验所用Taq聚合酶、载体pMD19-T、限制酶、DNA凝胶纯化回收试剂盒和反转录试剂盒(PrimeScript RT-PCR Kit)等均购自宝生物工程有限公司。GUS染色液购自北京雷根生物技术有限公司。引物合成与测序由睿博兴科生物技术有限公司完成。
1.2 试验方法
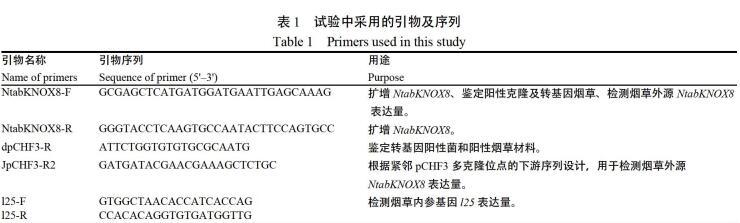
1.2.1 烟草NtabKNOX8基因的克隆及过表达NtabKNOX8烟草材料的获得 热酚法提取红花大金元叶片总RNA[30],参照PrimeScript RT-PCR Kit操作说明反转录获得cDNA。参考美国国家生物信息中心(National Center for Biotechnology Information, NCBI)收录的栽培烟草KNOX序列NM_001326004.1,设计全长引物并引入Sac Ⅰ和Kpn Ⅰ酶切位点,以cDNA为模板进行扩增。PCR产物纯化回收后连入pMD19-T载体进行测序。采用DNAMAN和NCBI Blast分析测序结果。将测序正确的基因片段酶切连入过表达载体pCHF3后,经冻融法转化农杆菌[31],然后采用叶盘转化法转化红花大金元[30],经基因组PCR和RT-PCR检测,鉴定获得T0代过表达株系。本试验所采用的引物见表1。
1.2.2 过表达NtabKNOX8烟草材料的表型观测 收获T0代过表达植株自交种(T1代),消毒播种于1/2 MS平板(含50 mg/L硫酸卡那霉素),对照材料红花大金元种子同时消毒播种于1/2 MS平板,25 d后选取长势一致的转基因抗性植株和对照材料移栽到装有育苗基质(草炭和蛭石1:1)的花盆中。自然光照,每2天浇水。
播种后44、51和61 d,每个材料选取长势良好且一致的6棵烟株,选择自下而上第4片叶片,用直尺测量叶片长、宽,计算叶形指数。测量结束后,将叶片剪下,用天平称取鲜重,随后排在同一水平面进行拍照。所得图片用Image J v1.52q处理,获得叶面积,计算比叶鲜重(叶片鲜重/叶面积)。播种后80 d时,拍照记录各材料表型。同时,采取每个材料自上而下第4片成熟叶,采用叶绿素清除实验对其进行观察和拍照[24],所得图片采用Adobe Photoshop CC 2019进行颜色反相处理以观察脉序。
1.2.3 生长素含量及分布观测 将DR5::GUS(父本)分别与NtabKNOX8过表达材料(母本)和野生型红花大金元(母本)杂交,获得F1代材料35S::NtabKNOX8×DR5::GUS和HD×DR5::GUS。将上述材料直接播种于育苗基质中,播种后40 d时剪取其自上而下第1片叶(幼嫩叶)和第2片叶(成熟叶),参考北京雷根生物技术有限公司GUS染色液说明书进行GUS染色。通过对比染色状况,检测叶片中生长素的含量及分布差异。
1.3 数据分析
试验数据采用Microsoft Excel 2016和SPSS25软件进行统计分析,用单因素ANOVA检验-LSD方法进行平均数的差异显著性检验(p<0.01)。
2 结 果
2.1 普通烟草NtabKNOX8基因的克隆与生物信息学分析
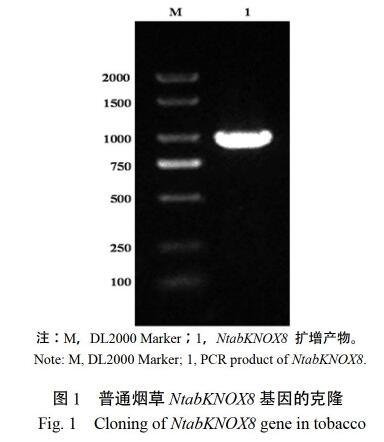
参考NCBI GenBank No.NM_001326004.1序列设计引物,在普通烟草红花大金元中扩增到大小为984 bp的目的片段(图1)。该片段可编码一个由327个氨基酸组成的蛋白,推测分子量为36.7 kD,等电点为5.06。DNAMAN比对结果表明,该序列与NCBI数据库的NM_001326004.1及中国烟草基因组数据库的Ntab0312890完全一致,参考刘向真等[32]的研究结果将其命名为NtabKNOX8。NCBI Blast结果表明,NtabKNOX8与枯斑三生烟NTH1(AF544052.1)、矮牵牛HERMIT-like protein 3(GQ409542.1)、番茄KN4(NM_001279346.2)的核酸序列相似度分别为98.47%、87.09%和85.68%,氨基酸序列相似性分别为98.17%、83.88%和71.76%。其中,NtabKNOX8与NTH1高度同源,属于KNOX Ⅰ亚家族。
2.2 过表达NtabKNOX8导致烟叶皱缩且叶形变宽圆
本研究采用野生型红花大金元(Honghuadajinyuan, HD)、NtabKNOX8过表达T1代抗性材料OE-1(over-expression line 1)和OE-2(over-expression line 2)3个烟草材料进行表型观察。OE-1和OE-2播种44 d前后,即表现有肉眼可见的叶片皱缩、对称性丧失、叶形变宽圆的表型。随着植株的发育,该表型更加明显(图2)。为更科学地展示叶片皱缩程度和叶形的变化,测量了各材料播种44、51和61 d的比叶鲜重、叶形指数和叶面积。播种44 d时,OE-1和OE-2与野生型材料的比叶鲜重均无显著差异;播种51 d时,OE-1和OE-2的比叶鲜重均高于野生型,差異极显著;播种61 d时,OE-1和OE-2的比叶鲜重与野生型差距进一步扩大,比野生型分别高53.3%、66.6%,差异达极显著水平(图3)。在播种后44、51和61 d,OE-1和OE-2叶形指数均低于野生型,且差异均达极显著水平(图4)。过表达材料与野生型的叶形指数差距随生长时间延长逐渐增大,播种后61 d时,OE-1和OE-2的叶形指数分别比野生型低39.6%、41.5%。在播种后44、51和61 d,OE-1和OE-2的叶面积均低于野生型,并始终保持在野生型的一半左右,差异均达极显著水平(图5)。该试验表明,过表达NtabKNOX8严重影响烟草叶片的形态,导致叶面皱缩且叶形变宽圆,叶形指数变小、叶面积减少、比叶鲜重增大。
2.3 过表达NtabKNOX8导致烟叶主脉变短变弯且脉序类似掌状网脉
剪取各材料的叶片主脉,将各材料叶片主脉以叶正面朝左、叶背面朝右的方向放置,进行拍照。如图6,与野生型相比,过表达材料叶片的主脉长度变短。并且,野生型烟叶主脉没有明显的弯曲,而过表达材料叶片的叶脉显著向叶背面弯曲。同时比较了野生型与过表达材料在脉序上的差异。红花大金元为羽状网脉,而过表达材料的脉序显著变化,侧脉呈辐射状,类似掌状网脉(图7)。试验表明,过表达NtabKNOX8严重影响了烟草的主脉形态和侧脉分布,改变了烟草的脉序。
2.4 过表达NtabKNOX8导致烟叶生长素含量显著提高且分布更广泛
参照1.2.3分别获得了35S::NtabKNOX8×DR5::GUS和HD×DR5::GUS烟草材料,利用GUS化学染色法进行GUS活性检测。结果表明(图8),在两种F1代材料中均检测到GUS活性,但幼嫩和成熟叶片中,35S::NtabKNOX8×DR5::GUS材料叶片的GUS活性整体上明显高于对照,且分布更加广泛。在幼嫩叶片中,对照烟草叶片的GUS活性普遍较低,而35S::NtabKNOX8×DR5::GUS材料在叶片主脉基部和部分侧脉区域检测到很强的GUS活性。在成熟叶片中,对照烟草叶片在叶基部和叶尖区域检测到一定程度的GUS活性,而35S::NtabKNOX8× DR5::GUS材料除在叶基部和叶尖部位检测到明显加强的GUS活性外,在叶片的主、侧脉及脉间也检测到明显的GUS活性。该结果表明,过表达NtabKNOX8导致烟草叶片生长素含量显著提高且分布更加广泛。
3 讨 论
烟草是以烟叶为主要收获器官的作物,不同的烟制品对烟叶大小和形状有不同的要求。SAKAMOTO等[28]的研究表明,过表达NtabKNOX8的同源基因NTH1导致叶片轻微发育紊乱,但尚未明确叶片的具体形态变化。NtabKNOX8与NTH1高度同源,其过表达也导致烟叶出现相似表型。在此基础上,本研究进一步分析了这种叶片发育异常在叶形上的具体表现,测定了过表达NtabKNOX8后烟草在叶形指数、比叶重和叶面积3个形态指标的变化趋势,为根据不同生产要求定向调控烟草叶形提供了一定的研究数据。已有研究发现,拟南芥KNOX Ⅰ亚家族基因BREVIPEDICELLUS在SAM中促进细胞分裂,而在维管束中则促进木质部纤维的分化[33-34]。本研究中过表达NtabKNOX8所致烟草材料的叶脉形态变化,是由SAM中细胞分裂异常还是木质部纤维分化加剧引起,还需要更多的试验数据阐明。
植物的遗传改良依赖于对有关数量性状遗传体系以及其中个别重要基因的研究。张兴伟等[35]利用“主基因+多基因”混合遗传模型的6个世代联合分离分析方法,分析了烤烟叶形指数、比叶重和叶面积等的遗传体系。本研究首次明确了过表达
NtabKNOX8对烤烟数量性状叶形指数、比叶重和叶面积的影响,与上述遗传体系相结合,为烟草的遗传改良提供了基本数据。宋健等[36]的研究表明,叶面褶皱程度、主侧脉夹角等数量性状的表现与外界环境条件密切相关,在不同时期基因的表达也会出现差异,因此研究相关基因的顺序性表达对揭示烟草发育的遗传规律具有重要意义。本研究仅探究了组成型過表达NtabKNOX8对叶片形态的影响,关于内源NtabKNOX8在烟草不同生育期的表达尚需进一步研究。
相关研究表明,玉米ZmKN1可以直接与参与生长素合成、转运和信号转导的基因结合,且该基因在玉米叶片中的异位表达导致叶片皱缩,皱缩叶片中DR5rev::mRFPer的表达比野生型显著增加[26]。与该研究结果一致,过表达NtabKNOX8基因导致叶片皱缩和DR5::GUS的表达增加,说明NtabKNOX8可能通过类似机制导致生长素的积累。推测NtabKNOX8可能参与调节生长素的含量与分布,进而导致了过表达材料在叶片形态方面的多重变化。此外,已有研究表明KNOX蛋白参与植物体内多种激素含量的调节,包括生长素、赤霉素和细胞分裂素[1]。这些生长调节物质均可影响烟叶的生理特性[37]。本研究仅探究了NtabKNOX8过表达材料中生长素含量与分布的变化,关于过表达NtabKNOX8导致的叶形变化是否有其他激素参与,仍需进一步探究。
4 结 论
本研究首次从普通烟草红花大金元中克隆获得一个KNOX Ⅰ亚家族基因NtabKNOX8。过表达NtabKNOX8导致烟叶皱缩,叶形指数变小、叶面积减少、比叶鲜重增大,叶片生长素含量明显增加且分布更为广泛。推测过表达NtabKNOX8可能通过调节生长素含量与分布,导致烟叶形态的改变。本研究为烟草的遗传改良和定向调控烟草叶形提供了一定的研究数据。关于NtabKNOX8如何参与调节叶片各组织的发育过程、调控生长素的含量与分布及其过表达导致的叶形变化是否有其他激素参与等科学问题,仍需更加深入的研究。
参考文献
[1] HAY A, TSIANTIS M. KNOX genes: versatile regulators of plant development and diversity[J]. Development, 2010, 137(19): 3153-3165.
[2] HAKE S, SMITH H M, HOLTAN H, et al. The role of KNOX genes in plant development[J]. Annual Review of Cell and Developmental Biology, 2004, 20: 125-151.
[3] KERSTETTER R, VOLLBRECHT E, LOWE B, et al. Sequence analysis and expression patterns divide the maize knotted1-like homeobox genes into two classes[J]. The Plant Cell, 1994, 6(12): 1877-1887.
[4] 葉曙光,宰文珊,熊自力,等. 番茄KNOX基因家族鉴定及茄科作物KNOX基因进化关系分析[J]. 核农学报,2017,31(7):1263-1271.
YE S G, ZAI W S, XIONG Z L, et al. Genome-wide identification of KNOX gene family in tomato and their evolutionary relationship in solanaceae[J]. Acta Agriculturae Nucleatae Sinica, 2017, 31(7): 1263-1271.
[5] 郝好,崔永涛,钱前,等. 水稻同源异形盒基因的研究进展[J]. 中国稻米,2016,22(1):1-9.
HAO H, CUI Y T, QIAN Q, et al. Research progress of homeoboxgene in rice[J]. China Rice, 2016, 22(1): 1-9.
[6] FRANGEDAKIS E, SAINT-MARCOUX D, MOODY L A, et al. Nonreciprocal complementation of KNOX gene function in land plants[J]. New Phytologist, 2017, 216(2): 591-604.
[7] SAKAKIBARA K, ANDO S, YIP H K, et al. KNOX2 genes regulate the haploid-to-diploid morphological transition in land plants[J]. Science, 2013, 339(6123): 1067-1070.
[8] FURUMIZU C, ALVAREZ J P, SAKAKIBARA K, et al. Antagonistic roles for KNOX1 and KNOX2 genes in patterning the land plant body plan following an ancient gene duplication[J]. PLoS Genetics, 2015, 11(2): e1004980.
[9] MA Q, WANG N, HAO P, et al. Genome-wide identification and characterization of TALE superfamily genes in cotton reveals their functions in regulating secondary cell wall biosynthesis[J]. BMC Plant Biology, 2019, 19(1): 432.
[10] WANG S, YANG H, MEI J, et al. Rice homeobox protein KNAT7 integrates the pathways regulating cell expansion and wall stiffness[J]. Plant Physiology, 2019, 181(2): 669-682.
[11] LI E, BHARGAVA A, QIANG W, et al. The Class II KNOX gene KNAT7 negatively regulates secondary wall formation in Arabidopsis and is functionally conserved in Populus[J]. New Phytologist, 2012, 194(1): 102-115.
[12] REYES-RIVERA J, RODRIGUEZ-ALONSO G, PETRONE E, et al. Expression of the KNOTTED HOMEOBOX genes in the cactaceae cambial zone suggests their involvement in wood development[J]. Frontiers of Plant Science, 2017, 8: 218.
[13] CHAI M, ZHOU C, MOLINA I, et al. A class II KNOX gene, KNOX4, controls seed physical dormancy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(25): 6997-7002.
[14] LONG J A, MOAN E I, MEDFORD J I, et al. A member of the KNOTTED class of homeodomain proteins encoded by the STM gene of Arabidopsis[J]. Nature, 1996, 379(6560): 66-69.
[15] SSCOFIELD S, DEWITTE WMURRAY J A. STM sustains stem cell function in the Arabidopsis shoot apical meristem and controls KNOX gene expression independently of the transcriptional repressor AS1[J]. Plant Signal and Behavior, 2014, 9(6): e28934.
[16] CHEN R. Functional genomics and genetic control of compound leaf development in Medicago truncatula: an overview[J]. Methods in Molecular Biology, 2018, 1822: 197-203.
[17] SLUIS AHAKE S. Organogenesis in plants: initiation and elaboration of leaves[J]. Trends in Genetics, 2015, 31(6): 300-306.
[18] ZHAO M, YANG S, CHEN C Y, et al. Arabidopsis BREVIPEDICELLUS interacts with the SWI2/SNF2 chromatin remodeling ATPase BRAHMA to regulate KNAT2 and KNAT6 expression in control of inflorescence architecture[J]. PLoS Genetics, 2015, 11(3): e1005125.
[19] TESTONE G, CONDELLO E, DI GIACOMO E, et al. The KNOTTED-like genes of peach (Prunus persica L. Batsch) are differentially expressed during drupe growth and the class 1 KNOPE1 contributes to mesocarp development[J]. Plant Science, 2015, 237: 69-79.
[20] MAEDA H, AKAGI T, ONOUE N, et al. Evolution of lineage-specific gene networks underlying the considerable fruit shape diversity in Persimmon[J]. Plant and Cell Physiology, 2019, 60(11): 2464-2477.
[21] HAKE S, VOLLBRECHT EFREELING M. Cloning Knotted, the
dominant morphological mutant in maize using Ds2 as a transposon tag[J]. EMBO Journal, 1989, 8(1): 15-22.
[22] HAY A, JACKSON D, ORI N, et al. Analysis of the competence to respond to KNOTTED1 activity in Arabidopsis leaves using a steroid induction system[J]. Plant Physiology, 2003, 131(4): 1671-1680.
[23] SATO Y, SENTOKU N, NAGATO Y, et al. Isolation and characterization of a rice homebox gene, OSH15[J]. Plant Molecular Biology, 1998, 38(6): 983-998.
[24] 丁偉乔,徐全乐,蒲帆,等. Pttkn1基因异位表达对烟草叶片形态的影响[J]. 西北植物学报,2008(3):440-446.
DING W Q, XU Q L, PU F, et al. Ectopic expression of Pttkn1 gene on morphological alteration of tobacco leaves[J]. Acta Botanica Boreali-Occidentalia Sinica, 2008(3): 440-446.
[25] BARKOULAS M, HAY A, KOUGIOUMOUTZI E, et al. A developmental framework for dissected leaf formation in the Arabidopsis relative Cardamine hirsuta[J]. Nature Genetics, 2008, 40(9): 1136-1141.
[26] BOLDUC N, YILMAZ A, MEJIA-GUERRA M K, et al. Unraveling the KNOTTED1 regulatory network in maize meristems[J]. Genes and Development, 2012, 26(15): 1685-1690.
[27] NISHIMURA A, TAMAOKI M, SAKAMOTO T, et al. Over-expression of tobacco knotted1-type class1 homeobox genes alters various leaf morphology[J]. Plant and Cell Physiology, 2000, 41(5): 583-590.
[28] SAKAMOTO T, NISHIMURA A, TAMAOKI M, et al. The conserved KNOX domain mediates specificity of tobacco KNOTTED1-type homeodomain proteins[J]. The Plant Cell, 1999, 11(8): 1419-1432.
