基于SSR分子标记的部分烤烟种质资源遗传多样性研究
2020-05-25丁永亮陈仁霄苑举民管成伟何宽信张兴伟李卓张启明
丁永亮 陈仁霄 苑举民 管成伟 何宽信 张兴伟 李卓 张启明

摘 要:为准确评价部分烟草种质资源的遗传多样性,利用42对已发表多态性较好的烟草SSR标记引物对38份烤烟种质资源进行分析,筛选出22对引物在这些种质间存在多态性,平均等位位点数为3.68个,Neis多样性指数平均为0.451,Shannon信息指数平均达0.789。UPGMA聚类分析表明,红花大金元有明显特异性。遗传结构分析显示,参试材料可分为2个类群,类群1和类群2分别包含16份和22份种质材料,且类群1变异范围大于类群2,类群2材料多表现为自然株高在210 cm以下,叶数20~25,茎围10~11 cm,田间赤星病较严重,青枯病发病相对较轻。研究结果为提升SSR分子标记筛选效率和部分烤烟种质创新应用提供理论依据。
关键词:烟草;种质资源;SSR分子标记;遗传多样性;遗传结构
Genetic Diversity of Flue-cured Tobacco Germplasm Resources Based on SSR Molecular Markers
DING Yongliang1, CHEN Renxiao1, YUAN Jumin1, GUAN Chengwei1, HE Kuanxin1,
ZHANG Xingwei2, LI Zhuo1, ZHANG Qiming1*
(1. Tobacco Science Institute of Jiangxi Province, Nanchang 330009, China; 2. Institute of Tobacco Research of CAAS, Qingdao 266101, China)
Abstract: In order to accurately evaluate the genetic diversity of introduced tobacco germplasm resources, 38 tobacco germplasm resources were analyzed with 42 SSR primers with good polymorphism. A total of 22 pairs of polymorphic primers were selected based on higher identification ability. The average number of alleles was 3.68. The average diversity index of Nei was 0.451, and the average Shannon information index was 0.789. The UPGMA cluster analysis showed the specificity of Honghuadajinyuan. The genetic structure analysis showed that these 38 accessions were classified into two groups (group 1 and group 2), which included 16 and 22 accessions, respectively. The range of variation of group 1 was larger than that of group 2. Most accessions in group 2 showed less than 210 cm in plant height, more than 20 in the number of leaves, 10-11 cm in the stem circumference. Furmore,the accessions in group 2 were susceptible to brown spot disease but resistant to bacterial wilt. The results can provide theoretical basis for improving SSR molecular marker screening efficiency and innovative utilization of some flue-cured tobacco germplasm.
Keywords: tobacco; germplasm resources; SSR molecular marker; genetic diversity; genetic structure
煙草是我国重要经济作物,在国民经济发展中发挥着重要作用。优质烟叶是卷烟工业的重要原料,而品种是彰显烟叶质量特色的关键因素之一,对烟叶品质起主导作用[1]。种质资源是选育优良烟草品种的重要基础[2],烤烟遗传背景狭窄是烟草育种发展中的突出问题[3-4]。因此,建立遗传资源丰富的种质库尤为重要。分子标记技术目前已广泛应用于烟草的遗传多样性和亲缘关系研究,而且在烟草化学成分、普通农艺性状和抗病性等性状连锁基因定位中也取得了一定进展[5]。在基于PCR技术的分子标记方法中,SSR(Simple Sequence Repeats)标记具有多态性高、操作简单、稳定性好等诸多优点,在许多作物的遗传多样性研究中广泛应用[6]。对于烟草,BINDLER等[7-8]首次报道了其SSR标记,构建了包括2317个SSR标记和2363个位点,并覆盖24个连锁群的高密度遗传图谱,总遗传长度为3267 cM,标记间的平均距离小于1.5 cM。此后,SSR分子标记在烟草种质间遗传多样性研究中大量应用。叶兰钦等[9]利用92对烟草SSR标记分析了云南省13个烟草主栽品种的遗传多样性,检测到20对SSR多态性引物。陈夏晔等[10]从960对引物中筛选出34对SSR多态性引物,分析73份烟草抗黑胫病种质,认为其遗传背景较狭窄。尹国英等[6]从278对引物中筛选出32对多态性较好的SSR引物并对140份烟草种质进行分析,结果表明晾晒烟具有丰富的遗传多样性。本研究直接利用前人研究中多态性较高的SSR分子标记,对江西省自存和引进的烤烟种质资源开展遗传多样性分析,旨在为烟草新品种的创育和分子标记辅助育种提供理论指导。
1 材料与方法
1.1 试验材料
试验所用烤烟种质资源共计38份(表1),其中18份由国家农作物种质资源平台烟草种质资源子平台提供;4份为江西省内自育品系和收集的突变体,其余均从国内各省引进。
1.2 试验地点和方法
1.2.1 试验地点 所有材料于2018年3月10日移栽到江西省烟草科学研究所乐安试验田内,土壤为
砂壤土,无严重病虫害发生。土壤肥力状况:pH值5.3,有机质含量19.1 g/kg,速效氮含量90.3 mg/kg,速效磷含量24.5 mg/kg,速效钾含量99.5 mg/kg,氯离子含量0.12 mg/kg。
1.2.2 农艺性状及病害调查 采用随机区组设计,每份材料种植40株,设3次重复,行株距1.20 m×
0.50 m,田间管理和调制按照当地统一模式进行。按照YC/T 142—2010烟草农艺性状调查测量方法调查各种质单株着生叶数、自然株高、茎围和节距等农艺性状,每个小区调查10株。赤星病和青枯病参照GB/T 23222—2008烟草病虫害分级及调查方法进行调查,其中赤星病每个小区调查50片叶,青枯病调查全部烟株。
1.2.3 烟草DNA提取 以每份种质嫩叶为材料,利用磁珠法植物DNA提取试剂盒KFR-804496(Thermo Fisher公司)提取总DNA,用超微量分光光度计NANODROP 2000(Thermo Fisher公司)检测DNA浓度和纯度,将其稀释至约50 ng/μL,?20 ℃保存备用。
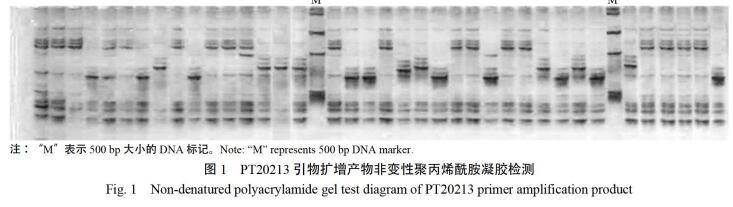
1.2.4 PCR扩增与检测 采用已发表多态性较好的42对烟草SSR标记引物[6,11-15],引物由英潍捷基(上海)贸易有限公司合成。PCR扩增体系参照Ex Taq试剂盒(购自TAKARA公司)说明配制。扩增程序:94 ℃预变性5 min,PCR扩增35个循环,每循环94 ℃变性30 s,55 ℃(视引物而变)退火30 s,72 ℃延伸30 s,最后72 ℃延伸10 min。利用10%非变性聚丙烯酰胺凝胶电泳检测PCR产物,在180 V恒压下电泳3 h,用银染法显影。
1.2.5 数据处理 利用Excel 2013軟件统计农艺性状和病害病情指数。对于SSR带型,在相同迁移率的位置上,有带记录为“1”,无带记录为“0”。利用Dataformater软件对0、1矩阵进行格式转换,并过滤无多态位点。利用Popgene软件计算基因多样性和Shannon信息指数。利用NTSYS-pc 2.10软件构建UPGMA(非加权组平均法)聚类图,并利用DCENTER和EIGEN模块对供试烟草材料进行主成分分析(PCA)。利用Structure 2.3软件对烟草材料进行群体结构分析,潜在的分组数值K的范围设置在1~10。根据原始结果,每一个K值将独立运行10次再取平均值,其中burn-in period 10 000 步,MCMC重复100 000,ΔK参考EVANNO等[16]的算法用来决定最佳组群数量。
2 结 果
2.1 SSR引物多态性分析
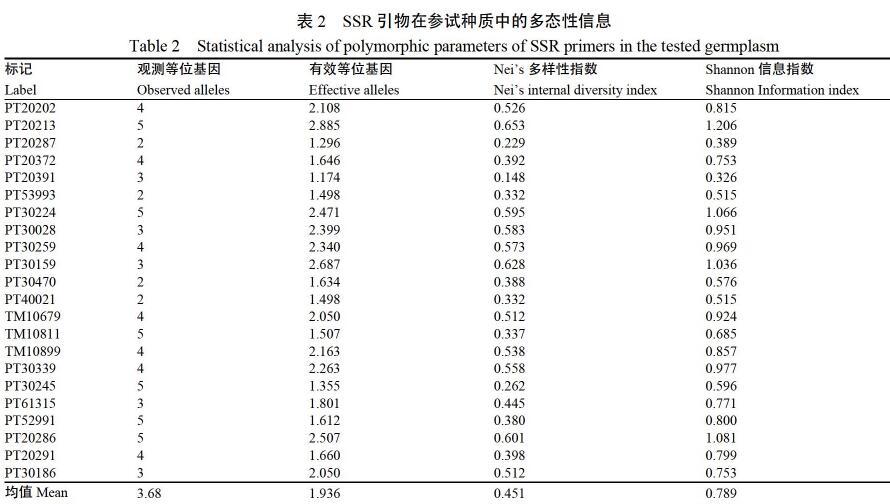
PCR扩增产物通过10%非变性聚丙烯酰胺凝胶检测结果表明,筛选的42对SSR标记中有27对检测出等位变异。利用Dataformater软件对0、1矩阵进行格式转换,并过滤无多态位点,筛选出22对具有多态位点的SSR标记(表2)。观测等位基因数变幅在2~5之间,平均为3.68个。有效等位基因数变幅在1.174~2.885之间,平均为1.94个,Shannon信息指数平均为0.789,Neis多样性指数变幅在0.148~0.653之间,平均为0.451,其中PT20213多样性指数最高,表明具有较高的鉴别能力(图1)。
2.2 种质资源聚类分析
为确定38份种质材料在基因组上的遗传关系,利用NTSYS软件按UPGMA方法进行聚类分析,构建了参试材料的亲缘关系图。由图2可知,22对多态性引物可将36份种质材料区分归类,聚类结果与已知种质亲缘关系大致相近,美国引进种质和部分突变体材料遗传距离较近,国内各种质间距离较近。利用DCENTER和EIGEN对供试材料进行主成分分析(图3),结果表明,38份种质材料大致可分为2个类群,且两个类群的离散程度存在较大差异。
2.3 群体遗传结构分析
利用Structure软件对烟草种质材料进行群体结构分析(图4)得出,群体等位变异频率特征类型数K呈逐渐增大的趋势,通过EVANNO等[16]ΔK值来确定K值。ΔK值在K=2时值最大,表明等位变异频率特征类型数K=2时其模型后验概率最大,由此可将38份种质材料分为2个类群。烟草38个种质材料的群体遗传结构如图5,其中类群1(POP 1)包括G80、K326、Coker86、CV70、CV87、中烟98、中烟102、云烟97、云烟99、云烟110、HY06、粤烟98、FJ109、闽烟9号、红花大金元、新丰变等16个种质材料,类群2(POP2)包括剩余的22份种质材料。遗传结构分析与聚类分析在云烟110、云烟97和Coker86等材料的群体划分结果上存在差异,与主成分分析在云烟110、NC2514、豫烟10号等材料的群体划分结果上存在差异。
2.4 两个遗传群体农艺性状与抗病性变异分析
如图6所示,群体遗传结构分析所得两个群体的农艺性状和田间主要病害发病情况存在差异。POP1在各农艺性状统计范围内均有分布,POP2自然株高均在210 cm以下,99.91%的种质材料自然株高不超过185 cm,着生叶片17.6片以上,茎围在10.1~11.0 cm范围内种质数占比高达86.36%,节距集中在3.6~4.9 cm。在赤星病方面,POP1有12.5%的个体发病指数在10以内,POP2发病指数均在10.1以上。在青枯病方面,两个类群病情指数主要处于0~5.0之间,POP1和POP2在此范围内的株数分别占比56.25%和81.82%,其中POP2发病指数均在15.0以下。由此可见,POP1的农艺性状变异范围大于POP2,POP2材料多表现为株高在210 cm以下,叶片数20~25,茎围10~11 cm,田间赤星病较严重,青枯病发病相对较轻。
3 讨 论
筛选出多态性较好的SSR分子标记是开展烟草SSR相关研究的基础。张铭真等[17]从250对引物中筛选出64对SSR引物,分析了81份烟草种质资源的遗传多样性,平均等位位点数为4.2个。马冰等[18]从2317对引物中筛选出24对核心引物对20份烤烟种质进行遗传多样性分析,平均等位位点数为3.54个。鞠馥竹等[19]从580对引物中筛选出43对多态性引物,平均等位位点数为3.39个。为充分利用前人研究成果,本研究利用42对已发表的多态性较好的SSR标记引物对38份烟草种质材料进行遗传多样性分析,筛选到22对引物在这些种质间存在多态性,检测到81条多态性扩增条带,平均等位位点数为3.68个,与前人研究相当,但较大程度减少了标记筛选工作量,提升了效率。Neis多样性指数平均为0.451,Shannon信息指数平均达0.789,说明这些引物总体上有较好的鉴别能力,种质材料具有较高的遗传多样性。
本研究所用种质材料包括国外引進种质、国内地方种质和本省自有突变体等,聚类分析和主成分分析发现红花大金元与大部分种质材料遗传距离大,可以考虑将其作为亲本材料拓宽遗传背景,发掘优异性状。聚类及遗传结构分析显示美国引进的种质材料遗传距离近,遗传背景相似,与MOON等[20]研究结果相一致。聚类分析未能将参试的38份种质材料划分成明显的类群,主成分分析初步显示38份材料可划分为2个类群,与类群2相比,类群1种质间变异和离散程度更大,这与类群遗传结构分析的类群间农艺性状及抗病性变异分析相一致。但是两个分类结果在云烟110、云烟97和Coker86 3个材料的类群划分上存在差异,造成这种差异的主要原因是两者分类依据不同。聚类分析依据的是烤烟材料间的遗传距离,反映其亲缘关系的远近;而群体遗传结构分类依据服从Hardy-Weinberg平衡的群体数目,基于数学模型之上,并计算各供试材料间相应的Q值[21]。因此,本试验利用Structure软件将供试烤烟材料分为2个类群,具有较高的准确性。此外,关联分析已广泛应用于大麦[22]、玉米[23]、小麦[24]、水稻[25]、花生[26]等作物的遗传育种研究,烟草与农艺性状[21]、抗病性[27]、致香物质[28]等方面的关联分析也大量出现,本研究可进一步在农艺性状、抗病性、化学成分等方面开展多年重复试验,寻找与性状紧密相关的标记,以用于分子标记辅助育种研究。
4 结 论
利用已发表多态性较好的42对烟草SSR标记引物对38份烟草种质材料进行分析,筛选到22对引物在这些种质间存在多态性,平均等位位点数为3.68个。参试的38份烟草种质具有较高的遗传多样性,UPGMA聚类分析显示红花大金元具有明显特异性。遗传结构分析显示,参试材料可分为2个类群,在农艺性状和抗病性方面,类群1变异范围大于类群2,类群2材料多表现为株高在210 cm以下,叶数20~25,茎围10~11 cm,田间赤星病较严重,青枯病发病相对较轻。本研究结果为提升SSR分子标记筛选效率和部分烤烟种质创新应用提供理论依据,并为进一步与农艺性状、抗病性、化学成分等方面开展关联分析奠定了基础。
参考文献
[1]中国农业科学院烟草研究所. 中国烟草栽培学[M]. 上海:上海科学技术出版社,2005.
Institute of Tobacco Research of CAAS. Tobacco cultivation in China[M]. Shanghai: Shanghai Science And Technology Press, 2005.
[2]张艇. 烟草种质资源的遗传多样性研究[J]. 农技服务,2010,27(1):101-103.
ZHANG T. Research on genetic diversity of tobacco germplasm resource[J]. Agricultural Technology Services, 2010, 27(1): 101-103.
[3]孙计平,吴照辉,李雪君,等. 21世纪中国烤烟种植区域及主栽品种变化分析[J]. 中国烟草科学,2016,37(3):86-92.
SUN J P, WU Z H, LI X J, et al. Analysis of regional variation and major varieties of flue-cured tobacco planted in China in the 21 century[J]. Chinese Tobacco Science, 2016, 37(3): 86-92.
[4]陈雅琼,王卫峰,丁安明,等. 基于SSR荧光标记分析我国主要审(认)定烤烟及白肋烟品种遗传多样性[J]. 中国烟草学报,2013,19(2):98-105.
CHEN Y Q, WANG W F, DING A M, et al. Analysis of genetic diversity in national listed tobacco varieties using SSR fluorescent marker data[J]. Acta Tabacaria Sinica, 2013, 19(2): 98-105.
[5]罗昭标,陈欢,毛华,等. 分子标记在烟草性状连锁基因定位中的应用进展[J]. 生物技术通讯,2014,25(1):139-142.
LUO Z B, CHEN H, MAO H, et al. Progress of the application of molecular markers in gene mapping of tobacco characters [J]. Letters In Biotechnology, 2014, 25(1): 139-142.
[6]尹国英,杨小燕,何其波,等. 鉴定烟草种质资源SSR核心引物筛选和验证[J]. 植物遗传资源学报,2013,14(5):960-965.
YIN G Y, YANG X Y, HE Q B, et al. Screen and identification of SSR core primers for tobacco germplasm[J]. Journal of Plant Genetic Resources, 2013, 14(5): 960-965.
[7]BINDLER G, VAN DER HOEVEN R, GUNDUZ I, et al. A microsatellite marker based linkage map of tobacco[J]. Theoretical and Applied Genetics, 2007, 114(2): 341-349.
[8]BINDLER G, PLIESKE J, BAKAHER N, et al. A high density genetic map of tobacco (Nicotiana tabacum L.) obtained from large scale microsatellite marker development[J]. Theoretical and Applied Genetics, 2011, 123(2): 219.
[9]叶兰钦,辛明明,杜金昆,等. SSR标记应用于烟草品种遗传多样性研究[J]. 中国农学通报,2009,25(1):56-62.
YE L Q, XIN M M, DU J K, et al. Genetic diversity revealed by SSR markers of the tobacco cultivars[J]. Chinese Agricultural Science Bulletin, 2009, 25(1): 56-62.
[10]陈夏晔,刘艳华,张兴伟,等. 抗黑胫病烟草种质的遗传多样性分析[J]. 中国农学通报,2014,30(7):58-63
CHEN X Y, LIU Y H, ZHANG X W, et al. Genetic diversity analysis on resistant tobacco germplasm to black shank disease[J]. Chinese Agricultural Science Bulletin, 2014, 30(7): 58-63.
[11]赖瑞强,李荣华,夏岩石,等. 烟草种质的SSR标记遗传多样性及青枯病抗性的关联分析[J]. 中国烟草学报,2018,24(6):67-77.
LAI R Q, LI R H, XIA Y S, et al. SSR marker-based genetic diversity analysis of tobacco germplasm and association analysis with resistance to bacterial wilt[J]. Acta Tabacaria Sinica, 2018, 24(6): 67-77.
[12]张兴伟,任民,刘艳华,等. 烟草核心引物的筛选[C]//中国烟草2013年学术年会论文集. 北京:中国烟草学会,2013:109-114.
ZHANG X W, REN M, LIU Y H, et al. Screening of SSR core primers with polymorphism on 12 tobacco accessions[C]//Proceedings of the 2013 China tobacco annual conference. Beijing: China Tobacco Society, 2013: 109-114.
[13]向世鹏,胡日生,周向平,等. 烟草种质资源黑胫病抗性鉴定及亲缘关系SSR分析[J]. 华北农学报,2016,31(1):156-161.
XIANG S P, HU R S, ZHOU X P, et al. Identification of resistance to black shank disease of tobacco germplasm resources and analysis of genetic relationship of SSR[J]. Acta Agriculturae Boreali-sinica, 2016, 31(1): 156-161.
[14]陈芳,徐世晓,李晓辉,等. 基于SSR标记的80份烟草种质指纹图谱的构建及遗传多样性分析[J]. 作物雜志,2019(1):22-31.
CHEN F, XU S X, LI X H, et al. Construction of molecular fingerprinting and analysis of genetic diversity for 80 tobacco (Nicotiana tabacum) germplasms[J]. Crops, 2019(1): 22-31.
[15]张铭真,邢雪霞,李晓辉,等. 烟草种质资源遗传多样性与群体结构分析[J]. 中国烟草科学,2016,37(4):42-47.
ZHANG M Z, XING X X, LI X H, et al. Analysis of genetic diversity and population structure of germplasm resources in Nicotiana tobacum[J]. Chinese Tobacco Science, 2016, 37(4): 42-47.
[16]EVANNO G, REGNAUT S, GOUDET J. Detecting the number of clusters of individuals using the software structure: a simulation study[J]. Molecular Ecology, 2005, 14(8): 2611-2620.
[17]張铭真,李晓辉,王袁,等. 81份烟草种质资源遗传多样性分析[J]. 江西农业学报,2017,29(1):62-68.
ZHANG M Z, LI X H, WANG Y, et al. Analysis of genetic diversity of 81 tobacco germplasm resources[J], Acta Agricultural Jiangxi, 2017, 29(1): 62-68.
[18]马冰,代帅帅,程亚增,等. 烤烟种质资源SSR核心引物的筛选及验证[J]. 中国烟草科学,2016,37(5):1-5,9.
MA B, DAI S S, CHENG Y Z, et al. Screen and identification of SSR core primers for flue-cured tobacco germplasm[J]. Chinese Tobacco Science, 2016, 37(5): 1-5, 9.
[19]鞠馥竹,赵文涛,刘元德,等. 不同产区晾晒烟资源多样性的鉴定与评价[J]. 中国烟草科学,2019,40(2):8-15.
JU F Z, ZHAO W T, LIU Y D, et al. Identification and evaluation of the diversity of air/sun-cured tobacco germplasm resources in different producing areas[J]. Chinese Tobacco Science, 2019, 40(2): 8-15.
[20]MOON H S, NIFONG J M, NICHOLSON J S, et al. Microsatellite-based analysis of tobacco (Nicotiana tabacum L.) genetic resources[J]. Crop Science, 2009, 49: 2149-2159.
[21]童治军,陈学军,方敦煌,等. 231份烤烟种质资源SSR标记遗传多样性及其与农艺性状和化学成分的关联分析[J]. 中国烟草学报,2017,23(5):31-61.
TONG Z J, CHEN X J, FANG D H, et al. SSR marker-based analyses on genetic diversity and relevant variations of agronomic traits and chemical composition of 231 flue-cured tobacco germplasm resource[J]. Acta Tabacaria Sinica, 2017, 23(5): 31-61.
[22]IVANDIC V, HACKETT C A, NEVO E, et al. Analysis of simple sequence repeats (SSR) in wild barley from the fertile crescent: associations with ecology, geography and flowering time[J]. Plant Molecular Biology, 2002, 48: 511-527.
[23]FLINT-GARCIA S A, THUILLET A C, YU J, et al. Maize association population: a high-resolution platform for quantitative trait locus dissection[J]. The Plant Journal, 2005, 44(6): 1054-1064.
[24]ROY J K, BANDOPADHYAY R, RUSTGI S, et al. Association analysis of agronomical important traits using SSR, SAMPL and AFLP markers in bread wheat[J]. Current Science, 2006, 90(5): 683-689.
[25]AGRAMA H A, EIZENGA G C, YAN W. Association mapping of yield and its components in rice cultivars[J]. Molecular Breeding, 2007, 19(4): 341-356.
[26]李东霞,石鹏,杨伟波,等. 利用SSR分子标记分析海南与国内外花生种质资源的遗传多样性[J]. 广东农业科学,2015,42(20):118-124.
LI D X, SHI P, YANG W B, et al. Analysis of genetic diversity in peanut(Arachis hypogaea L.)germplasm resources from Hainan and other regions by using SSR markers[J]. Guangdong Agricultural Sciences, 2015, 42(20): 118-124.
[27]丛鑫,刘艳华,戴培刚,等. 抗PVY烟草种质的遗传多样性分析[J]. 植物遗传资源学报,2014,15(3):679-684.
CONG X, LIU Y H, DAI P G, et al. Genetic diversity analysis of tobacco germplasm resistance to PVY[J]. Journal of Plant Genetic Resources, 2014, 15(3): 679-684.
[28]任民,张长静,蒋彩虹,等. 基于高密度SSR连锁群的烟草致香物质关联分析[J]. 中国烟草学报,2014,20(4):88-93.
REN M, ZHANG C J, JIANG C H, et al. Association analysis of tobacco aroma constituents based on high density SSR linkage group[J]. Acta Tabacaria Sinica, 2014, 20(4): 88-93.
基金项目:江西省烟草公司科技项目“烟草种质资源的收集引进与种质库建立”(201401001)
作者简介:丁永亮(1990-),男,农艺师,硕士,从事烟草育种及生物技术研究。E-mail:yld9001@163.com
*通信作者,E-mail:zhangqiming1979@163.com
收稿日期:2019-10-23 修回日期:2020-02-14
