骶前肿瘤手术治疗情况及临床特点分析*
2020-05-25辛诚王志彬郑阔郑楠薪周继点高显华郝立强张卫
辛诚,王志彬,郑阔,郑楠薪,周继点,高显华,郝立强,张卫Δ
1 海军军医大学附属长海医院肛肠外科 上海 200433
2 海军军医大学基础医学院 上海 200433
骶前肿瘤发病率低,Mayo Clinic 曾报道平均40 000例住院患者中仅有1例骶前肿瘤患者,目前首选的治疗方式为手术切除[1]。由于该类肿瘤位于骶前间隙这一空间狭小且容易出血的特殊解剖位置,手术难度大。此外,骶前肿瘤手术入路多,根据肿瘤大小及位置的不同可选择经骶入路、经腹入路、经腹骶联合入路等手术方式,近年来随着微创技术的进步,出现了腹腔镜、机器人辅助腹腔镜骶前肿瘤切除术等新术式[2]。骶前肿瘤手术路径的选择尚无定论,仍然是一个困扰大家的难题。本文通过回顾性分析长海医院肛肠外科收治的57 例骶前肿瘤患者临床资料,对骶前肿瘤手术治疗情况和病理类型进行深入的分析,以期为临床制定手术方案提供参考,现报告如下。
1 资料与方法
1.1 一般资料
研究纳入2009年9月至2019年12月在长海医院肛肠外科行手术治疗的57 例骶前肿瘤患者为研究对象,患者入院时以肛门坠胀感、排便困难、骶尾部疼痛为主要症状。其中:男性14例,女性43例;年龄18~80 岁,平均(45.2±13.4)岁;初发患者54例,外院曾行手术3 例(1 例未完整切除肿瘤,2 例术后复发)。
1.2 术前检查
所有患者入院后均予直肠指诊,大部分患者可通过直肠指诊了解肿瘤大小、质地及范围。57 例患者中19例行CT检查,39例行MRI检查(见图1),4例行直肠腔内超声检查,5例兼行CT和MRI检查。
1.3 手术方法
1.3.1 经骶入路 患者采用折刀分腿位,根据肿瘤部位和大小选择切口位置及长度。一般选择经骶骨旁竖切口或经尾骨下缘横弧形切口,切开皮肤及皮下组织,切开部分臀大肌,采用锐性+钝性方法将肿瘤与邻近组织分离,结扎分支血管,切除肿瘤。创面彻底止血、冲洗,在最低处放置负压引流管,分层关闭手术切口(见图2)。

图1 骶前肿瘤典型MRI表现(红色箭头指向区域为肿瘤)

图2 经骶入路骶骨旁竖切口外观
1.3.2 经腹入路 患者采用膀胱截石位,取下腹正中切口。逐层进入腹腔,进入直肠后间隙找到骶前肿瘤并分离。分离过程中尽量不要损伤直肠壁致肠腔破裂,骶前分离时注意保护两侧输尿管、骶前静脉、下腹下神经及两侧血管神经束。切除肿瘤后创面彻底止血、冲洗,在最低处放置负压引流管,分层关闭手术切口。
1.3.3 经腹骶联合入路 同时使用经骶和经腹两种入路,分别由肿瘤下缘和上缘开始分离并最终汇合,具体手术方式同前所述。
1.3.4 机器人辅助入路 患者采用膀胱截石位,头低足高右倾位。采用四孔法布局:脐上3 cm 偏右侧3 cm处置入12 mm Trocar(观察孔);观察孔偏右下不少于8 cm置入8 mm Trocar作为第一机械臂主操作孔(Ⅰ臂);反麦氏点处置入8 mm Trocar 作为第二机械臂操作孔(Ⅱ臂);助手的辅助孔(A 孔)选择在观察孔平面与左锁骨中线交汇处。建立气腹后游离直肠进入直肠后间隙,找到骶前肿瘤并分离,操作要点同前经腹入路。
1.4 统计方法
使用SPSS 24.0软件进行数据分析。符合正态分布的计量资料以(xˉ±s)表示,非正态分布则以M(QL,QU)表示,采用t检验或Mann-WhitneyU检验。分类变量用(n)或[n(%)]表示,采用χ2检验或Fisher确切概率法进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 手术情况分析
57 例患者均通过手术完整切除肿瘤,其中经骶入路37 例,经腹入路17 例,经腹经骶联合入路2例,机器人辅助腹腔镜切除术1例。经骶入路与经腹入路两组患者的年龄、性别、住院时间、并发症发生情况及病理类型比较,差异均无统计学意义(均P>0.05)。经骶入路组手术时间、术中出血量少于经腹入路组,肿瘤直径小于经腹入路组,差异均有统计学意义(均P<0.05)。见表1。
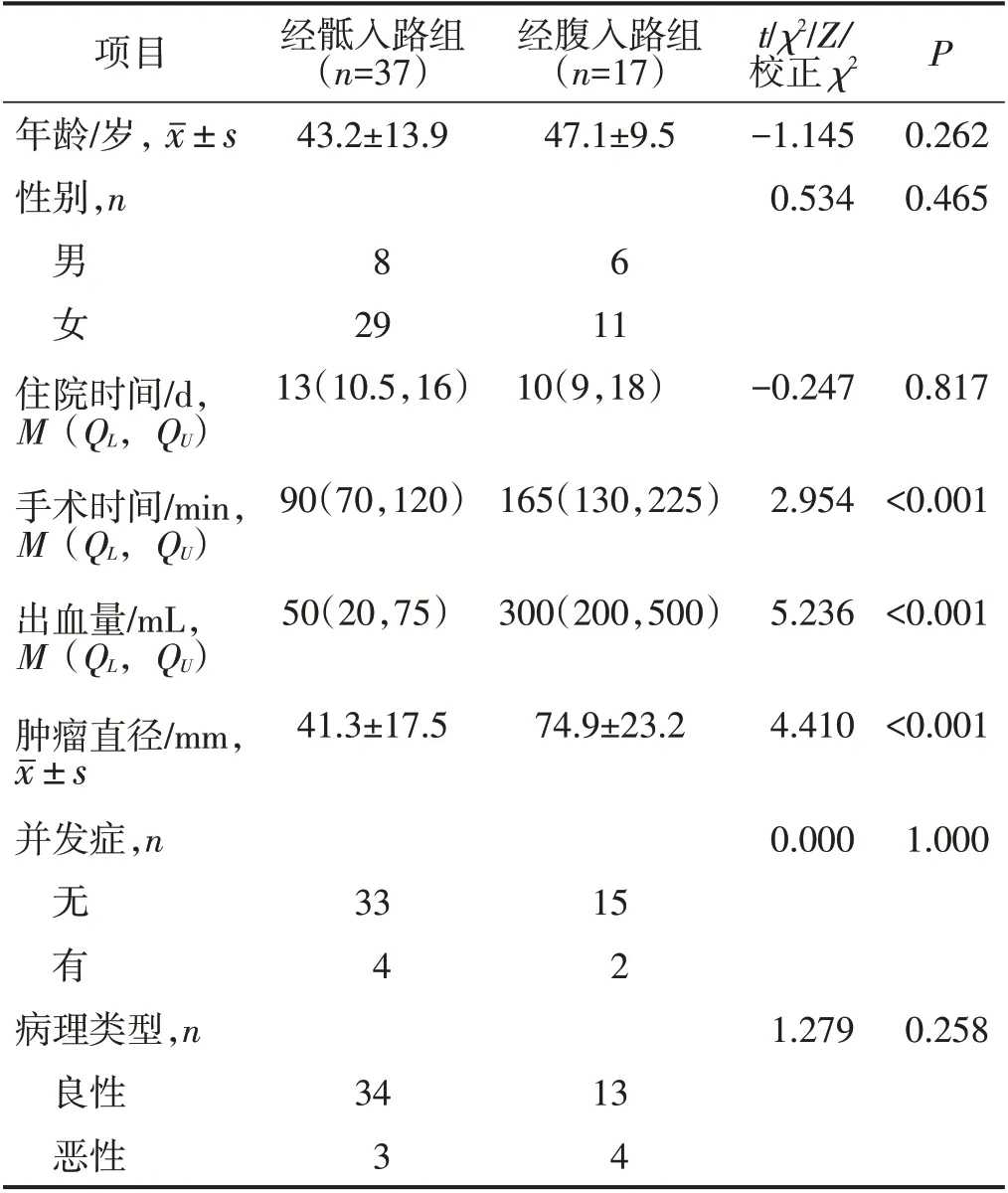
表1 经骶入路组与经腹入路组患者临床资料比较
以所有入组患者肿瘤直径的中位数5 cm 为界值,将本次研究对象分为两组,比较两组之间手术时间和手术入路的差异,结果显示肿瘤直径>5 cm组手术时间较长,手术方式以经腹入路为主,差异均有统计学意义(均P<0.05),见表2。此外,57 例患者中肿瘤下缘距肛缘距离≤7 cm(近腹膜返折水平)共48例,其中采用经骶手术入路34例,经腹手术入路12 例,经腹骶联合入路2 例;肿瘤下缘距肛缘距离>7 cm 有9 例,其中5 例经腹入路,3 例经骶入路,1 例机器人辅助手术。当肿瘤下缘距肛缘距离≤7 cm且肿瘤直径>5 cm 时共有18 例,其中经腹入路10例,经骶入路6例,经腹骶联合入路2例。
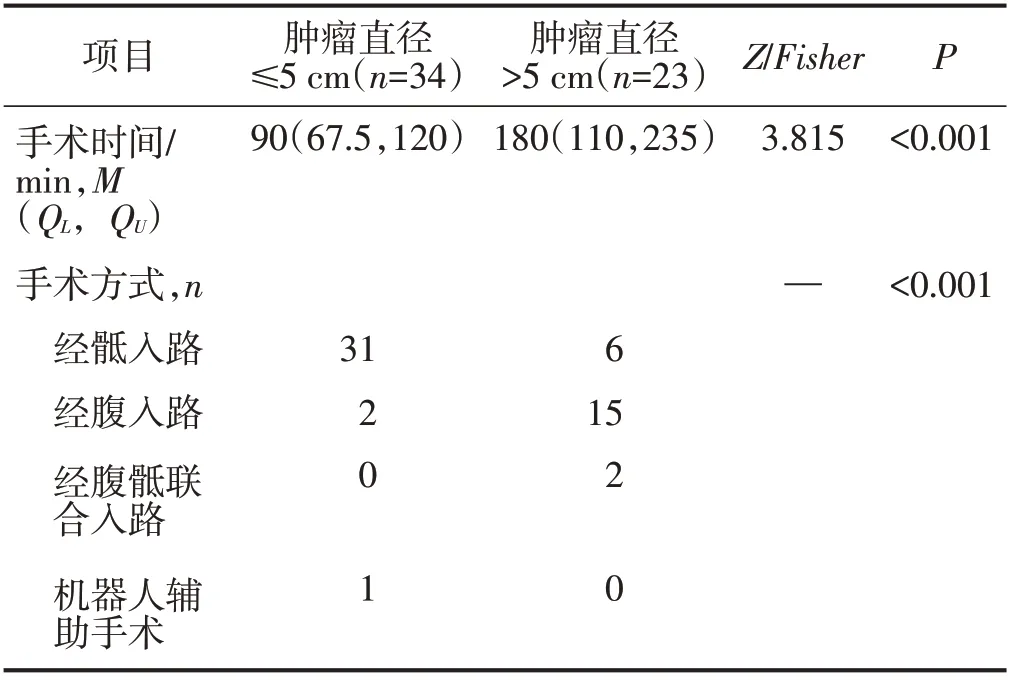
表2 两组手术时间及手术入路分析
所有57 例患者共有6 例出现并发症,包括骶前出血1 例,切口感染3 例,泌尿系统感染2 例,所有患者经治疗后恢复良好。经骶入路组手术患者中有1例老年糖尿病患者术后切口感染、延迟愈合,经外科引流、换药后痊愈,共住院43 d。经腹入路手术组有1例由于肿瘤巨大,位置较深,剥离过程中出现骶前出血1 300 mL,术中予以输血,经压迫、电凝及缝合成功止血。有2例由于肿瘤侵犯肠壁,术中切除部分肠段,行回肠造口术1例,乙状结肠造口术1例。
2.2 术后病理结果
57 例患者术后病理结果包含16 种不同的类型,参考已有研究的分类标准[3-7],分为以下五类:先天性肿瘤、神经源性肿瘤、炎性组织、恶性肿瘤及其他类型肿瘤,其中以先天性表皮样囊肿最多见,有29例。见表3。
2.3 骶前肿瘤患者的主要症状
57 例患者术前主要症状有肛门坠胀感、排便困难、骶尾部疼痛、里急后重、排尿不畅等,部分患者同时存在多个症状,部分患者无任何不适,于健康体检时发现肿块。根据术后病理结果将57 例患者按照良性肿瘤和恶性肿瘤分为两组,49 例良性肿瘤患者中肛门坠胀感最多见(32 例),8 例恶性肿瘤患者中4 例有骶尾部疼痛,肛门坠胀、排便困难各3例。见表4。

表3 病理类型统计

表4 骶前肿瘤患者的主要症状n
2.4 随访结果
患者术后均予门诊随访,定期行MRI 或CT 检查。随访期间共有5 例复发,2 例为本院首次手术者,其中1例病理类型为表皮样囊肿患者于术后1年复发,在当地医院再次行手术切除;另1例恶性肿瘤患者于术后6个月复发,拒绝后续治疗。3例为外院术后本院再次手术者,其中1例患者首次外院手术时由于肿瘤巨大(直径约12 cm),无法将肿瘤完整切除,手术中抽尽囊内容物、灌注无水酒精,术后又行两次穿刺注射无水酒精,试图损毁囊内壁来达到治疗效果,治疗后1年内肿瘤复发,笔者团队二次手术中发现由于之前灌注过无水酒精,囊肿与周围组织粘连非常严重,无法分离,后采用打开囊壁抽取完囊内容物后,在囊内壁的指引下逐步剥离整个肿瘤,二次手术后随访至今已有3年,未出现复发。
3 讨论
骶前肿瘤发生于骶前间隙,该处是直肠后方的一个潜在性间隙,其内是疏松的结缔组织[8-9]。骶前肿瘤临床上较为少见,据统计全球每年的发病率为0.25‱~1.40‱,且女性发病率更高[10]。骶前间隙包含多种胚胎残留组织,胚胎发育过程中在此融合,易致肿瘤发生[11]。本次研究纳入的57 例患者中男女比例约为1:3,包含16种病理类型,参考同类研究的分类[12],其中先天性肿瘤38例占66.7%,神经源性肿瘤5例占8.8%,恶性肿瘤8例占14%。
骶前肿瘤发生位置较为隐匿,早期一般无症状。当肿瘤不断增大,对周围盆腔组织产生压迫或移位时才出现症状[13]。本研究中有8例(14%)患者是在体检时偶然发现,多数患者出现明显症状后才来就诊[14]。患者以肛门坠胀感、排便困难及骶尾部疼痛为主要表现。恶性肿瘤表现与良性肿瘤不同,以骶尾部疼痛为主(4/8),当出现该症状时需警惕有恶变风险[15]。
骶前肿瘤的术前检查包括直肠指诊、直肠腔内超声、CT 及MRI[4,16]。直肠腔内超声在肿瘤位于中低位直肠后方水平时对诊断有一定帮助,尤其有助于明确肿瘤与肛门括约肌的关系。CT 可对骶前肿瘤的大小、范围、血管分布及周围组织如子宫、膀胱、输尿管及直肠的关系做出更准确的判断。MRI 对软组织肿瘤了解更为清晰,其横断面及矢状面图像更有利于术者了解肿瘤与骶前间隙的关系。此外,MRI对骶管及腰椎管来源的肿瘤辨别更为清晰[17]。
骶前肿瘤易与盆腔脓肿混淆,两者都可能伴盆腔坠胀感及疼痛。MRI 的表现也很相似,都为囊性或混合性包块,T1WI 低信号表达,T2WI 高信号表达,尤其在骶前囊肿并发感染的情况下,两者鉴别更为困难。有学者提出进行术前穿刺活检以明确肿瘤性质,但是否会人为造成肿瘤种植、转移,目前还无定论,因此穿刺活检应慎重[18]。
由于骶前解剖位置特殊,手术路径的选择十分重要。决定手术入路主要的因素是肿瘤的大小、位置及性质。目前常用的手术方式有经骶入路、经腹入路和经腹骶联合入路。经骶入路具有出血少、手术便捷等优点,本次研究中采用经骶入路患者手术时间、术中出血量均少于经腹入路组,同时该组患者肿瘤直径也小于经腹入路组,但是临床实践应注意并非所有骶前肿瘤都适合经骶入路。
本次研究中肿瘤较大者手术时间更长,多选择经腹入路手术,因经腹手术入路可获得更好的暴露视野和牵拉效果。有文献提出肿瘤下缘距肛门6 cm以上,肿瘤下缘高于骶骨岬的患者建议采用经腹入路,而肿瘤距肛缘7 cm 以下且体积较小的患者建议采用经骶入路[19],这与我们的结果基本一致。此外,也有学者提出肿瘤上缘位于S4以下的建议采用经骶入路。然而,我们发现部分骶前肿瘤位于S4以下,但不能通过经骶入路完全切除。有研究提出从S3下缘延伸到耻骨下缘的连线(S3—耻骨线)对手术入路的选择更为准确[20],因此,建议以S3—耻骨线作为经骶入路和经腹入路的分界点,对于S3—耻骨线以下的骶前小肿瘤,建议采用经骶入路,否则建议采用经腹入路[21]。对于恶性病变,经腹入路可切除潜在的受累淋巴结[22]。当骶前肿瘤侵犯骶尾骨时,适合经腹经骶联合入路。
骶前肿瘤术后仍有一定的复发率,本次研究纳入的57 例患者术后随访期间有5 例复发,经分析,考虑有以下几点原因:(1)术前评估不全,术中遗漏部分病灶。部分患者在术前缺乏影像学检查,尤其是缺少CT 或MRI 检查,此时术者对肿瘤的大小、数目、形态及与周围组织的关系很难进行准确判断。复习1例复发病例的术前MRI发现,该肿瘤为分叶状,在较大病灶深部还有一小病灶,可能因遗漏小病灶而导致复发。(2)肿瘤巨大,手术困难。5例患者中有4例肿瘤直径大于7 cm,部分肿瘤因并发慢性感染、腹腔粘连而导致分离困难。一旦在术中肿瘤破裂,未充分冲洗创面也会增加复发概率。(3)手术入路不合理。经骶入路手术虽然有出血少、手术便捷的优点,但同时存在视野暴露欠佳、对于大肿瘤切除困难的缺点。不合理的手术路径选择将人为造成切除困难,增加创伤,甚至因无法完整切除而造成复发。对于肿瘤较大,完全或部分位于S3—耻骨线以上的肿瘤,建议采用经腹入路或经腹骶联合入路的方式切除。(4)病理为恶性肿瘤,术后未行标准辅助治疗。1例患者术后病理提示为腺癌,但拒绝行标准的辅助化疗而导致复发。骶前恶性肿瘤应根据病理情况,采取标准的术后化疗、放疗来降低复发率。因而,全面精准的术前评估、对困难手术的充分准备、合理的手术路径选择及术后标准的辅助治疗都将有助于减少骶前肿瘤的术后复发。
综上所述,骶前肿瘤起病较为隐匿,病理类型多样,恶性病变往往伴有骶尾部疼痛症状。完整切除肿瘤是首选的治疗方式,因此术前需仔细评估肿瘤情况,根据肿瘤的大小、位置及性质选择合理的手术路径非常关键。