非小细胞肺癌新辅助靶向及免疫治疗研究进展和展望*
2020-05-25徐嵩赵世康任凡任典王延烨宋作庆陈军
徐嵩 赵世康 任凡 任典 王延烨 宋作庆 陈军
肺癌作为发病率和死亡率第一的恶性肿瘤,其患病人数仍在逐年上升。但据最新数据显示,肺癌死亡率近年来出现下降趋势,很大程度上得益于靶向治疗及免疫疗法的突破进展[1]。手术和放化疗作为肺癌的传统治疗方法,整体有效率比较有限。越来越多的指南推荐对于特定晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者可以应用靶向药物或免疫药物,力求使患者获益最大化。靶向治疗可以特异性识别有已知突变的肿瘤细胞,通过阻断其信号通路的传递,抑制和靶向杀伤肿瘤细胞[2]。吉非替尼的上市标志着肺癌治疗从传统的放化疗时代开始逐渐步入精准治疗模式。靶向治疗相比放化疗更加精准,副作用更低,且能显著延长患者无进展生存期(progression free survival,PFS)[3]。目前发现的主要突变靶点EGFR、ALK、ROS1、NTRK 等均已有获批的靶向药物,作用于其他靶点的相关药物临床试验也正在进行中[4-5]。免疫治疗不同于直接攻击癌细胞的靶向治疗,其通过“唤醒”患者自身免疫系统来清除肿瘤细胞。PD-1抑制剂纳武利尤单抗是全球首个获得监管机构批准的PD-1抑制剂。此后,另一个PD-1抑制剂帕博利珠单抗后来居上,现已获批14个癌种的23个适应证。其他的PD-1/PD-L1抑制剂药物也如同雨后春笋般纷纷上市,获批用于多种恶性肿瘤。
早在上个世纪,有临床医生提出“新辅助治疗”这一概念,即在患者接受手术之前,先给予化疗或放疗,使肿瘤体积缩小。通过新辅助治疗,在术前杀灭患者体内循环肿瘤细胞,降低肿瘤分期,可使患者获得远期生存获益[6]。NSCLC 荟萃分析协作组[7]汇总15 项非小细胞肺癌随机对照研究结果,发现术前新辅助化疗相比单纯手术可以降低相对死亡风险并能提高患者的5年生存率。除影像学评估之外,新辅助治疗后还可以通过手术标本进一步进行病理学评估。如果新辅助治疗后,手术切除的肿瘤或淋巴结中残余癌细胞<10%,即为主要病理缓解(major pathological response,MPR);如果未发现残余癌细胞,即达到完全病理缓解(pathological complete response,pCR)。病理学缓解率对于新辅助治疗的疗效评估更为重要,也更能反映治疗后的真实情况[8]。传统化疗和放疗用以NSCLC新辅助治疗的MPR或pCR率仅不足10%,提示其疗效非常有限[9-10]。目前,NSCLC 靶向和免疫治疗的临床研究大多关注于晚期患者,但也有部分临床研究探索是否可以将靶向治疗或免疫治疗作为早期可切除NSCLC 患者的术前新辅助治疗。本文汇总最新的NSCLC新辅助靶向及免疫治疗临床研究,探索NSCLC 术前新辅助治疗的疗效及不良反应,评估术前新辅助治疗能否为患者带来真正获益,并探讨术前新辅助治疗的未来发展趋势。
1 新辅助靶向治疗
1.1 靶向药物单药治疗
NCT01217619 研究[11]是一项前瞻性单臂Ⅱ期临床研究,纳入19 例ⅢA-N2 期伴有EGFR 突变的NSCLC 患者,旨在评估厄洛替尼在新辅助治疗中的疗效。14 例患者在服药8 周后接受手术治疗,其中13例达到根治性切除。术后病理降期比例为21.1%,客观缓解率(objective response rate,ORR)为42.1%,疾病控制率(disease control rate,DCR)为89.5%。50%的术后患者达到部分缓解(partial response,PR),其余患者达到疾病稳定(stable disease,SD)。手术患者的中位无病生存期(median disease free survival,mDFS)为10.3个月;接受新辅助治疗的19例患者,中位无进展生存期(median progression free survival,mPFS)及中位总生存期(median overall survival,mOS)分别是11.2 个月和51.6 个月。在新辅助治疗期间,36.8%的患者出现厄洛替尼相关不良反应,15.8%为3~4 级不良反应,不良反应中皮疹的发生率最高(26.3%)。
NCT01407822研究[12]是一项Ⅱ期随机对照研究,旨在对比厄洛替尼和传统化疗方案(吉西他滨+顺铂)作为新辅助治疗在NSCLC 患者中的疗效。研究纳入72例存在EGFR突变的ⅢA-N2期NSCLC患者,被随机分为化疗组(35例,其中1例中途退出)和厄洛替尼组(37 例)。两组患者中分别有24 例和31 例接受手术治疗。化疗组与厄洛替尼组患者的ORR分别为34.3%和54.1%,MPR 率为0 和9.7%,mPFS 为11.4个月和21.5个月,两组均无患者达到pCR。在新辅助治疗期间,厄洛替尼组中无3~4级不良反应,而化疗组中29.4%的患者出现了3~4级不良反应。
1.2 靶向药物联合放化疗
前瞻性Ⅱ期临床研究-Ascent 研究[13]纳入13 例Ⅲ期EGFR突变阳性NSCLC患者,探索阿法替尼联合标准新辅助治疗的疗效。受试者首先接受2 个月阿法替尼治疗,后接受同步放化疗。治疗后7例患者接受手术治疗,其余患者继续接受阿法替尼维持治疗。接受手术治疗患者的MPR率为57.1%,1例患者(14.3%)达到pCR。13 例患者整体ORR 为69%,mPFS为34.6个月,2年OS为85%。
2 新辅助免疫治疗
2.1 免疫单药治疗
在多中心单臂Ⅱ期临床研究-LCMC-3 研究[14]中,101例ⅠB-ⅢB期NSCLC患者接受PD-L1抑制剂阿替利珠单抗治疗。其中90 例患者接受手术治疗,术后ORR 为7%,MPR 率为18%(95%CI:11%~28%),pCR率为5%。2例患者出现了与治疗无关的5级不良反应(术后心脏疾病及疾病进展所致死亡),29例患者出现3~4级不良反应(6例与治疗相关)。
CheckMate-159[15]是一项单臂Ⅱ期临床研究,评估术前PD-1 抑制剂纳武利尤单抗的疗效。22 例Ⅰ~Ⅲ期可切除NSCLC 患者被纳入研究,其中20 例按原定计划接受免疫治疗。20例手术患者的ORR仅为10%,但MPR率达到45%(95%CI:23%~68%),pCR率为15%。术后中位随访时间为12 个月(0.8~19.7个月),3 例患者出现疾病进展(progressive disease,PD)。在新辅助治疗过程中,没有出现因免疫治疗引发的手术延迟,23%的患者出现了治疗相关不良反应,5%的患者为3~4级不良事件。
单臂Ⅰ期临床研究MK3475-223[16]探索PD-1抑制剂帕博利珠单抗作为新辅助治疗的疗效。研究中10 例可切除Ⅰ~Ⅱ期NSCLC 患者接受2 个周期的帕博利珠单抗治疗。术后MPR 率为40%(95%CI:16.7%~68.8%)。在治疗期间未出现因新辅助治疗引发的手术延迟,也未发生手术相关的并发症。
2.2 双免疫联合治疗
开放随机Ⅱ期临床研究-NEOSTAR 研究[17]评估了PD-1 抑制剂纳武利尤单抗联合CTLA-4 抑制剂ipilimumab 对比纳武利尤单抗单药的疗效。44 例Ⅰ~ⅡA 期NSCLC 患者被随机分入纳武利尤单抗组(N 组,n=23)或纳武利尤单抗联合ipilimumab 组(NI组,n=21)进行治疗。N 组患者术后ORR 为22%,MPR 率为17%,pCR 率为9%;NI 组患者术后ORR 为19%,MPR 率为33%,pCR 率为29%。N 组和NI 组患者治疗相关的3~4 级不良反应发生率分别为13%和5%。手术并发症方面,N组中2例患者出现支气管胸膜瘘,5 例患者出现气胸症状,NI 组中3 例患者出现气胸。
2.3 免疫药物联合化疗
NADIM 研究[18]是一项多中心单臂Ⅱ期临床试验,结果显示化疗联合纳武利尤单抗疗效良好。研究纳入46 例可切除ⅢA 期NSCLC 患者,所有患者均接受纳武利尤单抗、紫杉醇和卡铂的术前新辅助治疗。部分患者出现PD 或因不良反应终止试验,其余患者均完成完整治疗方案。最终41例患者接受手术治疗,均为R0(显微镜下无残留)切除。术后患者ORR 为78%,MPR 率为83%(95%CI:71%~95%),pCR率为71%。
NCT02716038研究[19]是一项单臂Ⅱ期临床研究,旨在评估化疗联合阿替利珠单抗对比化疗是否令患者获益增加。研究共纳入14 例ⅠB~ⅢA 期NSCLC患者,均在术前接受4 周期阿替利珠单抗、紫杉醇和卡铂的联合治疗。11 例患者成功接受手术治疗,其中1 例患者出现了与免疫治疗无关的术后并发症并导致死亡。患者的ORR 为57%,MPR 率为50%,pCR率为21%。中位随访时间8.6 个月(95%CI:3.5~17.8),期间4 例患者出现复发,其中2 例患者存在脑转移。新辅助治疗期间最常见的不良反应为中性粒细胞减少(12例患者出现3~4级中性粒细胞减少),9例患者因不良反应需减少化疗剂量。此外,1例患者出现了3级转氨酶升高,另1例患者被查出Ⅰ型糖尿病(治疗结束后1年)。
3 疗效与不良反应
手术切除是早期NSCLC 患者首选的治疗手段。然而,即使完整切除肿瘤后,患者的长期生存也不甚理想。根据国际肺癌研究协会TNM分期(第八版)数据,Ⅲ期NSCLC患者术后5年生存率不足30%,而ⅠB期患者术后5年生存率也仅为70%左右[20]。围手术期的治疗策略仍需要优化和提高。Frei 等[21]率先提出对头颈部癌、骨肿瘤、乳腺癌等实体肿瘤患者行“新辅助化疗”,即在给予局部治疗前先使用药物治疗。理论上,新辅助治疗可以减少肿瘤负荷达到术前降期的效果,使患者有机会接受根治性切除治疗,增加患者的手术获益[22];新辅助治疗还可以清除术前患者机体内存在的微转移病灶,减小患者复发几率,有效延长患者生存期[23]。相比化疗,靶向治疗和免疫治疗具有更高的缓解率和更低的不良反应,已被纳入晚期NSCLC 一线治疗。近年来,研究者们开始尝试使用靶向药物及免疫治疗药物作为新辅助治疗用药,探索这类治疗模式为患者带来的收益及风险。
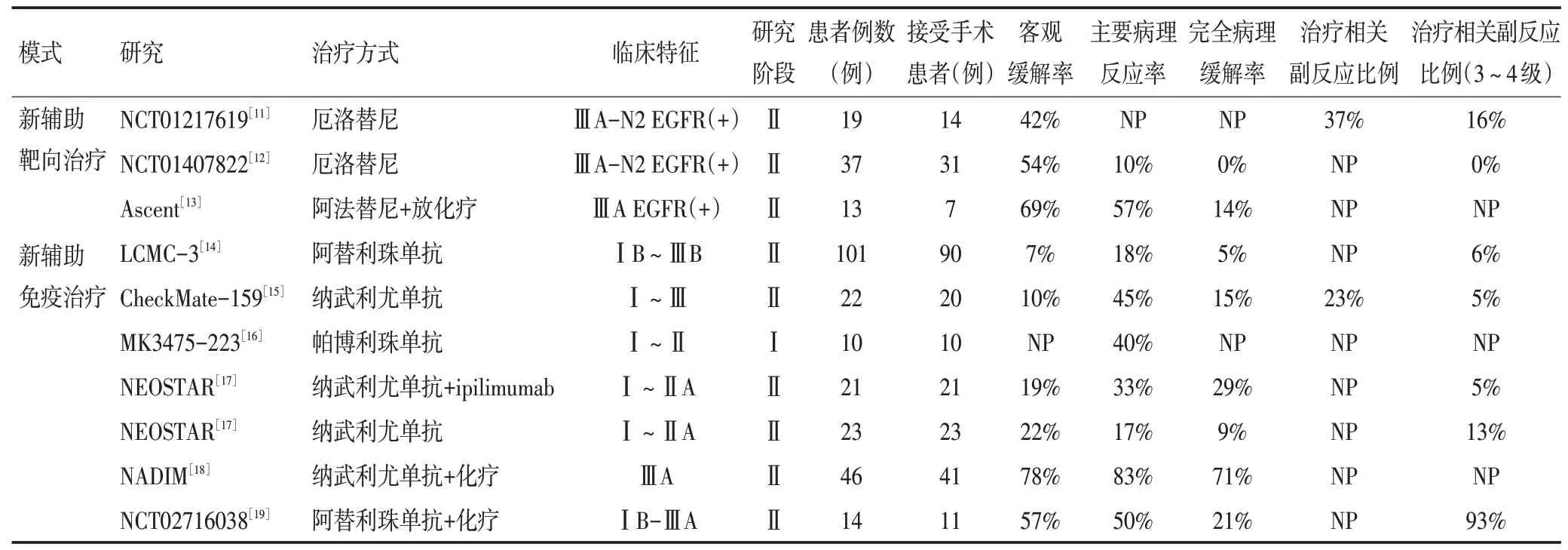
表1 新辅助靶向及免疫治疗临床实验数据
从汇总结果(表1)可以看出,术前无论是靶向治疗或是免疫治疗,患者均可以取得较放化疗更高的ORR 及pCR。且从数据总体趋势来看,患者在接受新辅助治疗后如果影像学ORR 较高,其获得病理学缓解的可能性更高。尽管靶向药物和免疫治疗药物的疗效均较化疗升高,但二者作为新辅助治疗的疗效仍存在差异。新辅助靶向治疗能为患者带来更高的影像学ORR,而接受新辅助免疫治疗的患者术后的MPR 率及pCR 率更高。既往的动物试验显示,手术前行新辅助免疫治疗,相比术后的辅助免疫治疗,可以令小鼠的整体生存时间显著延长[24]。据以往报道,NSCLC 患者术后的MPR 与DFS 和OS 呈正相关,这也提示可以将MPR作为新辅助治疗患者的预后因素[25-26]。因此,尽管靶向治疗对存在相应突变的患者更为“精准”,但新辅助免疫治疗也许能为患者带来更大生存获益。
任何治疗方案的生存获益都会与风险并存。相比新辅助免疫治疗,新辅助靶向治疗所导致的不良反应相对较低。但从总体数据上可以看出,除NCT02716038研究中3~4级治疗相关不良反应率较高,其余新辅助免疫治疗研究的3~4 级不良反应并不高。大多数患者可以在接受免疫治疗后接受手术治疗,即使存在药物相关不良反应,多数症状可通过治疗缓解,而不会造成显著的手术延迟或取消。此外,对于胸外科医生而言,围手术期并发症及手术难度也是十分重要的。从NEOSTAR 研究的数据来看,接受新辅助免疫治疗后40%的手术被认为更复杂,证明新辅助免疫治疗的确会增加手术难度。但在NEOSTAR 研究中,围手术期常见并发症(如气胸和肺炎)的发生率并未显著提高[17]。
4 潜在风险与未来发展
新辅助靶向和免疫治疗的疗效值得肯定,但仍存在一些问题值得特别关注。第一,有报道提示部分患者在新辅助治疗过程中,因PD 而无法接受后续治疗。医生需谨慎要考虑术前新辅助治疗的潜在风险。第二,靶向治疗虽可以特异性杀伤肿瘤细胞,且不良反应较低,但新辅助靶向治疗的pCR 并不高[12]。第三,目前新辅助免疫治疗临床研究的术前用药周期不一致,在2~4个周期不等。近期Liu等[27]通过小鼠动物模型发现,术前免疫治疗的时间会影响负瘤小鼠的生存。过长或过短的术前免疫治疗均会对疗效产生影响。上述研究提示对于术前新辅助治疗,仍需探索最佳的术前治疗时间。第四,在新辅助免疫治疗中,不同免疫治疗药物和治疗模式的pCR差异较大。综合目前临床研究数据来看,PD-1 抑制剂的疗效优于PD-L1 抑制剂,PD-1 抑制剂联合化疗的疗效优于PD-1 单药治疗。但这仍需要更多的临床研究数据来验证。第五,目前所有的新辅助免疫治疗临床研究,均无生物学标志物用以筛选NSCLC患者。未来,如果将PD-L1表达或肿瘤突变负荷(tumor mutation burden,TMB)等标志物纳入筛选标准,或许会进一步提高新辅助免疫治疗的疗效。第六,新辅助靶向或放化疗对于较为早期(例如Ⅰ期)的NSCLC 患者,应用价值并不突出。但免疫治疗的机制与靶向治疗不同,给予术前免疫治疗或许可以刺激机体产生针对肿瘤的特异性T 细胞[28]。这些T 细胞具有记忆效应,术后会产生持续监测和杀伤残余肿瘤细胞的作用[29-30]。因此,新辅助靶向治疗的最适用人群是Ⅱ~Ⅲ期可切除患者,而新辅助免疫治疗可能适合所有Ⅰ~Ⅲ期患者。但免疫治疗的用药时间和模式,需要根据患者的分期和肿瘤负荷情况而有所调整。
总之,相较于传统放化疗,术前新辅助靶向和免疫治疗的确为NSCLC 患者带来更高的疾病缓解率。但有关新辅助靶向和免疫治疗的临床研究仍不成熟,特别是患者术后的DFS 和OS 仍需进一步观察。新辅助靶向和免疫治疗所带来的手术相关风险困难(例如手术延迟和疾病进展等)和围手术期并发症,是外科医生较为担心的问题。此外,如何进一步“精准化”选择合适的患者,以及探讨更加高效且低毒的联合治疗模式,也是未来NSCLC 新辅助治疗的研究方向。无论如何,新辅助靶向和免疫治疗为早期可切除NSCLC 患者的术后长期生存带来了希望。未来仍需更多的转化研究和临床试验来进行深入的探究。
