基于平衡效应的多种吸附剂对CH4/N2分离性能研究
2020-05-25陈高飞汪亚燕张东辉
陈高飞,汪亚燕,张东辉*,鲁 博
(1.中国科学院理化技术研究所低温重点实验室,北京 100190;2.天津大学化工学院,天津 300350;3.山西晋城无烟煤矿业集团有限责任公司煤与煤层气共采国家重点实验室,山西 晋城 048000)
甲烷(CH4)作为一种清洁能源,可以用作燃料及生产氢气、炭黑等物质的化工原料,主要存在于天然气、煤层气、油田气、沼气和垃圾填埋气等资源中。CH4同时也是一种温室效应气体,同体积的CH4引起的温室效应是CO2的21倍,对臭氧的破坏能力是CO2的7倍。因此对CH4进行回收再利用具有经济、环境双重效益。分离过程中由于N2和CH4的临界温度都很低且物理性质相近,因此如何高效分离CH4和N2成了回收CH4的核心问题[1]。
目前分离CH4/N2的技术主要有低温深冷、变压吸附(PSA)和膜分离等。低温深冷分离技术基础投资大,运行费用较高,在分离规模较大时(百万立方米/天)比较经济[2-3];膜分离对制膜技术依赖性强,膜本身可能存在易淤塞、易损坏、使用寿命短等问题,该技术仍处于开发阶段[4-5];基于平衡效应和基于动力学效应的PSA技术分别利用CH4/N2在吸附剂上平衡吸附量的差异和CH4/N2进入吸附剂孔内的速率不同进行分离,大多数PSA分离过程都是基于平衡效应完成的。该技术能耗低,操作灵活,常温下连续运行,只要选取合适的吸附剂,该技术对分离CH4/N2体系将具有较大优势[6-9]。基于平衡效应分离,Olajossy等[10]以活性炭为吸附剂,采用真空PSA方法分离煤层气中的CH4,在278K,吸附压力为300kPa下,将原料气中55.2%的CH4富集到96%~98%,回收率为86%~91%;Saleman等[11]采用双回流PSA工艺,以活性炭为吸附剂对甲烷含量为2.4%~49.6%的代表性排放气源进行了富集,将原料气中49.6%的CH4富集到65.9%,回收率为99%;Tang[12]、Yi[13]和Dreisbach[14]等对活性炭吸附CH4/N2也做了详细研究。Bakhtyari等[15]以5A为吸附剂,采用静态容积法测得CH4、N2纯组分以及混合组分在5A上的吸附量;Cavenati等[16-18]测得CH4/N2/CO2在13X上的吸附量并在吸附塔内填充双层吸附剂13X和炭分子筛(CMS)对三组分进行分离;McEwen[19]、Li[20]和Delgado[21]等分别研究了基于平衡效应的13X、硅沸石以及丝光沸石对CH4/N2的分离性能。基于动力学效应分离,Fatehi等[22]采用CMS吸附剂对进料组成为60%CH4/40%N2和92%CH4/8%N2两种原料气进行分离,最优条件下CH4纯度分别提高到75.84%和96.25%;Cavenati[23]、Bhadra[24]和席芳[25]等分别就CMS富集垃圾填埋气中CH4、ETS-4和CMS对CH4/N2分离性能比较以及CMS在分离CH4/N2体系方面的进展进行了详细论述。除了CMS,斜发沸石分子筛在CH4/N2动力学分离过程中也表现出较好的分离效果。Ackley等[26-27]和Kouvelos等[28]分别从斜发沸石改性以及吸附量测定方面分析了其对CH4/N2的分离效果。
本文利用PSA技术,采用基于平衡效应的多种吸附剂,研究了CH4、N2在活性炭、5A、13X、LiX、硅沸石、硅胶、ZSM-5等7种吸附剂上的吸附性能。测得CH4、N2在这7种吸附剂上的吸附量,并用Langmuir方程对吸附量数据进行拟合,得到相应的Langmuir方程拟合参数以及CH4、N2在各个吸附剂上的吸附等温线。最后对CH4、N2在这7种吸附剂上的吸附量、选择性及吸附热进行分析,为PSA技术分离CH4/N2提供指导。
1 实验部分
1.1 实验材料
本文中活性炭、硅沸石及硅胶吸附剂为实验室自制,5A(HYGB500A)、13X(HYZ10E)和LiX(HYGB100C)购自上海恒业分子筛股份有限公司,ZSM-5购自南开大学催化剂厂。7种吸附剂的比表面积、孔容、平均孔径等参数见表1。
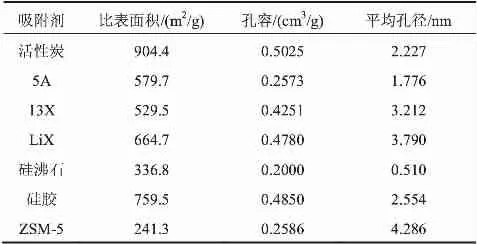
表1 吸附剂物性参数表
1.2 吸附量测定
本文采用静态容积法测量CH4和N2在各个吸附剂上的平衡吸附量。其原理是利用未发生吸附前系统的气体总量与达到平衡后系统内气体量的差值,结合压力与PVT状态方程,得到组分在不同温度下的气体吸附量。图1为静态容积法装置图,其中,置于恒温水浴锅内的参比槽与吸附槽为主体测试单元,材质为304不锈钢,容积均为60mL;压力传感器记录系统内压力变化,精度为0.05%;真空泵进行解吸。实验步骤如下:
1)实验开始前,先将吸附剂置于一定温度下活化;
2)称取一定质量吸附剂m装填在吸附槽内,检验装置气密性并测定系统的自由体积Va;
3)设定恒温槽温度,关闭阀门V1,打开阀门V4,对吸附槽进行解吸,完毕后关闭所有阀门;
4)打开阀门V1、V2对参比槽进行充压,达到设定值后关闭阀门V1,待示数平稳后记下压力值Ph,1(第1次升压时的压力值);
5)打开阀门V3,当吸附槽和参比槽内的压力不变时,表明系统已达到吸附平衡状态,记下此时的压力值Pe,1(第1次均压时的平衡压力值),关闭阀门V3;
6)重复步骤4)~5),测定不同温度,不同吸附剂下的吸附量。
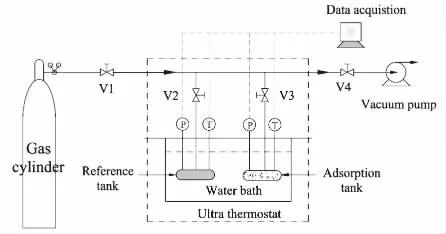
图1 静态容积法装置图
根据上述实验结果结合吸附量计算方程,可得到一定温度、压力下气体在不同吸附剂上的吸附量,方程如下:

式中:Ph,i为第i次升压的压力,Pa;P0,i为第i次前的初始压力,Pa;Pe,i第i均压后的平衡压力,Pa;Vr为参比槽的体积,m3;Va为吸附槽的自由体积,m3;qi为一定温度压力下组分i在吸附剂上的吸附量,mol/kg;m为吸附槽内装填吸附剂的质量,kg。
1.3 Langmuir模型
描述吸附等温线的方程较多,这里采用Langmuir方程进行拟合,得到CH4/N2在不同吸附剂上的拟合参数,方程如下:

式中:q是气体在吸附剂上的平衡吸附量,mol/kg;qm是单层饱和吸附量,mol/kg;B是吸附常数;P是压力,Pa。
1.4 IAST模型
理想吸附理论(IAST)是指通过单组分的吸附数据预测多组分的竞争吸附情况。
根据理想吸附溶液理论,扩张压力为:

简化扩张压力:

式中:πi为扩张压,Pa;πi*为简化扩张压,Pa;A为单位质量吸附剂上的表面积,m2/kg;R为理想气体常数;ni为压力p时混合体系中i组分的吸附量,mol/kg;pi0为纯组分i在和吸附相具有相同扩张压π时所具有的平衡压力。
理想溶液吸附理论遵循拉乌尔定律,即[29]:

式中:xi,yi为混合体系中i组分在吸附相和气相中摩尔分数。
对于多组分气体,当其混合体系达到平衡时,简化扩张压相同,即:

另外,多组分混合体系满足[30]:

代入Langmuir方程,根据上述(6)~(10),可以求得xi,pi0。
并且:

式中:nt为混合体系的总吸附量,ni0为纯组分气体i在pi0上的吸附量。
由(11)~(12)可以求得混合体系中各组分的吸附量。
2 结果与讨论
2.1 吸附量
表2是CH4/N2在各个吸附剂上的Langmuir方程拟合参数。
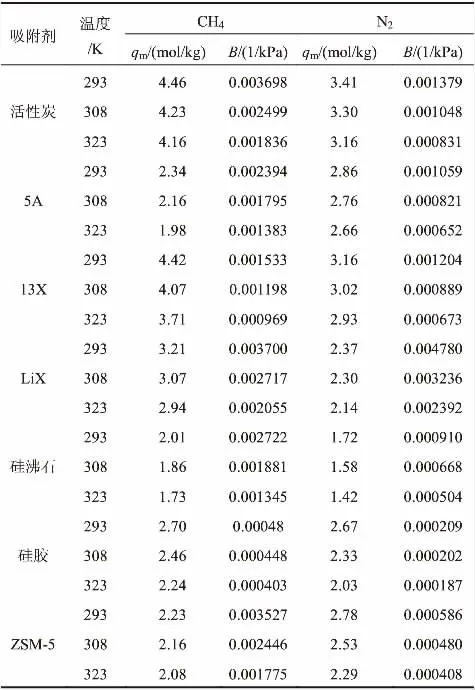
表2 Langmuir方程拟合参数
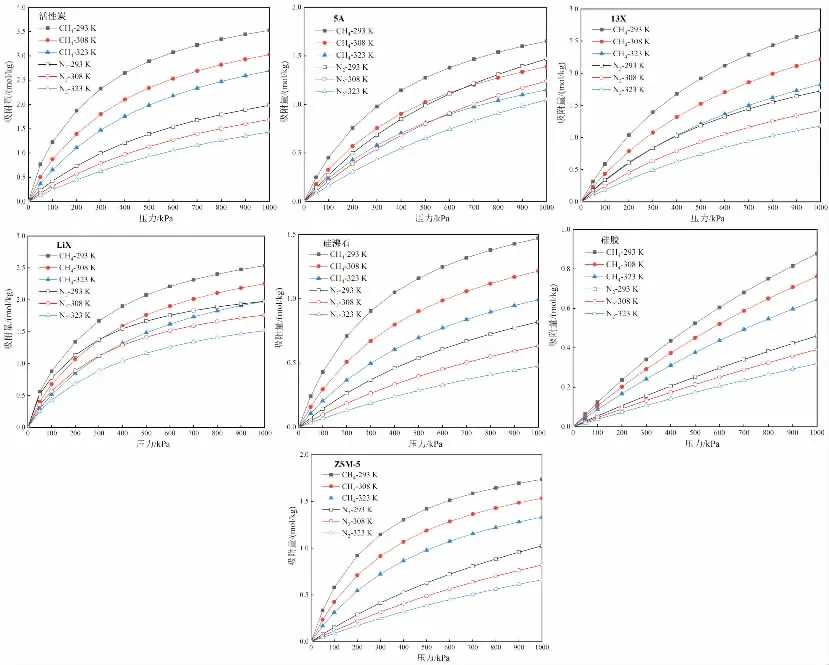
图2 CH4/N2在各个吸附剂上的吸附等温线

图3 各个吸附剂上CH4/N2吸附量对比
图2为293K、308K及323K下,CH4和N2在活性炭、5A、13X等7种吸附剂上的吸附等温线。由图可知,CH4在这7种吸附剂上的吸附量都大于N2的吸附量,而且CH4、N2的吸附等温线都属于I型,其在各个吸附剂上的吸附量数据都能够很好地用Langmuir方程关联。由表2可以看出,CH4、N2的qm和B都随着温度的升高而降低,导致吸附量随温度升高而降低。图3为293K、100kPa下,CH4、N2在这7种吸附剂上的吸附量,对比可知,CH4的吸附量从大到小依次为活性炭>LiX>13X>ZSM-5>5A>硅沸石>硅胶,N2的吸附量从大到小依次为LiX>活性炭>13X>5A>ZSM-5>硅沸石>硅胶。活性炭和LiX对CH4均表现出较大的吸附量,但是LiX上N2的吸附量最大,导致CH4与N2难以分离,而活性炭上N2的吸附量较小,可以实现分离。因此,从吸附量的角度考虑,活性炭为较优的分离材料,既能有效富集CH4,又能起到分离CH4/N2的作用。
2.2 选择性
研究吸附材料的平衡吸附选择性,旨在判断是否可以利用其平衡效应来分离混合气体。一般认为,选择性>2,就可以进行吸附分离,选择性越大,分离效果越好。两组分气体在吸附剂上的吸附选择性定义如下:

式中:x1和y1分别为组分1在吸附相和气相中的摩尔分数;x2和y2分别为组分2在吸附相和气相中的摩尔分数。
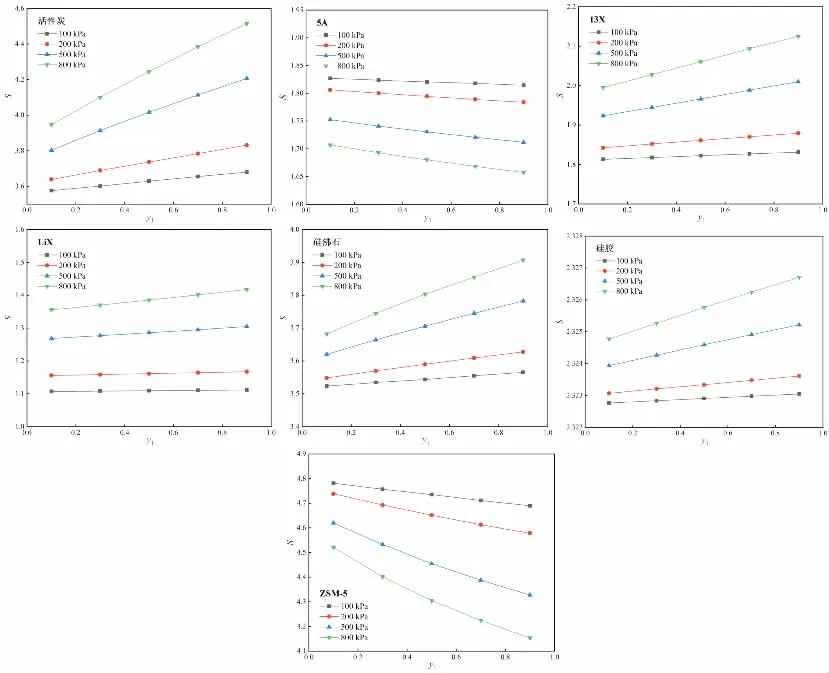
图4 CH4对N2的选择性随y1变化(293K)
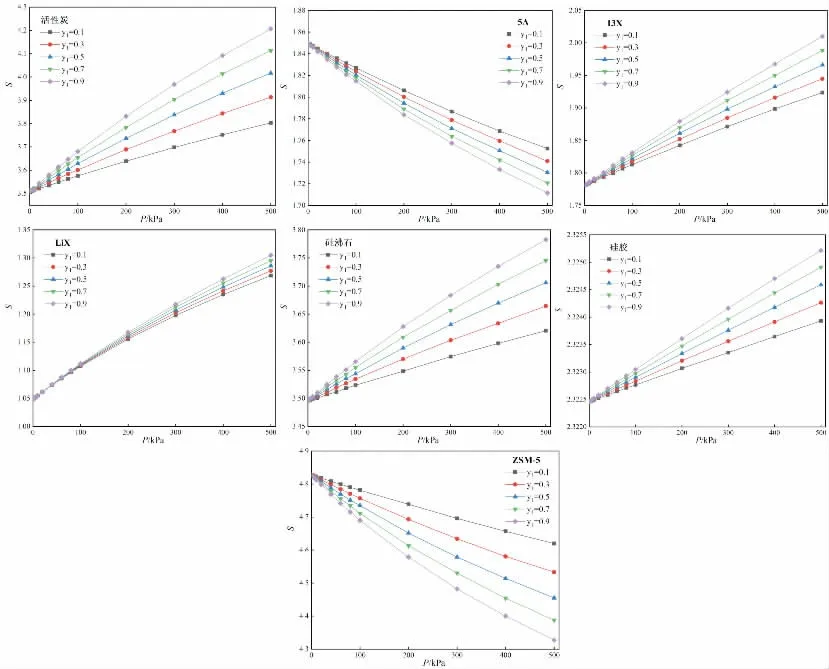
图5 CH4对N2的选择性随压力P变化(293K)
图4给出了293K下,CH4对N2的选择性随y1(CH4在气相中的摩尔分数)的变化,图5给出了293K下,CH4对N2的选择性随压力P的变化。由图4可知,相同CH4摩尔分数下,随着压力增加,活性炭、13X、LiX、硅沸石、硅胶等吸附剂上CH4对N2的选择性略有上升,而5A和ZSM-5上CH4对N2的选择性略有下降。由图5可知,相同压力下,随着CH4摩尔分数增加,活性炭、13X、LiX、硅沸石、硅胶等吸附剂上CH4对N2的选择性略有上升,而5A和ZSM-5上CH4对N2的选择性略有下降。这个变化趋势可以由CH4、N2在各个吸附剂上吸附等温线的增长趋势进行分析,当CH4的吸附量增长速度大于N2的吸附量增长速度时,CH4对N2的选择性就会上升,反之则会下降。由图2可知,CH4在活性炭、13X、LiX、硅沸石、硅胶等吸附剂上的吸附量增长速度要大于N2,因此随着压力增加,CH4对N2的选择性会上升,而CH4在5A和ZSM-5上的吸附量增长速度小于N2,因此随着压力增加,CH4对N2的选择性会下降。此外,由图4、图5还可以看出,活性炭、硅沸石、ZSM-5等吸附剂上CH4对N2的选择性较大,均大于3.5,因此,从选择性的角度考虑,活性炭、硅沸石、ZSM-5的分离效果较好。
2.3 吸附热
CH4、N2在各个吸附剂上的吸附热可根据吸附等温线,结合Clausius-Clapeyron方程计算得到,公式如下:

式中:△H为吸附热,J/mol;C为常数。
当吸附剂表面均匀且吸附质分子间无相互作用力时,吸附热与吸附量无关;若吸附剂表面不均一且吸附质分子间的相互作用不能忽略,则吸附热的大小会随着吸附量的改变而发生变化。由式(14)可计算得吸附热,表3给出了不同吸附量q下,CH4、N2在各个吸附剂上的吸附热值。由表可知,当吸附量相同时,CH4在活性炭、ZSM-5、5A等吸附剂上的吸附热要略大于N2,在13X、硅沸石等吸附剂上吸附热值与N2相近,而在LiX、硅胶等吸附剂上的吸附热要略小于N2。总的来说,虽然N2在各个吸附剂上的吸附量均小于CH4,但是N2的吸附热和CH4的吸附热可认为是接近的。这可能是由于在低压下CH4、N2与吸附剂之间的亲和力相近,而升高压力后使得CH4与吸附剂之间的亲和力增强,从而导致CH4的吸附量更大。
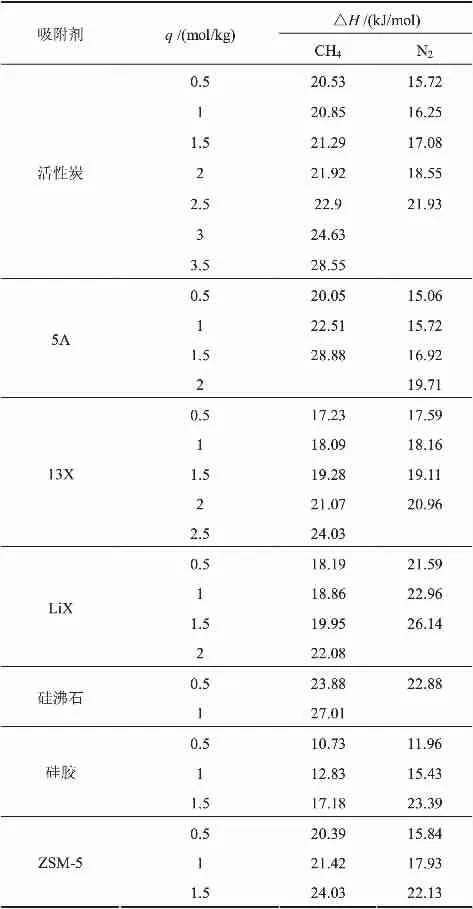
表3 CH4、N2的吸附热随吸附量的变化
3 结论
(1)采用静态容积法测定了293K、308K和323K三种温度下,CH4、N2在活性炭、5A、13X、LiX、硅沸石、硅胶及ZSM-5等7种吸附剂上的平衡吸附量,并采用Langmuir方程进行拟合。结果表明,Langmuir吸附模型能够很好描述CH4、N2在这些吸附剂上的吸附行为,并且活性炭上CH4吸附量大而N2吸附量小,因此从吸附量的角度考虑,活性炭为较优的分离材料。
(2)结合Langmuir方程与理想吸附理论计算了在不同气相组成及不同压力两种情况下,CH4、N2在各个吸附剂上的选择性大小。结果表明,在活性炭、硅沸石、ZSM-5等吸附剂上CH4对N2的选择性较大,均大于3.5,因此从选择性的角度考虑,活性炭、硅沸石、ZSM-5的分离效果较好。
(3)根据吸附等温线数据结合Clausius-Clapeyron方程得到了CH4、N2在各个吸附剂上的吸附热,由于吸附剂表面不均一且吸附质分子之间存在相互作用,使得吸附热大小随着吸附量的变化而改变。
综上,该研究从吸附量、选择性及吸附热等角度分析了CH4和N2在7种吸附剂上的吸附特征,有利于CH4、N2分离过程吸附剂的针对性选择以及具体PSA分离过程工艺的设计。
