NLRP3炎症小体及其相关炎症因子在高脂血症颈动脉样硬化家兔中的表达
2020-05-25刘孟楠杨思进胡钟竞刘平蒲玉婷
刘孟楠,杨思进,胡钟竞,刘平,蒲玉婷
动脉粥样硬化(AS)的发生起始于血管内皮损伤,而炎症反应存在于AS各个阶段[1]。近年来研究报道细胞焦亡作为固有免疫的重要部分,参与AS的进程并影响斑块的稳定性,因此减轻血管内皮细胞的细胞焦亡成为防治AS的重点[2]。核因子κB(NF-κB)是炎症反应中重要的转录因子,参与了AS炎症因子的表达。NOD样受体(NLR)家族中的NLRP3炎性小体作为固有免疫的受体或感受器,它的活化将激活含半胱氨酸的天冬氨酸蛋白水解酶1(Caspase-1)依赖的细胞焦亡,引起炎性因子白介素1β(IL-1β)及白介素18(IL-18)的释放从而起始AS的发生发展[2]。有研究表明,在高动脉粥样硬化风险如高血压、高血脂、糖尿病、吸烟的患者主动脉中炎性小体的表达明显增加[3]。因此,探究NLRP3炎症小体及相关炎症因子在动脉粥样硬化动物模型中的关系对于防治AS具有重要意义。
1 材料与方法
1.1 实验材料清洁级新西兰大白兔20只,体重1.6~2.2 kg,由西南医科大学实验动物中心提供。存放于西南医科大学动物实验中心,光照12 h/d,室温19℃~22℃,湿度40%~60%饲养。基础饲料、高脂饲料均由西南医科大学动物实验中心提供。BCA蛋白浓度测定试剂盒,蛋白裂解液(RIPA)(碧云天生物技术研究所,Beyotime Biotechnology,Shanghai,China);Tris-Hcl,N a C l(生工生物工程(上海)股份有限公司,Shanghai,China);PVDF膜(Millipore,Schwalbach,Germany);p65抗体(pSer536)(stj28018,St John's Laboratory,London,United Kingdom);p65抗体(arp38197_p050)、NLRP3抗体(arp63297_p050)、Caspase-1抗 体(a r p 5 8 9 8 3_p 0 5 0)、I L-1 β 抗 体(arp54323_p050),Aviva Systems Biology,San Diego,USA;IL-18抗体(paa064rb51 Cloud-Clone,Houston,USA);β-actin 抗体(Sigma, A2228);NF-κB ELISA试剂盒(abx362187,Abbexa,Cambridge,UK);IL-1β ELISA 试剂盒(E-EL-RB0013,Elabscience Biotechnology,Wuhan,China);IL-18 ELISA试剂盒(eku05257,Biomatik,Ontario,Canada);Berthold LB941微孔板式多功能酶标仪(Berthold公司);Western blotting系统(MINI-PTET,COMP SYS,10W,1.0MM、POWERPAC HC POWER SUPPLY、SEMI DRY BLOT APPARATUS,Bio-Rad公司);Tanon 6600发光成像工作站,Tanon公司。
1.2 实验方法
1.2.1 建立高脂血症颈动脉粥样硬化动物模型将20只实验兔经普通饲料适应性喂养1周,按随机数字表法分为对照组和模型组,每组各10只。对照组继续正常喂养,模型组术前禁食12 h,不禁水,经麻醉、颈部脱毛并清洁消毒后,作颈正中切皮,于甲状软骨上方分离左侧约2.5 cm长的颈总动脉。用动脉夹夹闭颈总动脉两端,在血管纵轴方向使用4.5号头皮针穿刺进入阻断血管的两端,生理盐水冲洗置换出管腔内的血液后,接上已调节好流量为250 ml/min的气流,干燥内皮5 min,然后将管腔内充满生理盐水并恢复血供。湿润棉片轻压止血后缝合皮肤创口并包扎[4]。术后肌注庆大霉素预防感染,使用由96%的普通饲料和2%的胆固醇以及2%的猪油配制而成的高脂饲料喂养4周建立兔高脂血症劲动脉粥样硬化模型。实验过程中,各组未出现厌食、消瘦、明显不能耐手术的表现及突发的急性死亡。
1.2.2 血脂检测造模术后4周后处死实验家兔,股动脉采血。血样在室温自然凝固,4℃ 3000 r/min离心10 min以分离血清。血脂采用全自动生化仪检测血清总胆固醇(TC)、三酰甘油(TG)水平。
1.2.3 颈动脉组织HE染色分离1cm长的颈动脉组织,经脱水、透明、浸蜡、包埋并制成4 μm石蜡切片,将干燥的石蜡切片进行二甲苯脱蜡,下行梯度乙醇水化,蒸馏水洗加入苏木精染色10 min,然后用流水冲洗并用盐酸乙醇褪色,伊红染色1 min,流水冲洗,切片经梯度酒精脱水干燥,二甲苯透明,中性树胶封片后进行拍照。
1.2.4 NLRP3蛋白及相关炎症因子检测采用Westernblot 法检测各组p-P65 NF-κB、p65 NFκB、NLRP3、pro-Caspase-1、Caspase-1、Pro-IL-1β、IL-1β、pro-IL-18及IL-18蛋白质表达水平;采用酶联免疫法测定实验兔血清NFκB、IL-1β及IL-18活性,按照试剂盒说明步骤操作。
1.3 统计与分析所有数据均采用GraphPad Prism 8.0软件分析,计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况家兔的一般状况良好,实验过程中,各组未出现厌食、消瘦、明显不能耐受药物副作用的表现及突发的急性死亡。正常组家兔饮食饮水可,自主活动良好,精神状态佳,反应灵敏,毛发较有光泽;模型组家兔饮食饮水可,精神状态及反应能力较正常组弱,自主活动减少,毛发光泽度差。各组实验兔体重呈生理性增长(表1)。
表1 各组实验兔不同时间体重比较(kg,±s)
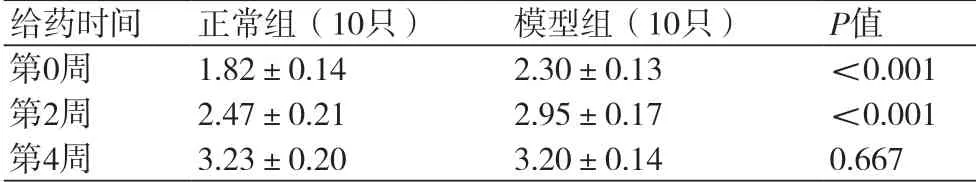
表1 各组实验兔不同时间体重比较(kg,±s)
给药时间 正常组(10只) 模型组(10只) P值第0周 1.82±0.14 2.30±0.13 <0.001第2周 2.47±0.21 2.95±0.17 <0.001第4周 3.23±0.20 3.20±0.14 0.667
2.2 血脂与正常对照组比较,模型组 TC、TG水平均显著升高,差异有统计学意义(P<0.001),提示高脂血症模型造模成功(表2)。
2.3 颈动脉形态学改变造模4周后,光镜下正常组颈动脉内皮完整,分界清晰,内膜光滑,平滑肌细胞完整,排列整齐;模型组颈动脉内大量脂质沉积并有向管腔内凸起的斑块,中膜内层出现断裂,平滑肌细胞显著增生,可见由大量泡沫细胞构成的脂质斑块,斑块内有炎症细胞浸润并有变性坏死,提示高脂血症动脉粥样硬化模型造模成功(图1)。
表2 各组实验家兔血脂水平比较(mmol/L,±s)
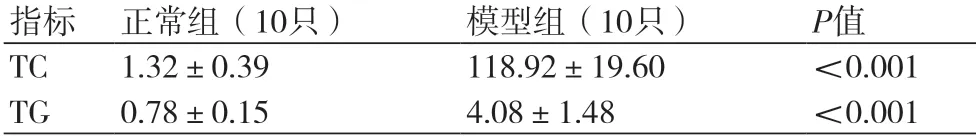
表2 各组实验家兔血脂水平比较(mmol/L,±s)
注:TC:总胆固醇;TG:三酰甘油
指标 正常组(10只) 模型组(10只) P值TC 1.32±0.39 118.92±19.60 <0.001 TG 0.78±0.15 4.08±1.48 <0.001
2.4 实验兔颈动脉组织焦亡指标及炎性指标的蛋白表达免疫印迹试验测得实验兔颈动脉组织模型组p-P65 NF-κB、NLRP3、Caspase-1、pro-IL-1β、pro-IL-18、IL-1β及IL-18 较正常值组表达显著上升,差异有统计学意义(P<0.001);pro-Caspase-1较正常组表达下降,差异有统计学意义(P<0.05);P65 NF-κB的表达较正常组表达升高,但差异无统计学意义(P>0.05)(图2)。
2.5 实验兔血清炎性指标的表达Elisa法测得实验兔血清模型组NF-κB、IL-1β及IL-18 较正常值组表达显著上升,差异有统计学意义(P<0.001)(图3)。

图1 颈动脉病理变化(HE,×100)
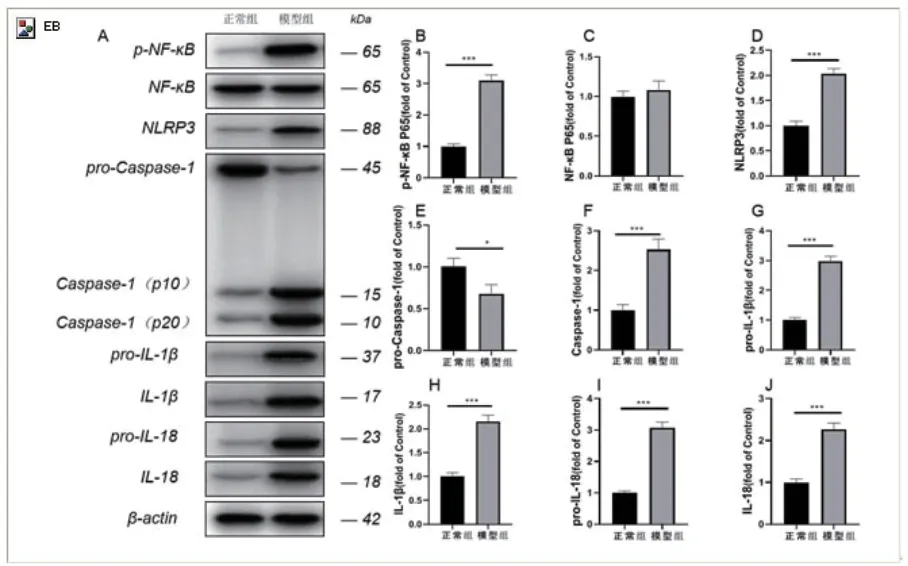
图2 颈动脉组织中NLRP3 炎症小体通路相关蛋白表达

图3 血清炎性指标的蛋白表达
3 讨论
AS形成机制多样,主要包括血管内皮的损伤、脂质代谢异常、血流动力学损伤、遗传、物理化学损伤等。血管壁受到多种复杂因素的联合作用,最终导致血管壁慢性炎症的发生,AS在缓慢进展中形成,而导致内皮损伤及炎症反应的具体机制至今尚未确切阐明。在AS的发生过程中,颈动脉是最易受累的部位,是反应全身AS的一个窗口[1]。炎症小体(Inflammasome)是一类促炎性多蛋白复合体,其中NLRP3炎症小体是目前研究中结构和功能较为明确的炎症小体,其作为固有免疫的重要组成部分在机体免疫反应和疾病发生过程中具有重要作用,研究表明NLRP3炎症小体通过参与AS的形成并影响斑块的稳定性发挥着重要的作用[2]。激活的NLRP3炎性小体可以通过促进血管内皮细胞焦亡,进而导致内皮功能障碍诱导AS的发生,细胞焦亡的激活依赖于Caspase-1的调控,而Caspase-1的活化受到NLRP3炎性小体的调控[3]。NLRP3炎性小体的活化是AS形成所必须的,胆固醇晶体通过激活NLRP3炎性小体促进血管内皮的细胞焦亡,进而导致内皮功能障碍诱导AS发生,并且有研究表明通过活化NF-κB的模式识别受体或细胞因子受体可以启动AS的形成[5]。
细胞焦亡依赖于Caspase-1的调控,并伴随促炎症因子IL-1β和IL-18的成熟与释放,进而募集并激活其他免疫细胞并促进下游炎症因子、趋化因子、粘附因子等的表达,级联放大炎症反应,IL-1β是动脉斑块形成初期重要的致炎因子,也是影响斑块稳定性重要因素[6]。有研究表明,大脑中动脉栓塞脑缺血/再灌注模型大鼠体内血清脑组织中NF-κB磷酸化水平升高,NLRP3、Caspase-1、IL-1β和IL-18表达增加,NLRP3炎症小体活化,通过抑制NF-κB磷酸化能降低NLRP3、Caspase-1、IL-1β和IL-18水平进而抑制NLRP3炎症小体的活化[7]。王全河等[8]的研究表明,NLRP3炎症小体蛋白表达水平及mRNA水平在高脂诱导大鼠冠状动脉硬化型心肌病模型中升高,提示NLRP3炎症小体参与了该疾病模型的发生发展过程,NF-κB 通路能够活化NLRP3炎症小体,激活的Caspase-1这一剪切修饰酶能够促进炎症因子的释放进而导致细胞焦亡。
为了阐明NLRP3炎症小体及相关信号途径在AS中的发病机制及其焦亡的关系,并为临床对AS的治疗提供相关依据,本研究通过颈动脉内膜空气干燥术及高脂饲料喂养快速建立了高脂血症颈动脉粥样硬化家兔模型并对其进行研究,在本研究中家兔高脂血症颈动脉粥样硬化模型颈动脉组织p-NF-κB、NLRP3、Caspase-1、pro-IL-1β、pro-IL-18、IL-1β及IL-18 蛋白较正常值组表达显著上升,这与其他学者的研究结果是一致的。模型组颈动脉组织p-P65 NF-κB/P65 NF-κB比值显著上调,血清NF-κB、IL-1β及IL-18显著上调,表明高脂血症颈动脉粥样硬化家兔NF-κB水平以及NF-κB磷酸化水平增加,NF-κB被激活,且NLRP3炎症小体的激活也伴随这下游相关炎症因子的高表达。
本研究结果提示高脂血症颈动脉粥样硬化家兔模型存在NLRP3及其相关炎症因子如Caspase-1、IL-1β和IL-18的高表达,且通过活化NLRP3炎症小体促进AS机制可能与NF-κB磷酸化有关。对NLRP3炎症小体及NF-κB磷酸化的抑制可能成为治疗AS相关疾病的手段,值得更深层次的研究。
