抗传染性支气管炎病毒M蛋白单克隆抗体的制备及鉴定
2020-05-25周景明马文利祁艳华张改平王爱萍
周景明, 马文利, 祁艳华, 马 强, 张改平, 王爱萍
(郑州大学 生命科学学院 河南 郑州 450001)
0 引言
传染性支气管炎(IB)是由传染性支气管炎病毒(IBV)引起的一种急性和严重的家禽疾病[1]。病毒主要感染呼吸道、肾脏和生殖系统,造成呼吸窘迫、肾脏损害和产蛋量减少。IBV是一种具有极强突变和重组能力的RNA病毒,能够不断产生难以控制的新病毒毒株。IBV与快速突变率、病毒重组和宿主选择压力相关[2]。减毒活疫苗常用于疫苗接种计划,但它受到热稳定性差、毒力返还以及疫苗和野毒株之间重组的限制,可能会导致IBV毒株遗传多样性的不断出现,对家禽业造成严重危害。目前,IBV 抗原表位的研究主要集中在抗 IBV 感染中起免疫保护作用的S糖蛋白[3]和N 蛋白[4]。 M蛋白作为IBV重要的结构蛋白,其抗原表位的研究较少[5]。M蛋白约占病毒总结构蛋白量的40%,具有较高的保守性,可诱导机体产生特异性抗体,能诱导较强的细胞免疫反应[6]。因此,M蛋白可作为研制单克隆抗体或疫苗的靶标。本文利用基因工程技术重组表达了M蛋白,将其作为免疫原免疫小鼠,并利用杂交瘤技术制备了抗M蛋白单克隆抗体,为 IBV 抗原检测方法的建立以及相关研究提供材料。
1 材料和方法
1.1 材料
SPF种蛋(北京梅里亚维通实验动物技术有限公司),M41毒株(中国兽医药品监察所),雌性BALB/c小鼠(郑州大学实验动物中心),SP2/0细胞、pGEX-6p-1、大肠杆菌Transetta (DE3)(本实验室保存),IPTG、氯霉素和氨苄西林(Solarbio公司),限制性核酸内切酶、T4 DNA 连接酶(TaKaRa公司),HRP 标记羊抗鸡、羊抗鼠IgG(Abbkine 公司)。
1.2 方法
1.2.1IBV的扩繁 将IBV M41冻干粉用灭菌的PBS缓冲液溶解。种蛋孵化至10日龄,在接近气室处标记接种部位,吸取病毒稀释液接种鸡胚,48 h后收取尿囊液,离心,收取上清液-80 ℃保存。
1.2.2构建pGEX-6p-1-M表达载体 根据Genebank中已发表的IBV M41(登录号:AF286184.1)的M基因序列,设计一对引物:M-F:5′-CCGGAATTCCAGAGTATTAGACTCTTTAAGCGGT-3′;M-R:5′-CCGCTCGAGTTAGGTGTAAAGACTACTCCCTCCT-3′。提取尿囊液中的RNA,RT-PCR扩增M基因,构建pGEX-6p-1-M重组质粒。
1.2.3M蛋白的表达及纯化 将构建的重组表达载体pGEX-6p-1-M转化大肠杆菌Transetta(DE3)感受态细胞。在LB液体培养基加入IPTG诱导表达后,超声处理菌体,对上清液和沉淀物进行SDS-PAGE分析,结果显示融合蛋白主要以包涵体形式存在,随后对包涵体进行变性和复性。
1.2.4动物免疫 取3只适龄雌性BALB/c小鼠,首次免疫时将纯化的重组M蛋白与等体积的弗氏完全佐剂混合,并用手持均质机乳化,对小鼠进行多点皮下注射,此后每隔两周将免疫原与弗氏不完全佐剂等体积混合乳化后对小鼠进行免疫。在细胞融合前3天静脉注射无佐剂的重组M蛋白加强免疫。
1.2.5细胞融合及杂交瘤细胞株的筛选 将脾淋巴细胞与小鼠SP2/0细胞融合,分别用M蛋白和GST蛋白作为包被原,SP2/0细胞上清液为阴性对照,采用间接ELISA法筛选阳性孔。选择仅与重组M蛋白反应的单克隆抗体的杂交瘤用于有限稀释和亚克隆,重复亚克隆3到4轮。
1.2.6单克隆抗体的制备与鉴定 用体内诱生腹水法大量制备抗IBV M蛋白的单克隆抗体。通过辛酸/硫酸铵法纯化腹水,并通过SDS-PAGE、亲和力、Western blot、免疫过氧化物酶单层细胞(IPMA)鉴定单克隆抗体。
2 结果与分析
2.1 pGEX-6p-1-M表达载体
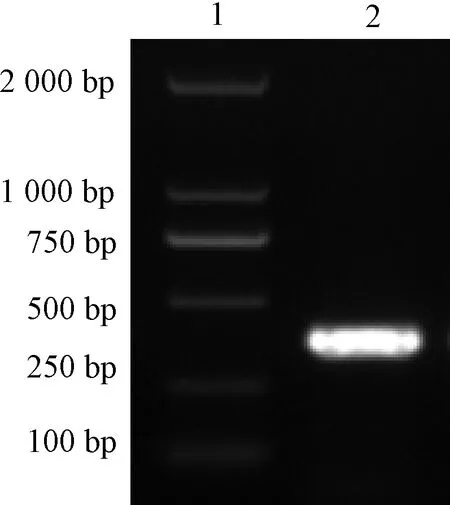
1:Marker;2:M基因图1 PCR扩增IBV M基因Figure 1 PCR amplification of IBV M gene
PCR扩增IBV M基因如图1所示。将感染的IBV M41毒株的尿囊液用RNAiso Plus提取出RNA,RT-PCR扩增M基因,利用琼脂糖凝胶电泳进行鉴定,在381 bp左右出现较亮的条带,与预期结果相符。
2.2 M蛋白的原核表达及纯化
重组M蛋白的SDS-PAGE及Western blot鉴定结果如图2所示。经IPTG诱导后,重组表达菌株pGEX-6p-1-M-Transetta(DE3)在40 kD左右出现明显的条带,与预期结果一致。可溶性分析后,发现目的蛋白质主要在沉淀中,表明重组M蛋白是以包涵体形式表达(图2(a))。对重组蛋白进行变性和复性,Western blot检测结果表明,重组 M 蛋白能与 IBV阳性鸡血清发生特异性反应(图2(b))。

(a)1.Marker;2.pGEX-6p-1;3.沉淀;4.上清 (b)1.Marker;2.GST;3.重组M蛋白图2 重组M蛋白的SDS-PAGE及Western blot鉴定Figure 2 Identification of recombinant M protein by SDS-PAGE and Western blot
2.3 单克隆抗体的制备与鉴定
细胞融合后经过间接ELISA法测定和3轮亚克隆,获得了11株抗M蛋白单克隆抗体的杂交瘤细胞株(2D2、2E5、4F5、5A6、5E6、5G7、9C11、3C11、9B10、9G6、9G8)。选择效价高的9C11,对抗M蛋白单克隆抗体进行大量制备,将纯化前后的9C11腹水通过 SDS-PAGE鉴定分析,结果如图3所示。可以看出,与腹水纯化前相比,纯化后的抗体具有较高的纯度。
将包被原M蛋白分别调整到不同浓度对酶标板进行包被,利用间接ELISA法测定9C11单克隆抗体效价,分别绘制出对应不同包被浓度的间接ELISA反应曲线,由亲和常数计算公式可以得出9C11单克隆抗体的Ka为6.49×108L/mol。
9C11单克隆抗体与重组M蛋白反应的Western blot分析如图4所示。GST作为阴性对照,将重组M蛋白与9C11单克隆抗体进行Western blot分析。检测结果表明,9C11单克隆抗体能与重组M蛋白发生特异性反应,在40 kD左右出现明显条带。

1:Marker;2:纯化前;3:纯化后图3 9C11单克隆抗体纯化的SDS-PAGE分析Figure 3 SDS-PAGE analysis of 9C11 mAb purification
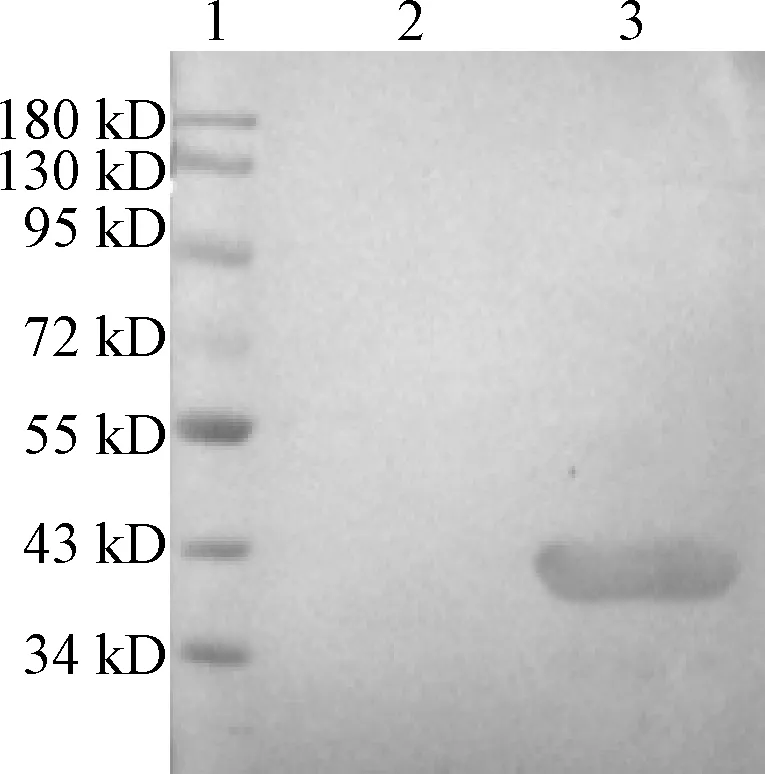
1:Marker;2:GST;3:重组M蛋白图4 9C11单克隆抗体与重组M蛋白反应的Western blot分析Figure 4 Western blot analysis of 9C11 mAb reacting with recombinant M protein
M41感染CEK细胞24 h后的IPMA鉴定结果如图5所示。将IBV鸡血清作为阳性对照,未接毒尿囊液作为阴性对照,采用IPMA方法进行鉴定,可见抗M蛋白9C11单克隆抗体能与M41结合,而与阴性尿囊液无反应。

图5 M41感染CEK细胞24 h后的IPMA鉴定结果Figure 5 IPMA identification results of M41 infected CEK cells after 24 h
3 讨论
M 蛋白是IBV中重要糖蛋白之一[7]。冠状病毒 M 蛋白体外表达困难,这可能与 M 蛋白在细胞中表达并积累到一定量时会破坏细胞壁有关[8]。M 蛋白 N 端的前 20 个氨基酸具有亲水性特征,紧邻的约80个氨基酸残基构成3个α螺旋疏水区,至少跨膜3次,这种跨膜结构也是影响表达的原因之一[9]。此外,M基因中存在大肠杆菌稀有密码子(约占12.1%),部分以串联形式存在,影响M蛋白原核表达[10]。使用DNAStar软件对其进行分析,M蛋白氨基端是跨膜区,羧基端主要是抗原表位区,删除3个跨膜疏水区,对羧基端381 bp(127个AA)M基因进行诱导表达。由于表达的融合蛋白主要是包涵体,PreScission酶无法切除GST标签。为了验证针对M片段产生的抗体又纯化出 GST 蛋白,与融合蛋白分别包被进行ELISA 检测,结果显示:融合蛋白的OD450值是GST蛋白所测值的3~6倍,说明免疫所产生的抗体有一部分是针对M 片段的抗体。为了获得大量特异性针对M蛋白的单克隆抗体,选择效价高的小鼠进行细胞融合,并用同样的方法筛选出分泌抗M蛋白抗体的杂交瘤细胞株。本实验制备了11株抗 IBV M 蛋白的单克隆抗体,丰富了IBV的单克隆抗体库。在IBV的结构蛋白中,M 蛋白是较为保守的,虽然其在IBV的生命活动中起着重要作用[11],但关于其免疫学功能方面的研究却相对较少。本实验制备的11株针对 IBV M 蛋白的单克隆抗体,为今后更深入地研究该蛋白的分子生物学功能、抗原表位的鉴定以及抗原捕获ELISA方法的建立等提供了有力的工具。
