活血通络汤对SANFH 兔造模过程中Notch1、HERP1 及bFGF表达的影响
2020-05-25蔡万翔王敏李涛江蓉星
蔡万翔,王敏,李涛,江蓉星
(1.成都体育学院附属体育医院,四川 成都;2.重庆市中医院,重庆;3.都江堰市医疗中心,四川 都江堰;4.成都中医药大学,四川 成都)
0 引言
股骨头坏死(ONFH)系多因素损伤或中断了股骨头的血供,从而导致股骨头骨髓成分与骨细胞死亡,最终股骨头结构发生改变甚至塌陷,并出现相应临床症状的难治性关节疾病[2]。长期或短期大剂量使用糖皮质激素已成为非创伤性股骨头坏死的首要发病因素[3]。股骨头血供的受损或中断导致骨髓成分及骨细胞的死亡或凋亡是骨坏死必经的环节[4]。减少激素对股骨头周围血供的损伤,促进股骨头周围血管的稳定获修复,抑制骨髓及骨细胞的死亡或凋亡进而促进骨组织及骨细胞的修复有利于降低或改善SANFH 的发生率。本次实验基于中医“未病先防”的特色指导思想结合前期实验成果,动态监测Notch1、HERP1 及bFGF 的含量,并探讨分析可能的相关作用机制,以期为防治SANFH 奠定理论基础。
1 实验材料
1.1 动物
全雄性健康日本大耳兔,总共192 只,3 月龄,体质量2.0-2.5Kg,由四川大学华西医院动物实验中心所提供,检疫合格(动物许可证号SCXK(川)2009-09)。单笼单兔饲养,标准条形饲料喂养,适应性喂养1 周。符合动物伦理要求。
1.2 药物
醋 酸 泼 尼 松 龙 注 射 液(规 格:5mL:125mg,批 号:131102,浙江仙琚制药);注射用青霉素钠(规格:0.48:80 万U,批号:A1311002,哈药集团制药总厂);硫酸庆大霉素注射液(规格:2mL:8 万U,批号:20131112,四川长征药业股份有限公司)。“活血通络汤”方组成:黄芪、丹参、川芎、当归g、怀牛膝、巴戟天、地龙、鸡内金等(均按原方比例于成都市北京同仁堂购买,并加工成粉末;后制成中药条形饲料,中药所占20%比值)。
1.3 仪器与试剂
低温离心机(型号:C2500 湖南湘仪实验仪器厂);实时荧光定量仪、热循环仪(美国ThermoFisher 仪器有限公司);旋涡混合器(江苏康健医疗用品有限公司);Rabbit NOTCH2 ELISA kit,Abcam 公司。电泳仪、电泳槽、化学发光凝胶成像仪(北京君意东方电泳设备有限公司);BMJ-Ⅲ型包埋机、TSJ-Ⅱ型全自动封闭式组织脱水机(常州中威电子仪器);枪头、EP 管(美国Axygen 公司);转轮式切片机(徕卡-2016,德国);数码三目摄像显微镜,BA400Digital(麦克奥迪实业集团有限公司);图像分析软件(美国Media Cybernetics 公司)。
多聚甲醛(EM 级)、无水乙醇(AR 级)、二甲苯(AR 级)、苏木素(AR 级)、硫酸铝钾(AR 级)、碘酸钠(AR 级)、丙三醇(AR 级)、伊红(AR 级)、氯仿(RNA 专用),实时荧光定量法(RT-PCR)检测试剂-总RNA 抽提试剂(美国Invitrogen 公司)、免疫组化(S-P法)试剂(北京中衫金桥生物有限公司)、酶联免疫吸附法(Elisa)试剂(bcam 公司)。
1.4 实验方法
1.4.1 分组
将实验大耳兔适应性喂养1 周后,准确称重,然后随机分成为四组:预防+治疗组(A)、治疗组(B)、模型对照组(C)与空白对照组(D),每组各48 只。
给药方式:A 组从第2 周开始喂服中药饲料(50g/kg.d)其余各组喂服普通饲料(50g/kg.d),每日1 次,连续1 周。从第3 周开始,A、B 两组喂服中药饲料(50g/kg.d),C、D 组连续喂服普通饲料(50g/kg.d),每日1 次,连续6 周。
1.4.3 造模
第3 周起,A、B、C 三组兔参照贺氏造模法开始造模[1],在每只家兔臀部采取肌肉注射醋酸泼尼松龙注射液(8mg/kg),D 组家兔臀部注射同等剂量的生理盐水,一周2 次,连续注射6 周。4 组家兔全部预防性注射使用青霉素(8 万U/kg),庆大霉素(4 万U/只),一周2 次,预防家兔感染。
1.4.4 标本采集
分别于第2、5、8 周末随机从各组抽取8 只兔子,抽取兔耳缘静脉血,抗凝,离心机分离,取白细胞和血清标本,低温保存。处死兔子,截取股骨头标本,放入10%甲醛中固定。
1.5 指标检测
1.5.1 一般情况
精神、运动、皮毛、体重、粪便等;
1.5.2 镜检
光镜镜检:脱水、修整、包埋、切片、HE 染色、封片,镜检;
电镜镜检:吸取固定液、洗涤、脱水、干燥、喷镀等,镜检;
1.5.3 空骨陷窝率
在股骨头软骨区随机选取10 个高倍视野,计算每个视野中所有骨陷窝数与空骨陷窝数(计算公式:空骨陷窝数/全部骨陷窝数×100%);
1.5.4 Notch1、HERP1 基因表达值
采 用RT-PCR 检 测;血 清 中bFGF:Elisa 检 测,骨 组 织 中bFGF:S-P 法检测。
1.6 统计方法
采用SPSS 17.0 for windows 统计软件包进行统计分析处理,计量资料采用表示,多组间比较采用单因素方差分析,组间两两比较采用t 检验;计数资料采用%表示,检测水准a=0.05。
2 实验结果
2.1 一般情况
2.2 骨组织光镜下观察


表2 骨组织光镜下观察

表3 骨组织电镜下观察
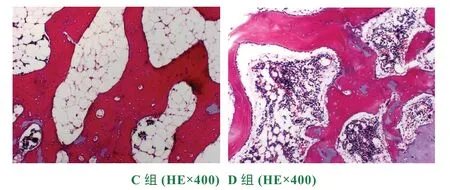
2.3 骨组织电镜下观察

2.4 兔股骨头空骨陷窝率结果(%)
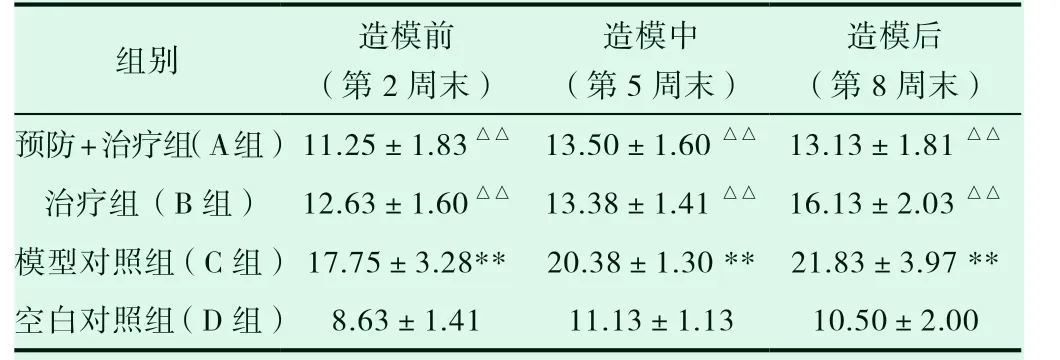
表4 兔股骨头空骨陷窝率结果(%)
由表4 分析空骨陷窝率:A、B、C 组均明显高于D 组(P<0.01);A、B 组 明 显 低 于C 组(P<0.01);在 第8 周 末 时:B 组 高 于A组(P<0.05);随着实验的进行,C 组呈上升趋势; B 组增长趋势弱于C 组;A 组在实验后期呈下降趋势。
2.5 Notch1 的基因表达检测结果
表5 药物对实验家兔血清Notch1 蛋白基因表达值的影响

表5 药物对实验家兔血清Notch1 蛋白基因表达值的影响
注:其它组与A 组比较*P<0.05,**P<0.01;C 组,D 组与B 组比较#P<0.05,##P<0.01;D 组与C 组比较^P<0.05,^^P<0.01。
组别 (第造2模周前末) (第造5模周中末) (第造8模周后末)预防+治疗组(A 组) 1.17±0.14 1.19±0.33 1.28±0.27治疗组(B 组) 1.30±0.20 1.18±0.13 1.29±0.18模型对照组(C 组) 1.22±0.22 1.16±0.10 1.72±0.37##**空白对照组(D 组)0.62±0.33^^##** 1.21±0.23 1.51±0.17
由上分析Notch1 表达值:第2 周末时,A、B、C 组明显高于D组(P<0.01);第5 周时,A、B、C、D 组各组间比较P >0.05;第8 周时,A、B 组均比C 组低(P<0.01)。A 组第8 周比第2 周稍高,B 组第8周比第2 周略低,C 组、D 组Notch1 表达值升高的幅度比A 组大。
2.6 HERP1 的基因表达检测结果
表6 药物对实验家兔血清中HERP1 浓度的影响(单位:ug/L)

表6 药物对实验家兔血清中HERP1 浓度的影响(单位:ug/L)
注:其它组与A 组比较*P<0.05,**P<0.01;C 组,D 组与B 组比较#P<0.05,##P<0.01;D 组与C 组比较^P<0.05,^^P<0.01。
组别 (第造2模周前末) (第造5模周中末) (第造8模周后末)预防+治疗组(A 组) 1.29±0.16 1.51±0.30 1.61±0.16治疗组(B 组) 1.51±0.24 1.60±0.16 1.78±0.26模型对照组(C 组) 1.48±0.48 1.80±0.22* 1.64±0.43空白对照组(D 组) 0.85±0.43 1.29±0.16##^^ 1.94±0.21
由上分析HERP1 表达值:第2 周时,各组间比较(P >0.05);第5 周时,A 组低于C 组(P<0.05),B 组高于D 组(P<0.01),C组高于D 组(P<0.01);第8 周时,各组间比较(P>0.05)。A 组、B 组2、5、8 周呈递增的趋势,C 组2、5 周呈增高的趋势(第8 周略微下降),D 组增高趋势大于A、B 组。
2.7 血清中bFGF 的检测结果
表7 药物对实验家兔血清中bFGF 浓度的影响(单位:ng/l)

表7 药物对实验家兔血清中bFGF 浓度的影响(单位:ng/l)
注:其它组与A 组比较*P<0.05,**P<0.01;C 组,D 组与B 组比较#P<0.05,##P<0.01;D 组与C 组比较^P<0.05,^^P<0.01。
组别 (第造2模周前末) (第造5模周中末) (第造8模周后末)预防+治疗组(A 组) 9.80±0.37 9.65±0.34 8.97±0.64治疗组(B 组) 9.51±0.23* 9.64±0.28 8.74±0.83模型对照组(C 组) 9.45±0.19* 9.83±0.13 8.57±0.76空白对照组(D 组) 9.75±0.26 10.18±0.84 9.70±1.02^^#
由上分析bFGF 浓度:第2 周末时,A 组高于B、C 组(P<0.05);第5 周末时,各组间比较(P>0.05);第8 周末时,C 组明显低于D组(P<0.01);B 组低于D 组(P<0.05);A、D 组间比较(P>0.05)。
2.8 兔骨组织中bFGF 平均光密度
表8 药物对兔骨组织bFGF 平均光密度的影响
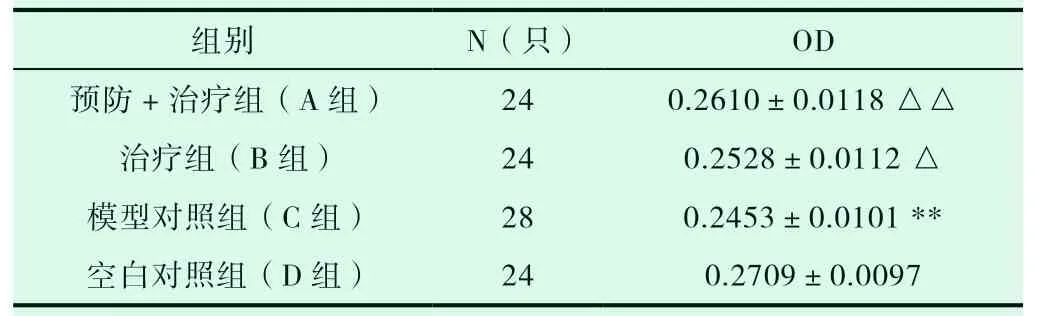
表8 药物对兔骨组织bFGF 平均光密度的影响
注:模型组与空白对照组(D 组)相比,**P<0.01;其余3 组与模型对照组(C 组)对比,△P<0.05 ,△△P<0.01。
组别 N(只) OD预防+治疗组(A 组) 24 0.2610±0.0118 △△治疗组(B 组) 24 0.2528±0.0112 △模型对照组(C 组) 28 0.2453±0.0101 **空白对照组(D 组) 24 0.2709±0.0097
由上可知:C 组兔骨组织bFGF 明显低于D 组(P<0.01);A 组兔骨组织bFGF 明显高于C 组(P<0.01);B 组兔骨组织bFGF 升高(P<0.05)。
3 讨论
家兔的一般情况的变化情况,表明A、B 两组的施加条件可抑制激素对家兔精神、毛色、体重、活动量的损害,且A 组略优于B组。从病理形态学及镜检结果表明A、B 两组家兔的施加条件能降低空骨陷窝率,且A 组略优于B 组。研究发现长期或者短期大剂量使用激素能引起股骨头软骨下空骨陷窝率升高,即为早期股骨头坏死[5]。所以实验表明A、B 组的施加条件能抑制激素对家兔骨组织的损伤,且A 组抑制作用略强于B 组,即活血通络汤能抑制家兔骨组织的损伤,且有一定的预防作用。
研究表明Notch 的高表达能抑制破骨细胞的表达,或者具有成骨作用[6],也有相关文献报道:Notch 信号对细胞成骨分化可能有抑制作用[7],李林等研究显示Notch 信号参与了骨形成和成骨细胞的分化,并可能对骨形成和成骨细胞有抑制作用[8]。还有研究表明Notch 信号通路能作用于细胞的成熟过程中调节细胞的增值与分化[9]。由表5 可知活血通络汤能抑制Notch1 的表达。所以单路分析可能是:活血通络汤通过抑制Notch1 的表达:①从抑制破骨细胞的增殖或(和)促进成骨细胞的增殖分化,②通过促进破骨细胞的死亡或凋亡或(和)抑制成骨细胞的死亡或凋亡;从而调控成骨细胞和破骨细胞的平衡来达到治疗SANFH 的作用。
HERP 是Notch 的下游靶基因,李斌元等认为HERP 参与了细胞的凋亡调节过程[10],陈风雷等研究表明抑制HERP 表达能够增强细胞自噬和抑制细胞死亡[11]。由表6 可知活血通络汤可能是降低HERP1 的表达从而增强了破骨细胞的自噬而抑制了成骨细胞的死亡来达到治疗SANFH 的作用,而A 组HERP1 的表达值低于B 组,说明A 组该项抑制作用强于B 组,表示活血通络汤预防SANFH 的作用得到体现。实验后期HERP1 对成骨细胞与破骨细胞的作用,可能即存在抑制成骨细胞细胞死亡的作用,也存在抑制破骨细胞死亡的作用,且后者有增强趋势。
作为细胞因子的bFGF 具有多种生物学活性,从表7、8 实验结果可知,活血通络汤具有上调家兔中bFGF 的作用,且造模前给药的上调作用强于造模开始后给药的作用。bFGF 是具有促进血管生成作用的血管生成因子。CHRISTIANW 等研究表明:细胞因子bFGF 具有促进微血管形成、改善微循环的作用,并且参与新生血管形成的全过程[12]。由此可以推论活血通络汤可能是通过上调兔血中bFGF 的含量,从而促进微血管形成,最终恢复股骨头血运来达到预防与治疗SANFH 的作用。细胞层面,有研究表明bFGF能促进成骨细胞的增值,而抑制破骨细胞的形成,从而促进骨的形成[13]。李鹏飞等研究发现,bFGF 对骨细胞的前期增殖起到有效的刺激作用,它合成并储存在成骨细胞中,并且对软骨细胞具有抗凋亡作用[14]。由此可以推测:活血通络汤通过上调bFGF 的含量:①促进成骨细胞的合成、抑制破骨细胞的形成;②对软骨细胞的抗凋亡作用;从而实现的治疗或者预防SANFH 作用。李晓辉等通过研究发现bFGF 是多种细胞的丝裂原,可促进成骨细胞基因的表达和血管的生成[15]。bFGF 在治疗股骨头坏死方面具备一定的潜能和优势。
在实验中Notch1、HERP1 与bFGF 可能单独的支路起作用,也可能是其中两者或者三者之间在不同时间段Notch 信号通路的某一通路被激活,如Notch1- HERP1、Notch1-bFGF 或Notch1-HERP1-bFGF 等通路,从而增加Notch 受体胞内活性片段(Notch intracellular domain,NICD)的表达,促进下游靶基因的转录表达,从而参与对细胞、血管增殖分化以及细胞的凋亡/死亡的调控,进而促进成骨分化或降低破骨分化,最终达到治疗SANFH。但其中的关联作用还需进一步的设立对应的实验来研究,以期为临床主动防治SANFH 奠定进一步的理论基础。
