氟苯尼考在海水鱼循环水养殖系统中的迁移转化规律
2020-05-25张莺脐张羡宇刘述颖吴子曾MDMOSTAFIZURRahman
郭 睿,张莺脐,张羡宇,刘述颖,吴子曾,张 倩,刘 鹰,MD MOSTAFIZUR Rahman
( 1.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023; 2.大连海洋大学,设施渔业教育部重点实验室,辽宁 大连 116023 )
抗生素被广泛用于水产动物疫病的治疗和预防,大量未被吸收利用的抗生素会通过多种方式最终进入水环境中。抗生素残留会引起水产动物自身以及水环境中微生物耐药性的产生,破坏水产养殖环境的生物多样性和生态平衡。此外,水产品体内残留的药物会沿食物链传递蓄积,对人类健康造成潜在的威胁。氟苯尼考属于联合国粮农组织批准可用于水产养殖的抗生素之一[1]。氟苯尼考作为氯霉素的替代物,被广泛用于鱼的链球菌病、鲑鱼疥疮病、细菌性冷水病、肠道败血症等细菌性疾病的治疗[2],氟苯尼考在水产养殖业中的大量使用导致其在环境和水产品中残留水平较高,在大连近岸海域养殖区中,氟苯尼考的质量浓度高达29.8~11 103 μg/L[3],对公众健康和出口贸易造成严重影响[5]。许多国家针对氟苯尼考残留制定了食品安全限量标准,并规定了相应的休药期。欧盟和中国《动物性食品中兽药最高残留限量》[4]明确规定氟苯尼考在水产品中的最大残留量为1000 μg/kg,日本规定鲈形目鱼类氟苯尼考的最大残留量为30 μg/kg[6];为达到该限量,我国和美国规定氟苯尼考的休药期分别为≥7 d和15 d。治疗周期影响水产动物体内药品的残留量,不同疾病及不同物种的治疗周期不尽相同,如治疗鳗鲡目鱼类爱德华氏病为7 d,治疗鲱形目淡水养殖种类弧菌病为14 d[7]。在实际生产过程中治疗期和休药期的实施和监管较难控制。
循环水养殖系统通过机械过滤、蛋白分离、微生物处理、紫外消毒等水处理环节,将养殖排放水经生物、物理和化学处理后实现重复利用,因其高效、环保的特征而成为国际公认的现代化养殖模式的发展方向[8-9]。与传统的流水养殖相比,循环水养殖系统可大幅度降低养殖耗水量,显著降低水体富营养化程度,但在养殖密度较高时,循环水养殖仍然会发生病害。抗生素治疗疾病,已是目前公认的最有效的方法,但其在鱼组织、水体和循环水养殖处理环节中存在未知风险。Bebak等[10]曾在淡水循环水系统中连续投喂10 d含土霉素的饲料,以此研究鱼组织、水体和沉积物中土霉素的残留。抗生素在鱼体内的分布、代谢和消耗的相关研究较多,而对抗生素在循环水养殖系统中的去向研究较少。因此,循环水养殖系统通过物理、化学、生物等处理过程是否会对水环境中和养殖生物体内残留的抗生素起到有效的去除作用,目前尚不清楚。
欧洲舌齿鲈(Dicentrarchuslabrax),属鲈形目、狼鲈科、舌齿鲈属,又名欧鲈[11],是地中海沿海地区一种重要的养殖鱼类,约占该地区鱼类总产量的20%[12]。引入中国后开展了大量关于苗种繁育及高效健康养殖理论与技术的研究,因其生长速度快、味道鲜美,欧洲舌齿鲈具有较大的市场潜力和较高的经济价值[13]。
笔者通过连续7 d投喂含氟苯尼考的配合饲料,检测循环水养殖系统中氟苯尼考的残留规律,分析不同水处理单元对氟苯尼考的去除效果,并通过检测氟苯尼考在欧洲舌齿鲈肌肉和肝脏组织中的残留水平,提出实际养殖生产中抗生素的用药方案以及合理的休药期时长。试验将为循环水系统中各水处理单元的工艺设计提供理论基础,推动水产养殖业的健康可持续发展。
1 材料与方法
1.1 材料
1.1.1 试验系统
循环水养殖系统由青岛海兴智能装备有限公司生产,3个并联的圆形养殖池(直径1000 mm×1100 mm,750 L)的尾水依次通过旋转集污器、微滤机、蛋白分离器、生物滤池、紫外消毒装置和增氧装置处理后,再次回到养殖池中循环利用。生物滤器中填料的有效体积为0.3 m3,在试验运行期间保持稳定,对氨氮平均降解率逾90%,化学需氧量平均降解率约75%。蛋白分离器体积为0.15 m3,系统水体流量为3 m3/h,单次循环时间为1 h,日循环次数为24次,每日水补充量为0.3 m3。
1.1.2 试验动物
试验所用欧洲舌齿鲈购自大连富谷集团。挑选规格均匀,体质健壮的鱼体[平均体质量(32.67±4.16) g]120尾,随机分在3个养殖池中。试验前将欧洲舌齿鲈在养殖池中暂养7 d,试验期间每日检测水质,水温(21.08±0.18) ℃,pH 7.85±0.02,盐度32.22±0.01,溶解氧(6.64±0.18) mg/L。
1.1.3 含氟苯尼考饲料配置
氟苯尼考粉(纯度为≥98%,山东亚康药业有限公司)、氟苯尼考标准品(纯度≥99%,Sigma)、乙腈、甲醇(色谱纯,禹王集团)、乙酸乙酯、正己烷(分析纯,天津市大茂化学试剂)。本试验使用的膨化配合饲料由广东粤海公司提供。药物饲料使用蛋清将氟苯尼考以1 g/kg的含量包被在饲料上,使得氟苯尼考实际投喂量为10 mg/(kg·d),阴干后储存在冰箱中-4 ℃备用。
1.2 方法
1.2.1 试验设计
试验设计投药期和停药期两个时期。投药期共7 d,按鱼体初始质量的1.5%投喂含氟苯尼考的饲料,停药期共14 d,投喂普通饲料,每日投喂饲料两次(8:00和20:00),在第一次投喂含药饲料后0、1、2、4、6、12 h分别自循环水养殖系统内的4个取样点(图1)取500 mL水样,之后每日投喂饲料后1 h取水样检测系统中氟苯尼考含量的变化,水样保存于-20 ℃。此外,检测投药前、投药第7 d、停药第7 d、停药第14 d时鱼组织样品中氟苯尼考的残留量,自3个试验桶各取6尾鱼,使用间氨基苯甲酸乙酯甲磺酸盐麻醉后,于冰上迅速解剖,取肝脏和肌肉组织用生理盐水冲净保存至-80 ℃待测。
1.2.2 水样中氟苯尼考的检测
水样预处理:取500 mL水样经0.45 μm水系滤膜过滤,调节pH至4.0。水样通过固相萃取仪(天津奥特塞恩斯仪器有限公司)以2 mL/min的流速经过固相萃取柱(Oasis HLB SPE 500 mg/6 mL)富集,上样前依次用5 mL甲醇和5 mL超纯水对固相萃取柱进行活化平衡,上样后依次加入3 mL超纯水淋洗,6 mL甲醇分两次进行洗脱,40 ℃氮气吹干(氮吹仪,杭州奥盛仪器有限公司)。最后使用2 mL甲醇定容,经0.22 μm微孔滤膜过滤后上机分析。使用高效液相色谱仪(岛津SPD-20A型)检测水中氟苯尼考的质量浓度,液相色谱柱采用Thermo Hypersil GOLD色谱柱(4.6 mm×250 mm, 5 μm), 柱温40 ℃,流动相为乙腈∶纯水=40∶60(体积比),流速1.0 mL/min,检测波长223 nm,进样量20 μL。
循环水系统不同处理单元对氟苯尼考的降解率计算:
A1/%=(C1-C2)/C1×100%
A2/%=(C2-C3)/C2×100%
A3/%=(C3-C4)/C3×100%
式中,A1为蛋白分离器对氟苯尼考的降解率,A2为生物滤池对氟苯尼考的降解率,A3为紫外消毒对氟苯尼考的降解率,C1为入水口处氟苯尼考的质量浓度,C2为经蛋白分离器后氟苯尼考的质量浓度,C3为经生物滤池后氟苯尼考的质量浓度,C4为经紫外消毒后氟苯尼考的质量浓度。

图1 循环水养殖系统取样点
1.2.3 组织样品中氟苯尼考的检测
组织样品预处理:取肝脏/肌肉组织,室温下解冻,准确称取1.0 g组织置于5 mL离心管中,加入乙酸乙酯2 mL,使用高速匀浆机(WIGGENS D-130)在冰浴条件下匀浆2 min,经超声波细胞粉碎机(新芝JY92-IIN)超声30 s,并用2 mL乙酸乙酯清洗刀头,合并两次提取液,涡旋30 s。室温黑暗静置2 h后离心(5000 r/min,15 min),吸取上清液于新的离心管中,40 ℃氮气吹干,加入1 mL甲醇溶解,2 mL正己烷去除脂肪,漩涡振荡,室温条件下,静置2~3 h,使用刻度吸管仔细除去上层正己烷,经0.22 μm的微孔滤膜过滤后待测。
液相色谱条件:柱温30 ℃,流动相为乙腈∶纯水=27∶73(体积比),流速1.0 mL/min,检测波长223 nm,进样量20 μL。
1.2.4 标准曲线
精密称取氟苯尼考标准品0.0010 g,使用甲醇溶解定容至100 mL,配制为10 mg/L标准储备溶液,保存-4 ℃冰箱中备用。水样检测前使用甲醇依次稀释,配制成质量浓度为0.2、2.0、10、20、40 μg/L的标准溶液。鱼组织样品检测前稀释质量浓度为0.01、0.1、0.5、1.0、1.5、2.0、2.5 mg/L的标准溶液。取20 μL用于液相色谱上机检测,以峰面积为纵坐标,氟苯尼考质量浓度为横坐标,绘制标准曲线,计算回归方程和相关系数。
1.2.5 回收率和精确度
为确保检测结果真实性和可靠性,本研究采用加标回收的方法对预处理质量控制。选择过滤海水为空白样品,添加氟苯尼考标准品,水样质量浓度分别为5.0、10、20 μg/L,鱼组织样品含量分别为0.1、0.5、1.0 μg/g,根据上述预处理方法,进行回收率、日内精确度以及日间精确度的检测。
回收率/%=V2/V1×100%
式中,V1为标准溶液的测定值,V2为样品处理后标准溶液的测定值。
按照信噪比=3为检出限,信噪比=10为定量限。
1.3 数据分析
使用SPSS 18.0统计软件和Origin软件对试验结果进行统计分析,试验数据以平均值±标准误表示。
2 结果与分析
2.1 液相色谱检测结果
根据本试验选取的前处理方法和液相色谱条件设置,氟苯尼考保留时间为8.1 min,分离度良好,无其他杂质峰干扰,氟苯尼考标准品的色谱峰见图2。
氟苯尼考在循环水养殖系统水样中的质量浓度为0.2~40 μg/L,鱼组织样品中为0.01~2.50 μg/g,各色谱峰面积和质量浓度呈线性关系,且线性关系良好。具体线性关系及其相关系数见表1。
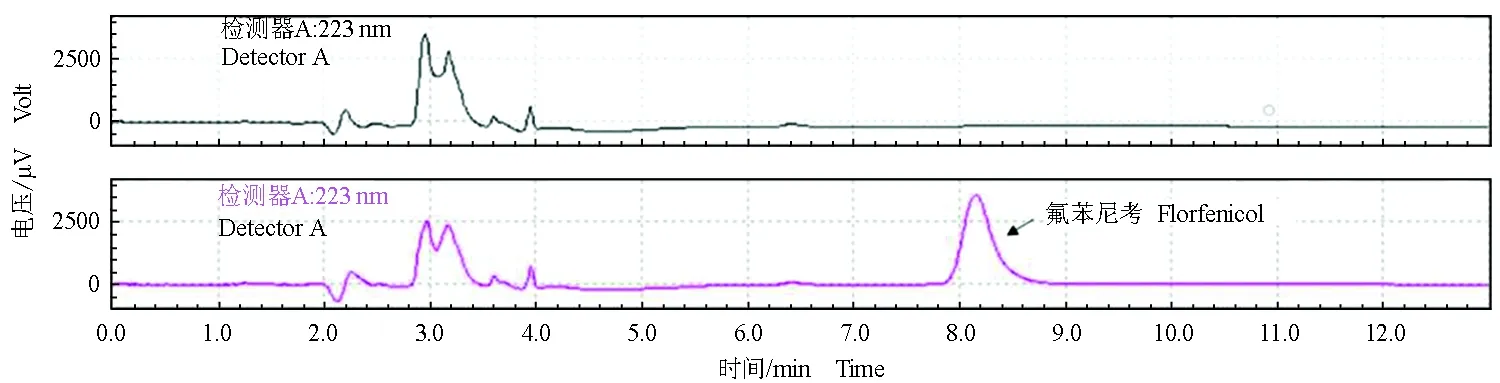
图2 氟苯尼考色谱图
回收率和精确度见表2。按照上述预处理方法水样的回收率为76.51%~96.23%,肝脏组织回收率为76.36%~83.50%,肌肉组织回收率为76.39%~84.09%,相对标准偏差<5%。日内精确度为0.91%~7.60%,日间精确度为1.23%~6.97%,均小于10%。本检测方法的检出限为75 ng/L,定量限为250 ng/L。因此,该预处理方法灵敏度高,数据具有真实性和可靠性。

表1 水样和鱼组织样品中氟苯尼考检测的回归方程和相关系数

表2 水样和鱼组织样品中氟苯尼考回收率与精确度
2.2 水样中氟苯尼考的分配规律
投喂含氟苯尼考的鱼饲料后12 h内氟苯尼考在循环水养殖系统中的分布规律见图3。4个取样点中氟苯尼考的质量浓度随投喂时间均呈先升后降的趋势,在投药后4 h各处理单元中氟苯尼考质量浓度达到峰值,其中生物滤池中氟苯尼考的残留量最高(7.45 μg/L),随着处理时间延长,各处理单元中氟苯尼考残留量显著下降,12 h时出水口中氟苯尼考的质量浓度降为2.10 μg/L。氟苯尼考经循环水系统内各处理单元分配去除,入水口中氟苯尼考残留质量浓度均高于出水口(P<0.01)。投药后1 h,出水口中氟苯尼考质量浓度高于入水口,可能是因为循环水养殖系统单次循环时间为1 h,投加的氟苯尼考在循环水养殖系统内蓄积还未得到充分处理。

图3 投药后12 h循环水养殖系统中氟苯尼考的分配规律
循环水养殖系统各处理单元中氟苯尼考的质量浓度在投药期和停药期分别呈逐渐升高和降低的趋势(图4)。随着投药时间的增加,系统内各处理单元中氟苯尼考的残留质量浓度呈不同程度积累上升。氟苯尼考在各处理单元中的富集分配比例不同。停药期间,各处理单元中氟苯尼考的残留质量浓度显著下降,提示循环水养殖系统对氟苯尼考具有显著的去除效果。停药第14 d入水口氟苯尼考质量浓度较投药第7 d相比降低了77.9%,远高于停药第4 d的35.5%和第7 d的49.4%。表明氟苯尼考在停药第7 d后在循环水系统中快速降解。停药第14 d各处理单元中的氟苯尼考水平恢复至与投药前相当的水平。投药期第7 d生物滤池中氟苯尼考残留质量浓度较蛋白分离器中氟苯尼考残留质量浓度高出5.2%,并且投药期第1、3 d,停药期第4、7、14 d均得出相同结果。表明生物滤池因自身特性,经过长时间的投药,自身会对氟苯尼考产生较强的积累效应。
为阐明停药期间不同处理单元对于氟苯尼考的降解率,对停药后不同时间段各处理单元的降解率进行计算分析。不同时期蛋白分离器对氟苯尼考平均降解率为(20.75±3.16)%,生物滤池为-(39.73±36.32)%,紫外消毒装置为(35.02±16.18)%(图5)。其中,紫外消毒在不同的停药时间段对循环水养殖系统中氟苯尼考的降解率最高,蛋白分离器次之,生物滤池在各时间段对循环水系统中氟苯尼考为负降解率。此外,停药第7 d各处理单元对氟苯尼考的降解率最高。

图4 投药期和停药期氟苯尼考在循环水养殖系统中的分配规律

图5 停药期循环水系统不同处理单元对氟苯尼考的降解率
2.3 鱼组织样品中氟苯尼考的分配规律
与水样中氟苯尼考含量的变化规律一致,氟苯尼考在鱼组织样品中残留水平随停药时间延长而降低。氟苯尼考在肌肉组织中更易富集,投药第7 d在肝脏和肌肉组织中氟苯尼考的含量分别为1.03 μg/g和1.88 μg/g(图6)。随着停药时间延长,氟苯尼考的残留水平逐渐下降,且在肌肉组织中氟苯尼考残留量始终高于肝脏组织中氟苯尼考的残留量。
停药第14 d,肝脏组织中氟苯尼考残留量较投药前相比高16.6%,肌肉组织中氟苯尼考残留量较投药前相比低15.5%。与投药第7 d相比,肝脏组织中停药第7 d的降解速率为33.3%,停药第14 d的降解率为81.9%。肌肉组织中停药第7 d的降解率为58.6%,停药第14 d的降解率为88.4%。表明肌肉组织中降解率大于肝脏组织中降解速率。且停药第7 d前降解率显著高于停药第7 d后。

图6 肝脏和肌肉组织中氟苯尼考的残留
3 讨 论
3.1 液相色谱方法检测水体和组织中氟苯尼考的残留
为保证试验结果的稳定性和准确性,通过改变流动相及其比例摸索流动相的最佳条件。甲醇和水、乙腈和水[14-15]是检测氟苯尼考最常用的流动相,试验结果表明,流动相为甲醇和水时,峰型较不稳定,易出现前伸峰和拖尾峰,而乙腈的溶剂强度较高且黏度低,并满足氟苯尼考在紫外区223 nm检测的要求。参考文献[16]的检测方法,进一步调整乙腈和水比例,发现在检测水样中乙腈∶水=40∶60,组织样品中乙腈∶水=27∶73时,精密度和回收率最佳,分离度良好,基本无拖尾现象。此方法快速、简单、实用,易于在实验室推广应用。
此外,为有效去除海水中杂质干扰,试验需采用固相萃取的方法[17],试验通过调整pH、活化、洗脱、吹干、涡旋等步骤[18],进一步使用Waters HLB柱,可得到较高的氟苯尼考回收率。在试验过程中增加超纯水淋洗步骤,使得样品涡旋溶解较为容易,出峰效果良好,杂质峰较少。
3.2 氟苯尼考在循环水系统水体中的迁移转化
随着现代科技的发展和环境保护的要求,传统的养殖模式已不符合当今资源节约、环境友好的要求。循环水养殖模式在国内外水产养殖生产中的应用日益普遍,其主要通过微滤机、蛋白分离器、生物滤池、紫外消毒等多个处理单元实现对养殖尾水的循环反复使用,在高度集约化养殖的同时保持养殖环境的水质稳定,并减少因养殖尾水排放对水环境的污染破坏[19]。循环水养殖模式不仅对水体中污染物含量可控,与传统养殖模式相比具有更高的单位产量。Martins等[20]利用循环水系统养殖大西洋鲑(Salmosalar)幼鱼1个月,其体质量增加至140~170 g,流水养殖模式中,大西洋鲑幼鱼的体质量为50~70 g。海水养殖的迅速发展,也使得养殖过程中细菌性疾病频发严重影响产业发展,制约水产品的品质和产量。为预防和治疗病害的发生,多种抗生素类渔药在养殖过程中被大量使用。
生物滤池是循环水养殖系统中不可或缺的处理单元。其主要是利用比表面积大、孔隙率高、截污能力强的填料附着生物膜[21],通过微生物的代谢,从而对氨氮、化学需氧量、总磷等产生稳定高效的去除效果[22]。近年来,因养殖排放水中抗生素的大量残留,国内外学者通过调整生物滤池的各项参数,开展大量研究以提高降解抗生素的效率。研究表明,生物滤池对抗生素的去除能力有限,赖后伟[23]研究发现,生物滤池对抗生素阿莫西林降解率较低,当水力停留时间为1 h时,阿莫西林平均降解率为18.1%,15 d后,水力停留时间提高到4 h,降解率才达到36.3%。此外,使用曝气生物滤池对含有磺胺噻唑的生活污水进行处理,发现随着时间的延长,降解率明显下降,这可能由于反应器中抗生素不断积累,对生物滤池内微生物的新陈代谢和生命活动产生影响,使得降解率降低[24]。本研究中生物滤池对氟苯尼考的降解率较低,甚至出现负效应,这可能是由于生物滤池内填料的比表面积较大,在处理初期,大量的填料和微生物对抗生素具有较强的吸附作用,随着氟苯尼考质量浓度的升高,可能会对生物滤池内的微生物产生毒性作用,使得其对氟苯尼考的降解率降低。而在停药后期,生物滤池又可能成为系统内氟苯尼考的释放源,氟苯尼考属于在水中溶解度较低的大分子物质[25],其较易被吸附于生物填料表面而不易被降解。随着循环水系统内氟苯尼考质量浓度的降低,蓄积在生物填料上的氟苯尼考反而会导致经过的养殖水中氟苯尼考质量浓度升高。
本试验结果显示,紫外消毒装置是循环水系统中氟苯尼考去除的主要工艺。光降解是抗生素在自然水环境中重要的消减途径,其反应机理主要是抗生素分子吸收光能后变成激发态从而引发各种反应,化合物吸收光能后可能发生直接光降解[26]。关于抗生素的光化学行为研究,国内外学者已经开展了一些工作,研究表明,在表层水体中光化学降解是抗生素类污染物的主要消减方式。氟苯尼考在避光条件下性质稳定;光照(波长300~800 nm)条件下,在纯水、淡水和海水中均很难发生光解反应[27];在紫外光(波长>200 nm)照射下,可发生直接光解和间接光解反应,包括氧化、脱氯、水解和侧链断裂等反应[28]。在日光照射下,氟苯尼考直接光解半衰期为187.29 h;在氙灯照射下,直接光解半衰期为22.43 h;在紫外—可见光照射下,辐射照度为4.10 mW/cm3时,直接光解半衰期为(17±2) min[29]。本试验采用紫外辐射照度为13.3 mW/cm3,远高于已报道试验中采用的紫外辐射照度(765 W/m3)[30],因而降解效率更快。蛋白分离器利用其泡沫分离的原理,可有效去除水中的悬浮物、蛋白质等,同时具有杀菌消毒作用,对于氟苯尼考去除的贡献率可能是由于泡沫吸附作用带离系统。
3.3 氟苯尼考在鱼体组织中的分布规律
我国的养殖水产品中先后出现了氯霉素、环丙沙星、孔雀石绿和硝基呋喃等抗生素类药物残留事件[31],使得养殖水产品的质量安全问题受到了公众广泛关注。同时,因抗生素残留超标,使得我国水产品进入欧盟、日本、韩国等市场受阻,严重影响我国水产品出口贸易,造成严重的经济损失。并因抗生素耐药性和潜在的健康危害,引发公共安全问题。在循环水养殖系统中,氟苯尼考因其高利用性和低排放率,被认为是环境友好型的农业养殖模式。但由于养殖种类、投药剂量和试验步骤等因素的差异,对于氟苯尼考半衰期、消耗率、组织分布、休药期的变化,无法直接进行对照比较。因此,需要进行大量试验研究。
肌肉作为水产品重要的可食用组织,抗生素在肌肉组织中的残留水平是消费者关注的重点。肝脏作为鱼体内的重要解毒器官,同时兼具鱼体消化、调节血糖平衡等功能,抗生素在肝脏的残留水平与养殖生物的免疫健康水平息息相关[32]。本试验使用10 mg/(kg·d)含氟苯尼考饲料治疗7 d,是氟苯尼考在水产动物中的标准用药量。我国、美国和欧盟均规定在鱼类可食用组织中氟苯尼考的最高残留限量为1 mg/kg,加拿大规定鲑科鱼类肌肉中氟苯尼考的最大残留限量为0.8 mg/kg。抗生素在鱼类体内吸收、分布、转化和消除需要一个过程,为达到该标准,我国和美国规定氟苯尼考的休药期分别≥7 d和15 d。本试验中,欧洲舌齿鲈在停药第7 d后肝脏和肌肉中氟苯尼考残留量低于《动物性食品中兽药最高残留限量》[4]规定的氟苯尼考最高残留限量,建议循环水养殖欧洲舌齿鲈的氟苯尼考休药期为7 d。不同的鱼种及暴露方式在药物的吸收、转移分布方面存在差异。循环水系统中水循环往复的使用,养殖鱼类可能会通过吸收水中残留的氟苯尼考而引起其在鱼体内蓄积。Meinertz等[33]在循环水养殖系统中对虹鳟(Oncorhynchusmykiss)使用20 mg/(kg·d)的氟苯尼考投喂10 d,停药后的第11 h肌肉中氟苯尼考含量达到峰值(442 μg/kg),480 h后降至9 μg/kg,提示循环水养殖系统水中氟苯尼考的残留水平对鱼体残留的贡献可忽略不计。以20 mg/(kg·d)剂量的氟苯尼考对褐牙鲆(Paralichthysolivaceus)连续经口灌药3 d,第7 d后氟苯尼考在肌肉、鳃和肝脏的含量分别为(0.29±0.16) μg/g、(0.34±0.24) μg/g和(0.25±0.17) μg/g,其肌肉组织的氟苯尼考残留量最高,建议休药期为7.91 d,此结果[34]与本试验结果一致。此外,黄聚杰等[35]以60 mg/(kg·d)的氟苯尼考对花鲈(Lateolabraxmaculatus)单次给药,给药1 d后氟苯尼考在肝脏中的含量高于肌肉,这可能是因为氟苯尼考具有较强的溶脂性,而肝脏中脂肪高于其他部位,导致其含量最高。本试验中肝脏中氟苯尼考含量均低于肌肉组织,可能是与不同鱼体间的差异性、鱼体的生理状态以及养殖环境的条件因素有关,也可能是由于肝脏作为解毒器官,对氟苯尼考产生自身降解,从而导致氟苯尼考肝脏残留量始终低于肌肉组织。
4 结 论
通过连续7 d投喂含氟苯尼考的配合饲料,检测氟苯尼考在循环水养殖系统中的残留规律。得出以下结论:
(1)氟苯尼考在循环水系统水体中的迁移转化规律:循环水养殖系统中各处理单元氟苯尼考的质量浓度随着投药时间的增加,呈不同程度积累上升,在投药第7 d时各处理单元氟苯尼考的残留质量浓度均达到最大值。停药后,氟苯尼考残留质量浓度逐渐下降,停药第14 d各处理单元中的氟苯尼考水平与投药前水平相当。同时,停药期间不同处理单元对于氟苯尼考降解率的贡献:紫外消毒装置>蛋白分离器>生物滤池。
(2)氟苯尼考在鱼体组织中的分布规律:根据《动物性食品中兽药最高残留限量》,本试验为欧洲舌齿鲈氟苯尼考休药期的制定提供理论依据,停药第7 d后肝脏和肌肉组织当中氟苯尼考残留量低于规定的氟苯尼考最高残留限量(1000 μg/kg)。
