NADPH氧化酶活化介导七叶皂苷诱导人神经瘤母细胞凋亡
2020-05-25张一鸣李懿宸王振华
张一鸣,孙 莹,李懿宸,安 艺,何 杰,李 刚,李 忌,王振华
(烟台大学生命科学学院/线粒体与健康衰老研究中心,山东 烟台 264005)
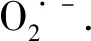
七叶皂苷(结构式如图1)是一种来源于七叶树的三萜皂苷类化合物,具有广泛的抗炎、抗水肿活性[13].本研究所用七叶皂苷钠为七叶皂苷的钠盐形式,其具有同样的生物活性[14].文献报道七叶皂苷可通过提升细胞内活性氧水平来诱发凋亡以及自噬来产生抗肿瘤活性[15-17],但对于其诱发肿瘤细胞中活性氧来源鲜有明确报道.本研究以人神经瘤母细胞系SH-SY5Y细胞作为体外模型,考察七叶皂苷诱导SH-SY5Y细胞凋亡的同时,探究其诱发ROS的可能来源,为揭示其确切抗肿瘤机制提供前期数据.
1 材 料
1.1 实验细胞系
人神经瘤母细胞系SH-SY5Y细胞购于中国科学院上海细胞库,于DMEM培养基、10% FBS血清、5% CO2、37℃恒温培养箱培养.细胞融合度达到80%进行传代培养.
1.2 仪器与设备
CO2恒温培养箱(日本三洋电器集团);生物超净工作台(苏州净化设备有限公司);倒置相差显微镜(香港Motic公司);多功能酶标仪(Molecular Device公司);流式细胞仪(艾森生物);AR-2140 型万分之一电子天平(梅特勒-托利多仪器有限公司);HC-3018R 型高速冷冻离心机(安徽中科中佳科学仪器有限公司);HHS-1 精密恒温水浴锅(金坛市医疗器械厂);蛋白电泳仪(美国Bio-Rad公司);Tanon5500凝胶成像系统(上海天能科技有限公司).
1.3 材料与试剂
七叶皂苷钠(纯度>98%,烟台大学药学院傅风华教授惠赠);MTT、细胞周期检测试剂盒、细胞凋亡试剂盒(北京拜尔迪公司);NAC(N-乙酰-L-半胱氨酸,总活性氧抑制剂)、Mito-tempo(线粒体源活性氧抑制剂)、DCFH-DA探针(美国sigma公司);DPI(二亚苯基碘,NADPH氧化酶抑制剂)(美国Selleck公司);β-actin一抗、Caspase 3一抗(美国CST公司);HRP耦联山羊抗兔IgG (美国Santa Cruz Biotechnology公司).
2 方 法
2.1 细胞实验分组
梯度Rh2干预实验:对照组(含有等量的溶剂对照)、实验组(不同浓度Rh2处理).
抑制剂干预实验:对照组(含有等量的溶剂对照)、七叶皂苷处理组、抑制剂处理组(包括NAC、Mito-tempo、DPI抑制剂)、抑制剂与七叶皂苷联用组(包括NAC、Mito-tempo、DPI抑制剂分别与七叶皂苷联用).抑制剂提前30 min预处理.
2.2 细胞活力检测
细胞按照5×104个/mL每孔100 μL接种于96孔板,孵育24 h,细胞贴壁后按实验分组,各孔补充100 μL含药(处理组)或不含药(对照组)完全培养基,继续孵育至48 h或72 h.处理终点后,吸弃原培养体系,每孔加入100 μL含10% MTT(5 mg/mL)DMEM培养液,培养箱中恒温作用4 h.小心吸弃含MTT体系,每孔加入200 μL DMSO溶液,水平震荡15 min,酶标仪570 nm 波长下测定吸光度A570,A570经调零孔校正后,如下式得出细胞增殖活力水平:细胞增殖活力=实验组A570(校正后)/对照组A570(校正后)×100 %.48 h药物作用IC50值采用Graphpad prism拟合分析得出.
2.3 细胞内活性氧检测
细胞按照1×105个/mL每孔3 mL接种于6孔板,细胞贴壁后按实验分组进行药物处理.处理终点后,细胞经胰酶消化处理成单细胞悬液,PBS清洗一遍消除胰酶影响;PBS重悬细胞经5 μmol/L DCFH-DA探针37 ℃避光孵育30 min,PBS清洗一遍,每个样品500 μL 重悬吹打均匀,FITC通道下检测(每例至少收集10 000个细胞);Novo Express软件分析相应流式数据.
2.4 细胞周期检测
细胞按照1×105个/mL每孔3 mL接种于6孔板,细胞贴壁后按实验分组进行药物处理.处理终点后,按照试剂盒规定方法操作测定,具体如下:细胞经胰酶消化处理成单细胞悬液,PBS清洗2遍消除胰酶影响,70% 4 ℃预冷乙醇固定2 h以上;去除固定液,PBS清洗2遍消除乙醇影响;染色结合缓冲液重悬细胞,经100 μg/mL RNase A、50 μg/mL PI 37 ℃避光孵育30 min,PerCP通道下检测(每例至少收集10 000个细胞);Novo Express软件通过Waston模型周期拟合分析相应流式数据.
2.5 细胞凋亡检测
细胞按照1×105个/mL每孔3 mL接种于6孔板,细胞贴壁后按实验分组进行药物处理.处理终点后,按照试剂盒规定方法操作测定,具体如下:细胞经胰酶消化处理成单细胞悬液,PBS清洗2遍消除胰酶影响,1×染色结合缓冲液重悬细胞,经5 μL Annexin V-FITC染料标记15 min后,5 μL PI染料标记5 min(染色过程室温下避光进行).FITC、PerCP通道下检测(每例至少收集10 000个细胞);Novo Express软件分析相应流式数据.
2.6 细胞内蛋白表达检测
细胞经药物处理终点后,4 ℃条件下细胞经裂解液(RAPA∶PMSF=100∶1,PMSF母液浓度为100 μmol/L)裂解后,细胞刮刮取收集蛋白,充分裂解20 min后4 ℃,15 000×g离心15 min取上清即得细胞总蛋白.蛋白经BCA法蛋白定量后,金属浴95 ℃加热变性.30 μg变性蛋白行经SDS-PAGE电泳,转印于PVDF薄膜上.4 ℃条件下对应一抗震荡孵育过夜,一抗孵育后TBST清洗3次,每次10 min,二抗室温孵育1 h,二抗孵育后TBST清洗3次,每次10 min.PVDF膜经ECL超敏发光液处理后,于Tanon 5500凝胶成像系统下聚焦采集蛋白条带,相应蛋白半定量结果经Image J 处理得出.
2.7 统计方法
3 结 果
3.1 七叶皂苷引起SH-SY5Y细胞增殖抑制
为探究七叶皂苷对人神经瘤母细胞SH-SY5Y细胞的抗肿瘤活性,分别采用不同浓度七叶皂苷作用于细胞24 h和48 h(图2).实验结果表明:七叶皂苷时间及浓度依赖性抑制细胞增殖(P<0.05),七叶皂苷介导48 h其IC50约为43 μmol/L.提示七叶皂苷对SH-SY5Y细胞有一定的抗肿瘤活性.
3.2 七叶皂苷引起SH-SY5Y细胞内活性氧的产生
肿瘤细胞内活性氧水平的失衡会引起肿瘤细胞的死亡,为探究七叶皂苷是否会引起SH-SY5Y细胞内活性氧的产生,本实验采用细胞内活性氧探针DCFH-DA来表征细胞内活性氧的产生情况.探针DCFH-DA进入细胞后,会进行基团脱离形成没有荧光的DCF,一旦活性氧产生,DCF会发出绿色荧光,从而可以表征细胞内ROS水平.结果如图3—图6所示,与对照组相比,采用30~50 μmol/L七叶皂苷处理至2 h,诱导细胞内ROS水平呈浓度依赖性升高(P<0.05);采用50 μmol/L七叶皂苷处理至2 h,细胞内ROS水平随处理时间延长而逐渐升高(P<0.05).表明七叶皂苷可引起SH-SY5Y细胞内活性氧的产生.
3.3 DPI降低七叶皂苷引起SH-SY5Y细胞内活性氧的产生
为探究七叶皂苷引起细胞内活性氧产生的来源,本实验运用总活性氧抑制剂NAC、线粒体源活性氧抑制剂Mito-tempo以及NADPH氧化酶抑制剂DPI进行预处理干预,以验证不同来源ROS对七叶皂苷所致SH-SY5Y细胞增殖的贡献.结果表明(图7、图8):2 mmol/L NAC以及10 μmol/L DPI预处理30 min均显著降低七叶皂苷引起的活性氧增加(P<0.05),但10 μmol/L Mito-tempo未有明显作用(P>0.05).提示NADPH氧化酶活化或与七叶皂苷诱导的细胞内ROS生成增加相关.
3.4 DPI降低七叶皂苷引起SH-SY5Y细胞增殖抑制
为进一步验证NADPH氧化酶来源活性氧与七叶皂苷诱导细胞增殖抑制作用关系,考察了NADPH氧化酶抑制剂对七叶皂苷所致细胞增殖抑制的干预作用,结果发现:与对照组相比,本实验选用过的10 μmol/L DPI单独处理未造成显著的细胞增殖抑制(P>0.05),但其与七叶皂苷联合处理后,可显著降低七叶皂苷引起的细胞增殖抑制(P<0.05)(图9).形态学观察表明,50 μmol/L七叶皂苷处理可致细胞皱缩、裂解并脱落后死亡,10 μmol/L DPI处理未见明显影响,DPI与七叶皂苷联合处理组细胞形态基本正常,未见明显皱缩脱落现象,但细胞内出现大量空泡(图10),其确切机制有待进一步揭示.提示NADPH氧化酶合成的ROS参与了七叶皂苷引起的细胞增殖抑制调控.
3.5 DPI改善七叶皂苷所致SH-SY5Y细胞周期阻滞
细胞增殖抑制一般与细胞周期阻滞相关,本研究采用PI单染后流式细胞仪测定了细胞周期分布,结果表明(图11、图12),七叶皂苷处理后,S期细胞占比明显增加(P<0.05),DPI联合处理可显著降低S期细胞占比(P<0.05).提示NADPH氧化酶合成的ROS参与了七叶皂苷引起的细胞周期阻滞于S期.
3.6 DPI抑制七叶皂苷诱导的Caspase 3剪切
Caspase 3剪切是细胞凋亡性死亡的的关键分子标志,为进一步探究七叶皂苷诱导SH-SY5Y细胞死亡机制,采用Western Blot考察了七叶皂苷对Caspase 3剪切的影响,结果表明(图13、图14):七叶皂苷明显增加Caspase 3蛋白剪切水平(P<0.05),提示凋亡七叶皂苷细胞毒性相关;采用DPI预处理降低了七叶皂苷所致的Caspase 3蛋白剪切(P<0.05),提示NADPH氧化酶来源的ROS参与了七叶皂苷诱发的细胞凋亡.
3.7 DPI抑制七叶皂苷诱导的细胞凋亡
为探究七叶皂苷诱导SH-SY5Y细胞凋亡情况,采用Annexin V-PI双染考察了七叶皂苷对细胞凋亡的影响,结果表明(图15、图16):七叶皂苷明显增加细胞早期和晚期凋亡细胞数;采用DPI预处理降低了七叶皂苷所致的细胞凋亡,提示NADPH氧化酶来源的ROS参与了七叶皂苷诱发的细胞凋亡.
4 讨 论
七叶皂苷具有广泛的抗炎、抗水肿等活性[13],现有证据表明七叶皂苷有一定抗肿瘤活性,但其明确分子机制仍未阐明.诱发肿瘤细胞内ROS生成增加或清除减少所致的氧化胁迫,是抗肿瘤药物发挥活性的重要机制之一.但鉴于ROS来源的复杂性,七叶皂苷抗肿瘤活性确切机制仍未报道.
本研究采用人神经瘤母细胞系SH-SY5Y细胞作为体外模型,评价了七叶皂苷的抗肿瘤活性,发现七叶皂苷呈浓度和时间依赖性地造成细胞增殖抑制以及诱导细胞内ROS生成增加,活性氧水平升高会对正常细胞以及肿瘤细胞DNA、蛋白质以及脂类造成不同程度的损伤,诱发细胞死亡[18-19].七叶皂苷能够引起细胞发生S期阻滞、磷脂酰丝氨酸的外翻和凋亡执行蛋白Caspase 3剪切,细胞形态皱缩、裂解并脱落,提示凋亡介导了七叶皂苷的细胞毒活性.为阐明七叶皂苷诱导SH-SY5Y细胞内ROS生成的源头,同时采用非靶向抗氧化剂NAC、线粒体靶向抗氧化剂Mito-tempo以及NADPH氧化酶抑制剂DPI联合七叶皂苷干预,发现NAC和DPI可显著抑制七叶皂苷诱导的细胞内ROS水平升高,而Mito-tempo未有明显作用,提示NADPH氧化酶活化应为七叶皂苷致细胞氧化胁迫损伤的源头.进一步发现DPI能够逆转七叶皂苷所引起的细胞增殖抑制、周期阻滞以及细胞凋亡,表明NADPH氧化酶来源的ROS介导了七叶皂苷的细胞毒活性.
凋亡作为细胞程序化死亡的重要方式之一,诱导肿瘤细胞凋亡对于肿瘤临床治疗有重要意义[9].本研究进一步证实过量ROS生成所致氧化胁迫参与了七叶皂苷诱导肿瘤细胞凋亡过程,并阐明了NADPH氧化酶为其重要源头,为七叶皂苷的进一步推广研究提供了数据支撑.
5 结 论
以人神经瘤母细胞系SH-SY5Y细胞评价七叶皂苷的体外抗肿瘤活性,发现七叶皂苷可以通过NADPH氧化酶的活化引起人神经瘤母细胞凋亡.
