TGF-β1调控人脑胶质瘤细胞迁移和侵袭能力的机制研究
2020-05-23钞敏刘楠娄淼刘竞辉翟玉龙王樑涂艳阳
钞敏,刘楠,娄淼,刘竞辉,翟玉龙,王樑,涂艳阳
(空军军医大学唐都医院 a.神经外科,b.实验外科,西安 710038)
恶性脑胶质瘤是最常见的原发性中枢神经系统肿瘤,占颅内肿瘤的50%~60%[1]。此外,由于胶质瘤恶性程度较高,呈浸润性生长,与正常脑组织分界不清,导致手术难以全部切除,因此,临床上常采用术后放疗联合替莫唑胺或丙卡巴嗪、洛莫司汀及长春新碱方案化疗[2]。尽管手术治疗、程序性细胞死亡受体1靶向治疗和免疫治疗等手段逐步发展,但恶性胶质瘤的预后仍较差[3-4],低级别胶质瘤患者的中位生存期只有7年[5-6],而高级别胶质瘤患者的2年生存率只有25%[7]。世界卫生组织2016年的中枢神经系统肿瘤分类方案首次将异柠檬酸脱氢酶突变和其他基因及染色体改变纳入分类标准,在组织学分类的基础上将胶质瘤再次分为异柠檬酸脱氢酶突变型(约10%)和异柠檬酸脱氢酶野生型(约90%)[8-9]。然而,肿瘤的发生和发展受到多种基因组成的复杂网络调控,因此,研究胶质瘤发生发展的分子机制,寻找新的治疗靶点,是胶质瘤临床治疗过程中亟待解决的难题。
研究发现,在软骨细胞中转化生长因子-β1(transforming growth factor-β1,TGF-β1)可以稳定Sox9蛋白的表达,且Sox9过表达会上调TGF-β1的作用靶标3′-磷酸腺苷-5′-磷酰硫酸合成酶2 mRNA的表达[10-11]。在食管腺癌细胞和成纤维细胞中,TGF-β的配体β2SP(β-spectrin)丢失会激活Notch通路和Sox9表达,并增强Notch和Sox9的核定位[12]。因此,推测在胶质瘤细胞中TGF-β1与Sox9存在上述调控关系。本研究主要探索TGF-β1调控胶质瘤迁移和侵袭能力的机制,为胶质瘤的临床治疗和科学研究提供新的思路。
1 材料与方法
1.1材料
1.1.1主要试剂及材料 U251胶质瘤细胞、U373胶质瘤细胞及BV2小胶质细胞均购自中国科学院上海生科院细胞库,改良Eagle培养基(Dulbecco′s modification of Eagle′s medium dulbecco,DMEM)(美国Hyclone公司,批号:SH30243.01B)、磷酸盐缓冲液(phosphate buffer saline,PBS)(美国Hyclone公司,批号:SH30256.01B)、胰酶(美国Sigma公司,批号:9002-07-7)、TGF-β1(上海近岸科技有限公司,批号:CA59)、Sox9抗体(美国Abcam公司,批号:ab185230)、β-actin抗体(武汉Abclonal生物科技有限公司,批号:AC026)、辣根过氧化物酶标记的兔二抗(武汉Abclonal生物科技有限公司,批号:AS014)、青-链霉素双抗(美国Hyclone公司,批号:SV30010)、胎牛血清(德国Gemini公司,批号:A49F74G)、蛋白裂解液(上海碧云天生物技术公司,批号:0330181805)、Matrigel基质胶(美国Coring公司,批号:8071270)、聚偏二氟乙烯膜(美国Millpore公司,批号:IPVH00010)、超敏化学发光底物检测试剂盒(西安晶彩生物公司,批号:JC-PC001)、Transwell小室(美国Corning公司,批号:3402)。
1.1.2主要仪器 Western Blot实验装置(美国Bio-Rad公司,型号:1645050)、紫外发光成像仪(美国Bio-Rad公司,型号:ChemiDoc XRS+)、低温离心机(德国Eppendorf公司,型号:5804R)、紫外分光光度仪(美国Bio-Rad公司,型号:1681135)、倒置相差显微镜(日本Olympus公司,型号:GX71)、恒温细胞孵育箱(美国Thermo公司,型号:3308)、细胞培养工作台(江苏太仓实验仪器厂)。
1.2方法
1.2.1Western Blot检测胶质瘤细胞中Sox9的表达 取U251胶质瘤细胞和BV2小胶质细胞各一皿,用细胞刮刀将细胞收集在1.5 mL离心管内,加入100 μL预冷的蛋白裂解液,在冰上裂解30 min;4 ℃,以离心半径8 cm,12 000 r/min离心15 min,转移上清至新的1.5 mL离心管中,聚氰基丙烯酸正丁酯法蛋白定量后,按比例加入5×上样缓冲液,煮沸10 min使蛋白变性;按照每孔10 μg的总蛋白量进行变性蛋白电泳100 V 2 h;湿转法250 mA转膜2.5 h;用5%脱脂奶粉溶液室温封闭2 h;经Sox9抗体(1∶1 000)、β-actin抗体(1∶150 000)4 ℃孵育过夜;TBST(Tris盐酸缓冲盐溶液+Tween)溶液洗涤3次,每次10 min,辣根过氧化物酶标记的兔二抗(1∶10 000)室温孵育2 h,TBST洗涤3次,每次10 min;暗室内在PVDF膜上滴加超敏化学发光底物进行化学发光,以上实验重复3次。
1.2.2TGF-β1处理U251和U373胶质瘤细胞 将生长汇合至80%的U251和U373胶质瘤细胞分别传代至12个6 cm皿内,分为处理组和未处理组,于37 ℃、5% CO2细胞培养箱内培养24 h后,各取 6皿处理组U251和U373胶质瘤细胞加入TGF-β1,终浓度为5 μg/L,未处理组不予任何处理,作为对照,记录时间,用细胞刮刀分别收取20 min、40 min、1 h、2 h、4 h及6 h的处理组及未处理组细胞于1.5 mL离心管内;加入蛋白裂解液,冰上裂解30 min,4 ℃,以离心半径8 cm,12 000 r/min离心15 min,转移上清至新的1.5 mL离心管内,聚氰基丙烯酸正丁酯法蛋白定量后,按比例加入5×上样缓冲液,煮沸10 min使蛋白变性后行Western blot实验,实验重复3次。
1.2.3划痕愈合实验 取处于对数生长期的U373和U251胶质瘤细胞接种于6孔板中,分为处理组和未处理组,调整细胞密度为5×105/mL,铺板生长24 h后,处理组用TGF-β1分别处理U251胶质瘤细胞2 h和U373胶质瘤细胞20 min,终浓度为5 μg/L,未处理组不予任何处理,作为对照,平行于6孔板长边用记号笔在背面划线,用无菌的200 μL枪头沿着直尺在6孔板内垂直画3条平行的划痕,PBS洗去残余漂浮细胞,更换为无血清培养基后,在倒置显微镜下标记并拍照记录,之后在37 ℃、5% CO2培养箱内继续培养,分别镜下拍照记录同一视野24 h及48 h的胶质瘤细胞的迁移距离。
1.2.4Transwell迁移实验 取处于对数生长期的U373和U251胶质瘤细胞,分为处理组和未处理组,处理组用TGF-β1分别处理U251胶质瘤细胞2 h和U373胶质瘤细胞20 min,未处理组不予任何处理,作为对照,胰酶消化并用无血清的培养基重悬,调整细胞浓度为1×104/mL,以200 μL/孔将细胞悬液加入 Transwell小室上室,每个下室加入600 μL含10%胎牛血清的培养基,置于37 ℃、5% CO2细胞培养箱继续培养24 h后,取出Transwell小室上室,用棉签拭去小室上层的细胞,弃去培养基,预冷PBS洗去小室上层残余培养基及脱落细胞,用100%甲醇溶液室温固定20 min,PBS冲洗2次,风干后用0.1%结晶紫的染色10 min,PBS洗去未结合的染液,将Transwell小室上室放入干净24孔板中,置于倒置显微镜下观察并拍照,每张膜随机选取5个高倍镜视野,计数小室底膜下室面的细胞数。
1.2.5Transwell侵袭实验 Matrigel基质胶1∶8稀释后包被Transwell小室上室,放入37 ℃、5% CO2细胞培养箱中4 h,取处于对数生长期的U373和U251胶质瘤细胞,分为处理组和未处理组,处理组用TGF-β1分别处理U251胶质瘤细胞2 h和U373胶质瘤细胞20 min后,胰酶消化并用无血清的DMEM重悬,调整细胞浓度为1×104/mL,以200 μL/孔将细胞悬液加入包被好的Transwell小室上室,剩余步骤同标题1.2.4。

2 结 果
2.1Sox9在胶质瘤细胞中的表达 Western blot结果显示,U251胶质瘤细胞的Sox9蛋白表达水平高于 BV2小胶质细胞(1.816±0.143比0.282±0.014)(t=10.670,P<0.001),见图1。
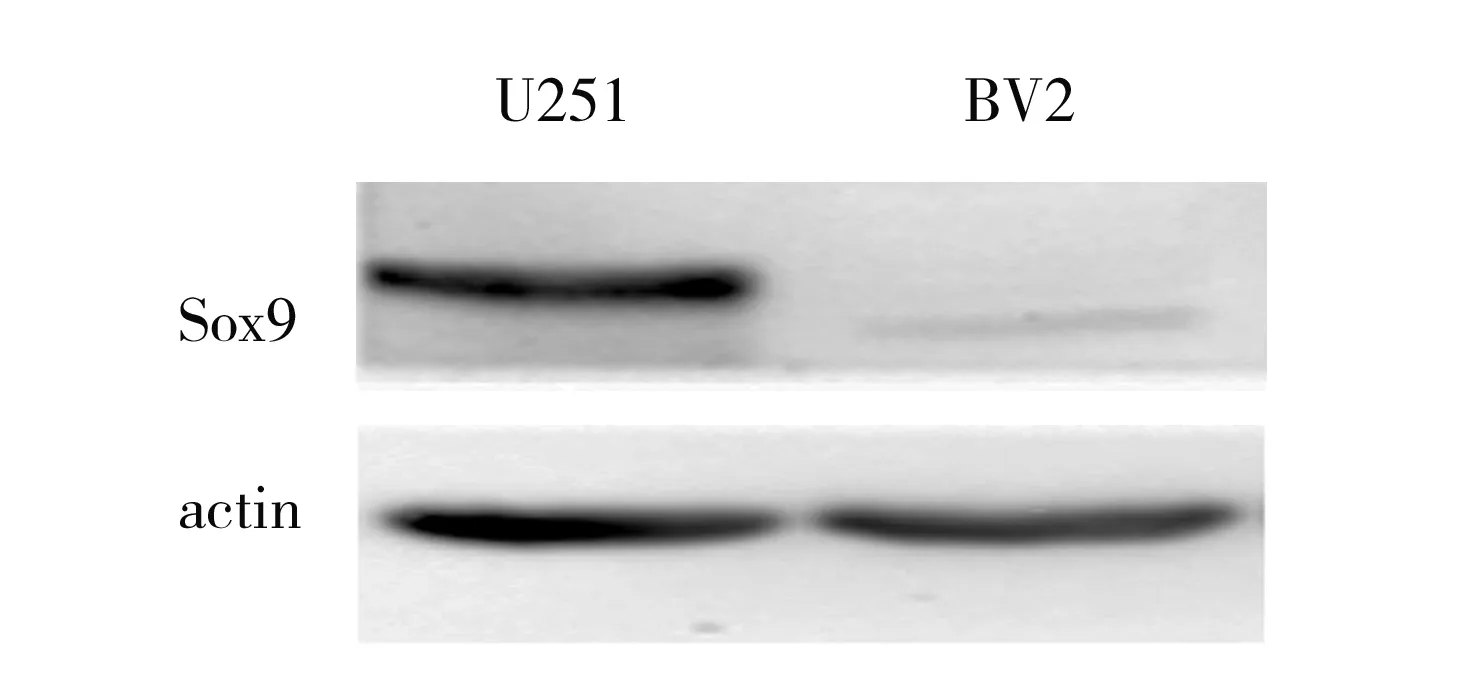
图1 BV2小胶质细胞与U251胶质瘤细胞中Sox9的表达水平
2.2TGF-β1处理U251和U373胶质瘤细胞后的Sox9蛋白表达水平 TGF-β1分别处理U251细胞2 h 及U373细胞20 min后Sox9的蛋白表达水平高于未处理组(P<0.05),其他时间点比较差异无统计学意义(P>0.05),见表1、表2、图2、图3。

组别20 min40 min1 h2 h4 h6 h未处理组2.198±0.511.712±0.3821.827±0.397 1.347±0.0242.239±0.656 1.816±0.285TGF-β1处理组1.909±0.341.586±0.096 1.731±0.2271.570±0.0611.616±0.0722.111±0.162t值0.4690.3200.2113.4390.9450.899 P值0.663 0.765 0.844 0.026 0.398 0.419
TGF-β1:转化生长因子-β1

组别20 min40 min1 h2 h4 h6 h未处理组1.490±0.0361.882±0.573 1.713±0.211 1.821±0.3901.898±0.3112.136±0.430TGF-β1处理组2.125±0.1882.045±0.5291.234±0.2152.030±0.6102.562±0.801.627±0.178t值3.3180.2081.5920.2880.7731.095P值0.0290.8450.1870.7880.4820.335
TGF-β1:转化生长因子-β1

TGF-β1:转化生长因子-β1;+:TGF-β1处理组;-:未处理组

TGF-β1:转化生长因子-β1;+:TGF-β1处理组;-:未处理组
2.3TGF-β1分别处理U251和U373胶质瘤细胞后迁移能力 划痕愈合实验检测胶质瘤细胞的迁移距离结果显示,TGF-β1处理2 h后的U251胶质瘤细胞24 h和48 h的迁移距离大于未处理组,TGF-β1处理20 min后的U373胶质瘤细胞24 h和48 h迁移距离大于未处理组,见图4。
2.4TGF-β1分别处理U251和U373胶质瘤细胞后的侵袭能力 Transwell实验检测胶质瘤细胞的迁移和侵袭能力结果显示:处理组的U251和U373胶质瘤细胞的迁移能力均大于未处理组(188.2±10.5比142.8±5.6,102.7±0.9比77.0±1.7)(t=3.836,P=0.005;t=13.990,P<0.001);处理组的U251和U373胶质瘤细胞的侵袭能力均较未处理组增强(117.9±2.6比74.7±4.2,123.3±6.0比69.6±2.5)(t=8.845,P<0.001;t=8.254,P<0.001),见图5。
3 讨 论
TGF-β信号通路是一条极为重要的细胞内信号转导途径。哺乳动物的TGF-β有TGF-β1、TGF-β2和 TGF-β33种亚型,激活的TGF-β细胞因子通过与细胞膜上Ⅰ型和Ⅱ型的TGF-β跨膜丝氨酸/苏氨酸激酶受体结合,形成异源复合物从而启动细胞内反应[13-14]。大量的体内体外实验表明,TGF-β能够通过影响肿瘤微环境、增强侵袭性质和抑制免疫细胞功能来促进肿瘤细胞的转移,并且调控多种不同的细胞生物学效应,其中包括细胞的增殖、分化、迁移和黏附、凋亡等[15-16]。
TGF-β通路与Sox9均参与调控肿瘤的发生、发展过程,有研究表明Sox9可能是TGF-β调控部分肿瘤发生发展过程中的重要下游靶点[17]。Sox9作为干性转录因子,是多种信号通路的重要节点[18-21],参与调控乳腺癌[22]、肝癌[23]、肺癌[20,24]、胶质瘤[25]等多种肿瘤的发生发展过程。Hiraoka等[17]证实了Sox9对富含亮氨酸重复序列的G蛋白偶联受体5的转录调控在胶质母细胞瘤的发生过程中起重要作用。de Bont等[26]通过微阵列分析技术表明Sox9在儿童室管膜瘤中高表达。Gao等[27]提出Sox9在脑胶质瘤中高表达,且与患者的预后密切相关。

TGF-β1:转化生长因子-β1;con:未处理组;TGF-β1+:TGF-β1处理组
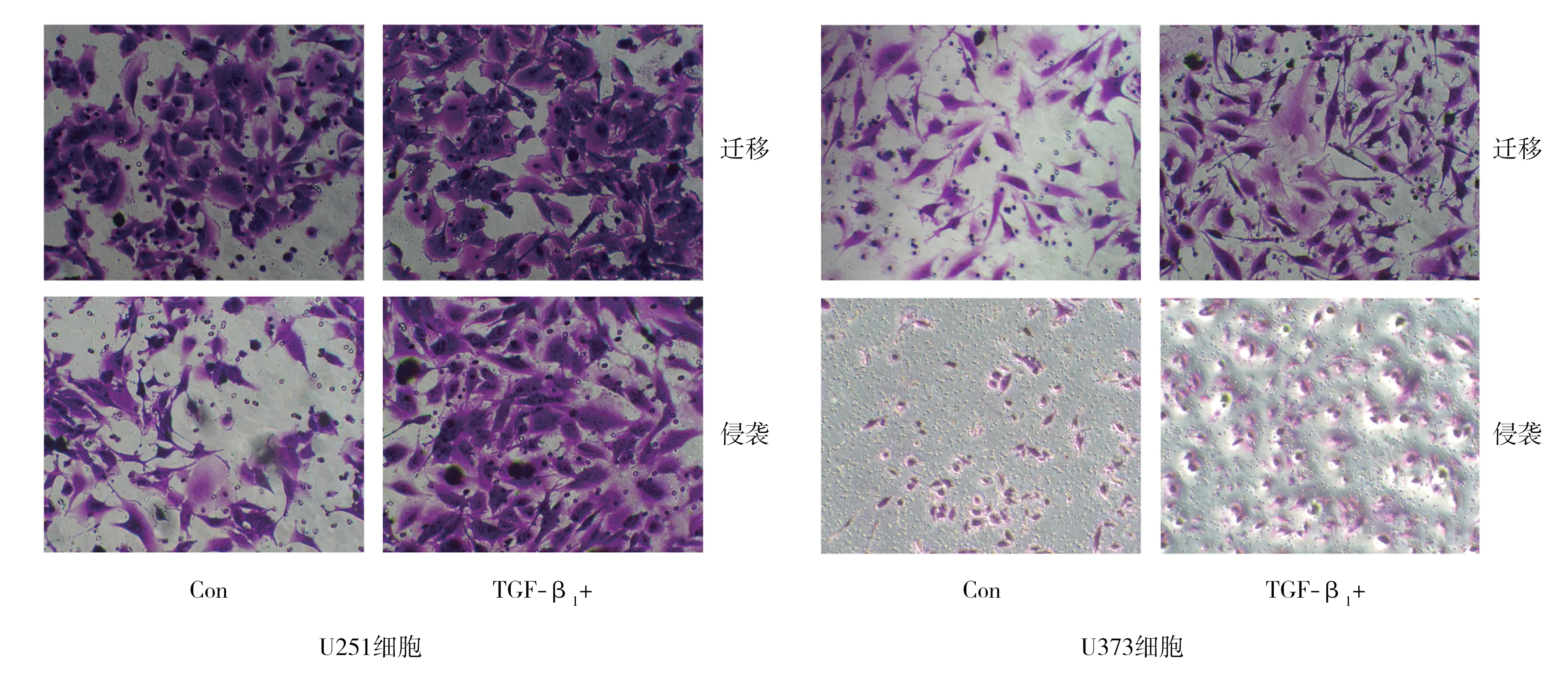
TGF-β1:转化生长因子-β1;con:未处理组;TGF-β1+:TGF-β1处理组
Sabelström等[28]研究发现miR-124可以通过直接靶向作用于Sox9抑制胶质瘤的侵袭,并且可以增加其放疗敏感性。研究表明,Sox9在胶质瘤组织中高表达,其在胶质瘤的增殖、迁移和侵袭,以及胶质瘤干细胞的自我更新中扮演重要角色,与胶质瘤的发生发展密切相关[29-30],但是其在胶质瘤发生发展中的具体机制尚不完全清楚。本研究结果显示,与小胶质细胞相比,胶质瘤细胞中Sox9表达升高。有研究表明,Sox9表达下调后,胶质瘤细胞的迁移、侵袭能力均降低,说明Sox9与胶质瘤的发生发展关系密切[31]。
Chavez等[11]和Song等[12]研究发现,在软骨细胞、食管腺癌细胞和成纤维细胞中,TGF-β可以通过稳定Sox9的蛋白水平调控其下游分子的表达。为了验证在胶质瘤的发生发展过程中,TGF-β与Sox9是否存在上述类似的调控关系,本研究采用TGF-β1细胞因子处理胶质瘤细胞,观察Sox9蛋白水平的表达情况,这是因为在体内TGF-β通路的主要作用因子是TGF-β1。本研究结果显示,在U251及U373胶质瘤细胞中,TGF-β1均可以稳定Sox9蛋白表达,但两个细胞系Sox9表达峰值出现的时间点有差别,这可能是由于不同的细胞系对TGF-β1的敏感性不同导致的。本研究细胞功能实验结果显示,与未处理组相比,TGF-β1处理组的细胞迁移和侵袭能力均增强。其原因可能是TGF-β1通过稳定Sox9蛋白的表达调控胶质瘤的迁移和侵袭能力,具体的机制有待下一步通过染色质免疫共沉淀以及挽救实验等来探索。
综上所述,本研究初步证实了在胶质瘤细胞内TGF-β1通过稳定Sox9蛋白表达促进胶质瘤细胞的迁移及侵袭能力,下一步将构建稳转细胞系通过挽救实验等进一步验证TGF-β1与Sox9在胶质瘤内的调控关系,同时提出猜想:在胶质瘤细胞中,TGF-β1是否通过经典的Smad蛋白来调控Sox9转录因子的表达,进一步对TGF-β通路通过稳定Sox9蛋白表达调控胶质瘤发生发展的具体机制进行探索,寻找胶质瘤发生发展过程中新的机制和治疗靶点,为脑胶质瘤的临床治疗提供新的思路和方向。
