低强度超声体外抑制SMMC-7721细胞增殖
2020-05-23石明芳刘邦忠刘光华杨名珍
石明芳, 刘邦忠, 刘光华, 王 平, 杨名珍
复旦大学附属中山医院康复科,上海 200032
低强度超声(low-intensity pulsed ultrasound,LIPUS)是治疗频率和强度均较低的波,具有组织中易穿透、声能吸收少、对组织损伤小的特点。LIPUS具有机械效应、空化效应和热效应,被广泛应用于临床治疗中,能够有效促进骨折的愈合、软组织修复、溶栓作用、感染炎症的修复和促进药物的渗透等。近年来,随着对超声生物学效应研究的深入,LIPUS成为肿瘤治疗的一种新手段。研究[1]表明,正常细胞对LIPUS的作用具有抵抗力,而恶性肿瘤细胞对其很敏感。LIPUS能提高血脑屏障和血瘤屏障通透性,增加局部的药物浓度,提高化疗药物的疗效[2-3]。同时,在体内外环境下,LIPUS联合微泡剂能有效促进肿瘤细胞中靶基因导入和表达[4],增强基因治疗肿瘤的效果。LIPUS作为一种新型的治疗方法,对肿瘤细胞具有杀伤效应,并能协同其他治疗手段,有望用于肿瘤治疗,发挥抗癌效应[5]。
肝细胞癌(简称“肝癌”)是全球范围内多发恶性肿瘤之一,发病率在男性中占肿瘤的第5位、致死率居肿瘤第2位,在女性中占肿瘤的第7位、致死率居肿瘤第6位[6]。由于大量慢性乙型肝炎和黄曲霉毒素感染人群的存在,中国肝癌发病率居高不下。在不断完善优化现有治疗手段的基础上,进一步寻找新的治疗技术和方法迫在眉睫。国内Sun等[7]用低强度聚焦超声介导微泡破裂,用于治疗兔VX2原位肝肿瘤,结果证实LIPUS可抑制VX2肝癌细胞的生长。本研究将LIPUS作用于肝肿瘤细胞系SMMC-7721细胞,观察其对细胞增殖活性的影响,并筛选最优强度,现报告如下。
1 材料和方法
1.1 材料和设备 人肝癌细胞系SMMC-7721细胞由复旦大学附属中山医院肝癌研究所惠赠。DMEM 培养基、胎牛血清(fetal bovine serum,FBS)、双抗(青霉素和链霉素)、胰蛋白酶、碘化丙啶(PI)均购于美国Gibco公司,膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)试剂盒购于美国Invitrogen公司,MTT试剂购于上海碧云天生物公司。酶标仪由德国Eppendorf公司生产,FACSort流式细胞仪由美国BD Biosciences公司生产,实验用超声治疗仪由英国BTL公司生产。
1.2 SMMC-7721细胞培养及处理 将SMMC-7721细胞培养于含10%FBS、1%双抗(青霉素和链霉素)的DMEM培养基中,置于37 ℃、5% CO2恒温孵育箱中。将处于对数生长期的SMMC-7721细胞接种于6孔板内,接种密度为0.5×106/mL;待细胞处于对数生长期且细胞活力>95%,80%~90%满时,室温下进行LIPUS处理。
LIPUS处理肿瘤细胞的方法参照Feril等[8]的实验:将超声探头(有效面积5 cm2)垂直固定于6孔板底部(底面积9.5 cm2),其间用耦合剂填充以隔绝空气;频率为1 MHz,工作周期为25%、时间为1 min,处理强度根据前期实验[9]结果采用0.3、0.5、1.0、 1.3、 2.0 W/cm2。对照组超声治疗仪工作状态:强度为0 W/cm2,频率1 MHz,工作周期25%、时间为1 min,其他参数均与实验组相同。细胞经LIPUS处理,孵育6 h后,置于倒置显微镜下观察形态改变。每组设3个复孔。
1.3 MTT法测定细胞增殖抑制率 收集对数生长期的SMMC-7721细胞,按照5×103/孔细胞密度接种于96孔板中,每组设5个复孔,置于含10% FBS的DMEM培养基中培养(37 ℃,5% CO2恒温孵育箱中)。培养24 h后,LIPUS组用LIPUS处理细胞,对照组予超声探头假照1 min,操作后继续放入培养箱孵育。6 h后,每孔加入20 μL MTT溶液(5 mg/mL)继续培养4 h。吸掉上清后,每孔加入50 μL二甲基亚砜(DMSO),置摇床上低速震荡20 min,最后采用酶联免疫检测仪测量各孔吸光度(OD,490 nm)。上述步骤均重复3次。细胞存活率=(实验组OD值÷对照组OD)×100%。根据SMMC-7721细胞存活率,筛选出超声最佳作用强度。
1.4 流式细胞术检测细胞凋亡率 待细胞生长至对数生长期时,LIPUS组采用MTT法结果确定的最佳作用强度处理,对照组用超声探头假处理。处理后继续孵育6 h,收集细胞,PBS重悬计数;取5×105个细胞加入195 μL Annexin V-FITC结合液重悬,加入5 μL Annexin V-FITC和10 μL PI混匀,室温避光孵育15 min;采用流式细胞仪检测细胞凋亡率。Annexin V-FITC为绿色荧光,PI为红色荧光。
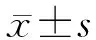
2 结 果
2.1 LIPUS对SMMC-7721细胞增殖活性的影响 以对照组细胞存活率为100%,结果(表1)表明:0.3 W/cm2组细胞存活率与对照组差异无统计学意义(P<0.05);0.5 W/cm2及以上强度组细胞存活率逐渐下降,呈强度依赖性,与对照组差异均有统计学意义(P<0.05)。0.5 W/cm2组细胞存活率与0.3 W/cm2组差异有统计学意义,与1.0 W/cm2组差异无统计学意义;1.3 W/cm2组细胞存活率与1.0 W/cm2组差异有统计学意义,与1.5 W/cm2组差异无统计学意义。最终确定0.5 W/cm2、1.3 W/cm2、2.0 W/cm2强度用于后续实验。

表1 超声处理1 min后SMMC-7721孵育6 h 存活率
注:细胞存活率以对照组为100%计算.*P<0.05,**P<0.01与对照组相比;n=5
2.2 LIPUS对SMMC-7721细胞凋亡率和坏死率的影响 流式细胞术检测(图1)显示:预处理1 min后孵育6 h,对照组仅有0.24% annexin V-FITC阳性细胞(凋亡细胞),0.5、1.3 、2.0 W/cm2组细胞凋亡率分别为4.66%、8.99%、32.41%,与对照组差异有统计学意义(P<0.01)。对照组未见PI阳性细胞(坏死细胞),0.5、1.3 、2.0 W/cm2组细胞坏死率分别为0.3%、0.8%、1.8% 。
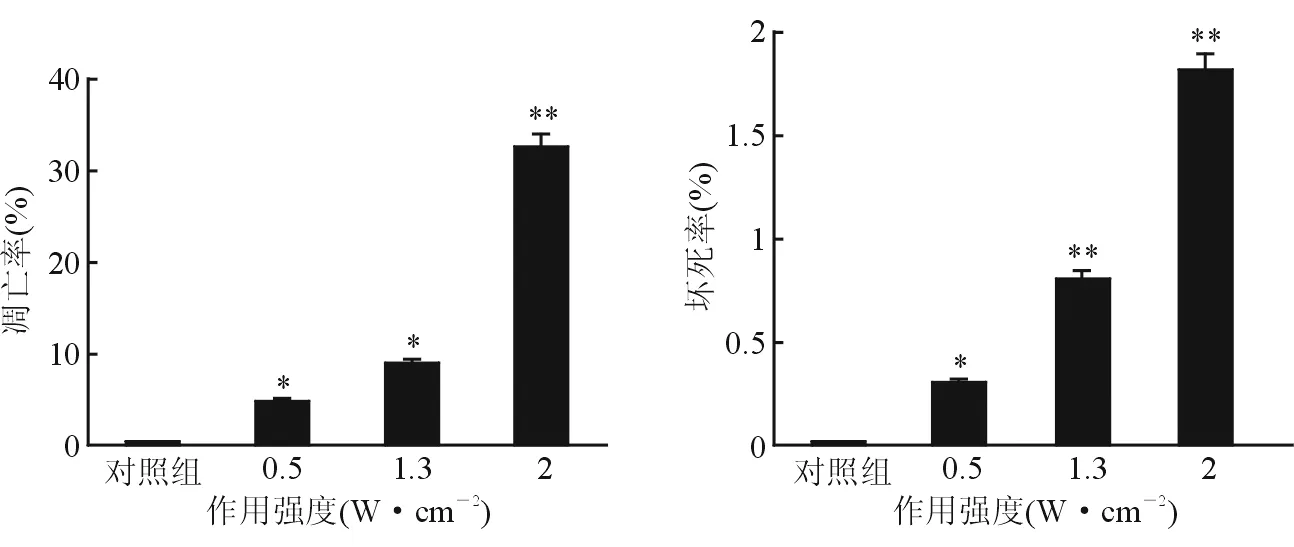
图1 流式细胞术检测超声处理1 min后孵育6 h细胞凋亡率和坏死率
3 讨 论
超声治疗作为康复医学的一个重要治疗手段,在骨关节疾病、疼痛的治疗方面发挥了巨大作用。近年来,国内外将LIPUS用于肿瘤细胞体外实验,取得可喜进展[8,10-11]。LIPUS具有多方面的生物学效应,包括空化效应、机械效应和热效应[12]。在超声作用下,介质中产生自由基及过氧化物质,同时超氧化物歧化酶(superoxide dismutase,SOD)的活力降低,从而诱导酶失活和脂质体解聚、氧自由基的清除减少,最终杀伤细胞[5,13]。此外,超声在传播过程中能使介质点进入振动状态,导致细胞膜透化、细胞间连接破坏,促进肿瘤细胞DNA损伤[14]、改变骨架基础蛋白[15],促进细胞凋亡。有学者认为,超声波在介质内传播的过程中,其能量不断被吸收而使介质温度升高,产生热效应,而当超声能量被组织吸收转为热量而温度升高时,正常组织可通过血流循环而散热,癌变组织则因血流少、散热差,温度易超出周围组织5~9 ℃[16]。基于以上理论,LIPUS被广泛用于肿瘤研究。LIPUS单独应用或联合应用微泡剂产生的空化泡载体,不仅能增加细胞膜的通透性,同时能增加化疗药物在局部的浓度并增加靶细胞的敏感性,促进基因导入和表达[17]。
本研究将不同强度的超声作用于SMMC-7721细胞,检测其对细胞的增殖活性。结果显示,经0.5 W/cm2及以上强度的LIPUS处理后,细胞的存活率明显下降,与对照组差异有统计学意义(P<0.05),说明LIPUS能够抑制SMM-7721细胞的增殖活性。而0.3 W/cm2组细胞存活率与对照组差异无统计学意义。Feril等[8]用LIPUS诱导U937(人组织细胞淋巴瘤细胞株)时发现,自由基(·OH)仅在0.3 W/cm2以上强度超声处理细胞时才可被检测到;氧化应激指示剂血红素加氧酶-1(heme oxygenase-1,HO-1)在0.3 W/cm2强度超声下也无明显变化,当处理强度达到0.4 W/cm2时,HO-1表达迅速上调至对照组的12倍,这与本研究结果相一致。本研究中MTT结果显示,LIPUS组随着超声作用强度增大,SMMC-7721细胞存活率逐渐下降,呈一定的强度依赖性。
目前国内外超声辐照肿瘤细胞的强度为0.05~5.12 W/cm2,对于LIPUS的界定并无明确的范围,国外一般以超声功率小于3或5 W/cm2作为低强度标准[18],国内目前一般要求不超过2 W/cm2[19]。本研究采用的BTL-5720型超声治疗仪治疗强度范围为0~3 W/cm2,而临床多采用在0.3~1.3 W/cm2。因此,本研究将0.5、1.3、2.0 W/cm2作为处理强度用于凋亡检测及后续研究。本研究显示,对照组细胞凋亡率为0.24%,LIPUS组随超声强度的增大,SMMC-7721的凋亡率逐渐升高。 LIPUS能诱导SMMC-7721细胞凋亡,同时致细胞坏死率较低。细胞凋亡在肿瘤形成的不同阶段均具有十分重要的作用,而坏死则可引起局部炎症反应,因此诱导肿瘤细胞凋亡并减少坏死是抗癌的重要思路。
综上所述,LIPUS能抑制肝肿瘤细胞系SMMC-7721细胞的增殖活性,诱导其凋亡,其效应呈强度依赖性。LIPUS有定位准确、组织穿透力强、简便易行的特点,易被患者接受,成为研究肿瘤治疗的一个新方向。目前研究主要针对LIPUS单独或联合其他治疗方法作用于肿瘤细胞的效应,而尚未揭示其抑制癌细胞活性、促进肿瘤细胞凋亡的分子生物学机制。若能从分子水平揭示LIPUS选择性的促进肿瘤细胞凋亡而不影响正常细胞的活性,以及同其他治疗方法协同作用的机制,则将为临床靶向治疗肿瘤提供更多的理论依据。
