颅内未破裂动脉瘤血管内治疗后患者颅内微出血(CMBs)的初步探讨
2020-05-23刘洪彬徐睿朱继张晓冬
刘洪彬,徐睿,朱继,张晓冬
(重庆医科大学附属第一医院神经外科,重庆)
0 引言
颅内未破裂动脉瘤常无症状,然而一旦破裂,致死、致残率高[1],对高破裂风险的颅内未破裂动脉瘤患者来说,血管内治疗已被证实是一项有效的治疗方式[2],然而血管内治疗术后脑出血及脑缺血两大并发症时有发生,其致残、致死率高。颅内微出血(CMBs) 近年来被提到对脑血管病的发生具有预测意义,磁化率加权成像(SWI)是一种高空间分辨率的三维梯度回波磁共振成像(3D)技术,是颅内微出血(CMBs)病变的有效监测检查[6-7]。本研究利用SWI 对重庆医科大学附属第一医院收治的111 例接受血管内治疗的未破裂动脉瘤患者术后颅内微出血这一现象进行监测、分析其危险因素,并对其存在的意义进行初步探讨。现报道如下。
1 材料与方法
1.1 研究方法
选用2018 年5 月至2019 年3 月重庆医科大学附属第一医院对111 例未破裂动脉瘤并接受血管内治疗的患者术后4-7 D 作SWI 检查、术后神经功能评估并收集患者临床资料,如一般情况:①年龄、性别、体脂;②既往史及个人史:如高血压、糖尿病、动脉粥样硬化病、吸烟史及饮酒史;③动脉瘤基本特征及手术信息:形态、大小、位置、栓塞方式( 支架辅助、单纯栓塞)、手术时间;④术后SWI 检查结果及神经功能、认知功能评估结果;⑤颅内微出血的临床特点(数目及发生部位)。
1.2 治疗过程
所有患者的手术均由神经外科主治及以上医师操作,并在全身麻醉下经股动脉入路完成,术前2 小时内均接受双联抗血小板药物治疗(300mg 阿司匹林;300mg 氯吡格雷术前顿服)。麻醉满意后,先行DSA 全脑血管造影,准确评估患者颅内动脉瘤数目、大小、形态及位置。术中给与全身肝素化( 普通肝素,50-70U/kg),以术中造影提示动脉瘤完全不显影为手术终点,(根据术中情况决定是否采用支架辅助栓塞)。
手术结束后,不逆转全身肝素化,待复查凝血功能正常后给予支架辅助栓塞术后患者低分子肝素0.5 或1 支(根据患者术前血栓弹力图及患者基本情况决定使用量)q12h 皮下注射预防支架置入术后脑血栓形成。支架置入术后的所有患者术后第3 天加用双联抗血小板药物治疗,单纯弹簧圈填塞术后患者无需接受抗凝及
典型病例图片展示:
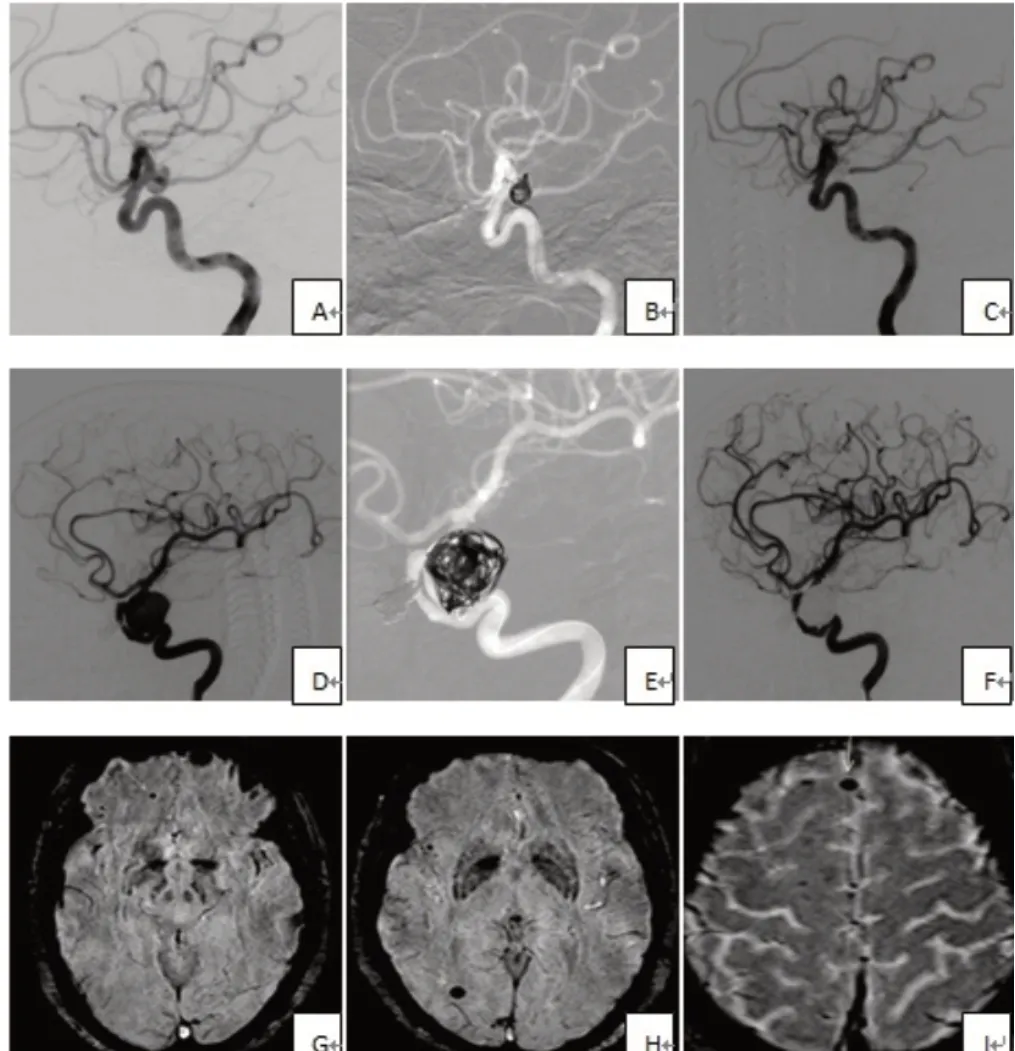
图1 颅内未破裂动脉瘤手术过程及术后SWI 阳性
抗血小板治疗。
1.3 颅内微出血(CMBs)监测方法
术后第4~7 天(根据患者病情恢复情况及医院MRI 设备条件)行SWI 检查,并记录颅内微出血(CMBs)位置和数目。
1.4 神经功能及认知功能评估评估
根据Rankin 量表(mRS)评分评估神经功能,采用中文版蒙特利尔认知评估(MoCA)量表评价认知功能。
1.5 统计学分析
采用SPSS 21.0 软件对所有数据进行统计学分析。术后SWI阳性率、患者一般情况及动脉瘤形态特征单因素分析用χ2检验,以n(%)表示;logistic 多因素回归法分析血管内治疗术后发生SWI阳性的独立危险因素。检验水准α=0.05,P<0.05 表示差异有统计学意义。
2 结果
2.1 患者特点
111 例 患 者 中 位 年 龄54 岁(29 岁~78 岁),其 中 女 性 占67.5%,反应了女性动脉瘤的优势。支架辅助介入栓塞术99例(89.1%),其中8 例因载瘤动脉与动脉瘤关系及颅内多发动脉瘤需要放置多个支架。
2.2 术中及术后并发症记录
术中及术后发生急性血栓形成事件2 例(1.8%),均未出现永久性神经功能障碍,其中1 例于术中造影提示同侧大脑中动脉M1段血流消失,立即行急诊支架取栓术,术后无症状;另一例发生在术后3 小时,患者出现神经功能障碍后急诊造影提示支架远端急性血栓形成,立即行急诊支架取栓术,术后恢复可。这两例患者术后SWI 均见微出血征象,但术后6 月随访结果显示,动脉瘤结果良好,且均未发生远期神经功能障碍及认知功能障碍。
2.3 SWI 阳性率
统计结果显示其中有47 例(42.3%) 出现颅内微出血(CMBs) 病变,病变大小介于1mm~10mm 之间。47 例SWI阳性患者中,均未出现神经功能障碍(mRS ≤1 分),均未出现认知功能障碍(MoCA ≥26)。微出血点的数目及分布情况如表2、表3 所示。

表1 微出血点数目对应患者数目

表2 微出血点位置对应患者数目
2.4 单因素和多因素分析结果
单因素分析结果显示,年龄大于65 岁、有饮酒史、高血压病史、糖尿病病史、动脉粥样硬化病病史、多发动脉瘤及手术平均时长对术后颅内微出血(CMBs)的发生有显著影响(P<0.05)。多因素logistic 回归分析显示,饮酒史,动脉粥样硬化病病史及多发动脉瘤为术后颅内微出血(CMBs)的独立危险因素(P<0.05)(表3、表4)。
3 讨论
3.1 颅内未破裂动脉瘤血管内治疗后患者颅内微出血(CMBs)的发生率
颅内微出血(cerebral microbleeds,CMBs) 在90 年代首次报道,颅内微出血是脑小血管病的重要影像学特征之[15],相关报道证实,普通人群中CMBs 具有一定的发生率,但根据不同的监测方法,结果差异较大,其中报道发生率最高的甚至高达23.5%~24.4%[16-17]。我们的研究发现颅内未破裂动脉瘤血管内治疗术后颅内微出血(CMBs) 的发生率(42.3%) 不低,比之在普通人群中的发生率(23.5%~24.4%) 明显升高。
3.2 颅内未破裂动脉瘤血管内治疗后患者颅内微出血(CMBs)的危险因素
我们本次的研究发现,颅内微出血的危险因素包括:年龄、高血压、糖尿病及动脉粥样硬化病病史、饮酒史阳性(P<0.05)。这与既往已初步证实的危险因素相仿[18],但我们的研究发现多发动脉瘤及手术时长也会对颅内微出血(CMBs) 产生影响(P<0.05),这是否可以说明我们的患者颅内微出血的发生率较普通人群高的原因之一。颅内多发动脉瘤及手术时间对颅内微出血的影响我们考虑可能是颅内多发动脉瘤较单纯动脉瘤手术时间较长,过程较之复杂,术中操作繁琐,导丝、导管对血管内皮的损伤几率更高的原因导致,Kakumoto 与Shi[26-27]等的相关研究发现血管内操作术后24~48 小时即可检出新发颅内微出血灶。
3.3 颅内未破裂动脉瘤血管内治疗后患者颅内微出血(CMBs)的临床意义
未破裂动脉瘤的处理是神经外科领域最具争议的话题之一,来自多国多项数据显示:直径>5mm 的未破裂动脉瘤破裂风险相对较高,应积极行手术干预;对于动脉瘤直径<5mm 应根据动脉瘤形态、位置、大小等多因素综合考虑治疗方案[21-25]。随着血管内介入治疗在未破裂动脉瘤领域得以广泛应用,越来越多的文献开始追踪报道未破裂动脉瘤介入术后的安全性及稳定性,我们发现血管内治疗术后脑出血及脑缺血成为两大主要并发症,其致残、致死率高。而颅内微出血(CMBs)近年来被提到对脑血管病的发生具有预测意义,因此我们试图通过对本次研究中发现的颅内微出血的临床特点的初步分析,寄希望此来减少我们术后脑出血及脑缺血并发症的发生。近年来,一些国外相关报道指出颅内微出血(CMBs)的数目及分布特点对脑血管疾病的发生有重要的预测价值[3、4、8-14];其中相关研究显示,脑微出血是所有类型脑卒中的危险因素[7];并且相关研究显示,当微出血灶≥6 个,或是≥2 个合并脑叶型微出血时发生脑血管相关疾病的风险更高[19-20]。我们的研究发现,颅内微出血数目大多集中于1~3 个,少数集中于4~5个,发生部位主要集中于各脑叶及基底节区,少部分发生在脑桥及小脑区。尽管我们的研究提示单纯≥6 个微出血灶的病人很少,但是≥2 个合并脑叶型微出血的病人却不在少数,这是术后发生脑血管并发症的危险因素之一。因此经过我们的初步探讨:术后做好颅内微出血的监测,以降低术后脑出血及脑缺血等并发症的发生率是有必要的。
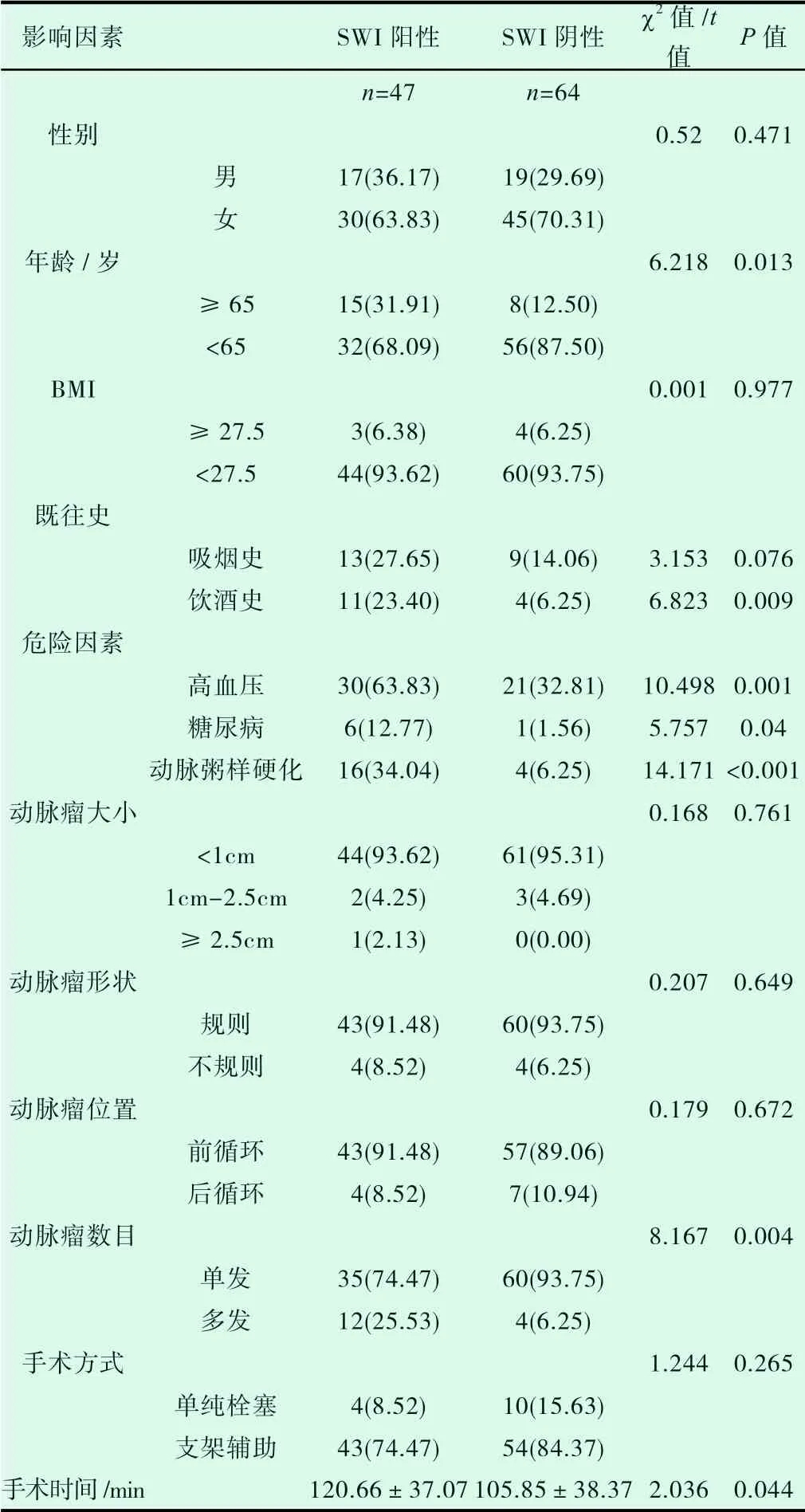
表3 SWI 阳性因素分析结果n(%)

表4 SWI 阳性多因素分析结果
4 总结
对于有相关危险因素及多发动脉瘤患者应给与特别重视,做好术前准备,术中操作应在保证安全的情况下达到简练、迅速,以减少手术时长,降低颅内微出血的发生,并在术后做好颅内微出血的监测,以降低术后脑出血及脑缺血等并发症的发生率。
这项研究的几个局限性值得注意,第一尽管有两位独立的神经外科医生回顾了术后SWI 影像学资料及得出结果,但一些SWI 异常信号很难描述,而且两位医生也不总是达成完美的共识;第二由于数据的回顾性,病史采集由不同医生记录,在收集某些临床变量,如糖尿病、高血压时会遇到一些困难,这些资料的有效性仅由病人的个人陈述和病史记录来证明,这可能导致数据偏差。第三,由于患者依从性不同,我们无法对病人远期的脑血管疾病的发生率及微出血的发生进行实时记录,因此对于颅内微出血(CMBs)的动态监测及是否对病人远期的脑血管疾病的发生有预测意义,还需进一步评估。
