徒手微创置钉内固定技术加微创减压治疗伴神经压迫的胸腰椎转移性肿瘤
2020-05-23顾宇彤张亮王毅超董健
顾宇彤 张亮 王毅超 董健
近年来,随着医疗技术的不断进步,恶性肿瘤患者生存率提高、生存时间延长,但转移性肿瘤的发生率也随之上升。骨骼是仅次于肺、肝之后第三大常发生转移性肿瘤的器官[1],约 30% 的恶性肿瘤会发生脊柱转移[2]。脊柱转移性肿瘤常引起疼痛、椎体病理性骨折甚至神经压迫导致瘫痪,所以对其治疗越来越受到重视[2-4]。非手术治疗包括镇痛、激素、放疗及化疗等[3],但这些方法只能缓解疼痛,不能提高生物力学稳定性。经皮椎体成形术 ( percutaneous vertebroplasty,PVP ) 是一种 C 型臂X 线机引导下将骨水泥注射入椎体的微创手术,可以缓解疼痛[4-5]并强化、稳定破坏的椎体,防止椎体进一步塌陷造成神经压迫[6]。
对于有神经压迫症状的胸腰椎转移性肿瘤,不减压只行 PVP 不能改善神经功能,不是一个最佳治疗方案[7],应该行前路、后路或前后路联合的神经减压、肿瘤切除加内固定术[8-9]。肿瘤切除的方式包括全椎体切除术 ( totle en bloc spondylectomy,TES )、矢状切除、后弓切除、碎瘤切除及蛋壳刮除术[8-9]。然而这些手术入路、可能的大出血、软组织过度剥离及患椎塌陷所致生物力学失稳都会导致严重的并发症[10-12]。回顾性分析 2014年 8月至 2015年 9月,我科采用徒手微创置钉内固定技术 ( Freehand MIPS,后外侧微小切口经椎旁肌间隙的 Wiltse 入路直视下植入椎弓根钉、皮下穿棒固定技术 )[13-19]、PVP 及正中小切口微创减压、肿瘤部分切除术[19-20]治疗的 43例伴神经压迫的胸腰椎转移性肿瘤患者,通过对临床疗效及手术节段 Cobb's 角、患椎高度压缩率的观察来评估这种微创手术方法的有效性和安全性。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1) 有下肢疼痛、麻木、行走不稳或瘫痪等神经症状;( 2) MRI 或 CT 显示胸腰椎单个椎体转移性肿瘤压迫神经,并与症状相符;( 3)查体发现患椎水平以下感觉、肌力减退等体征。
2. 排除标准:因无神经压迫的椎体恶性肿瘤、骨质疏松性骨折或椎体血管瘤而行 PVP 治疗的病例。
二、一般资料
本组共纳入 43例,其中男 24例,女 19例,平均年龄 ( 56.7±11.2) 岁;25例累及胸椎,18例累及腰椎。原发肿瘤来源于肝癌 5例,肺癌 8例,胃癌5例,肠癌 2例,膀胱癌 2例,乳腺癌 9例,前列腺 7癌例,甲状腺癌 5例。Tomita 评分系统[8]( 表 1)评分 7分 ( 6~7分 ),改良 Tokuhashi 评分系统[21]( 表 2) 评分 11分 ( 9~12分 )。根据 MRI 影像进行神经压迫 ( epidural spinal cord compression,ESCC )分级,2级 17例,3级 26例。脊柱肿瘤失稳评分( spinal instability neoplastic scoring,SINS ) 11分 ( 6~14分 )。本研究经医院医学伦理委员会审核批准,所有患者知情同意并签署知情同意书。
三、影像学检查
术前摄胸腰椎正侧位 X 线片、CT 及 MRI、PET。通过 MRI 或 CT 可以明确:( 1) 有无椎体皮质突破、椎旁破坏;( 2) 骨破坏类型 ( 破骨型、成骨型或混合型 );( 3) 椎体高度塌陷及神经压迫的程度。在 MRI T2加权相上使用 ESCC Bilsky 分级系统[23]对硬膜外神经压迫进行评估:0级 ( 只有脊柱骨破坏,无压迫 ),1级分为 1a ( 致压物碰及硬膜 )、1b ( 硬膜囊畸形 )、1c ( 致压物碰及脊髓或马尾 ),2级 ( 有脊髓或马尾压迫,脑脊液仍见 ),3级 ( 有脊髓或马尾压迫,脑脊液未见 )。术后复查 CT 以评估神经减压效果、椎弓根钉位置、有无骨水泥渗漏。
四、脊柱稳定性评估
SINS 脊柱肿瘤失稳评分系统 ( 表 3)[24]由脊柱肿瘤研究机构提出,用 5个放射影像学指标 ( 部位、骨病损、影像学脊柱序列、椎体高度丢失及脊柱后外侧附件累及 ) 和一个临床指标 ( 疼痛 ) 来评估脊柱稳定性,共 18分。根据评分将脊柱稳定性分为三类状况:稳定 ( 0~6分 ) ,潜在失稳 ( 7~12分 )及已失稳 ( 13~18分 )。
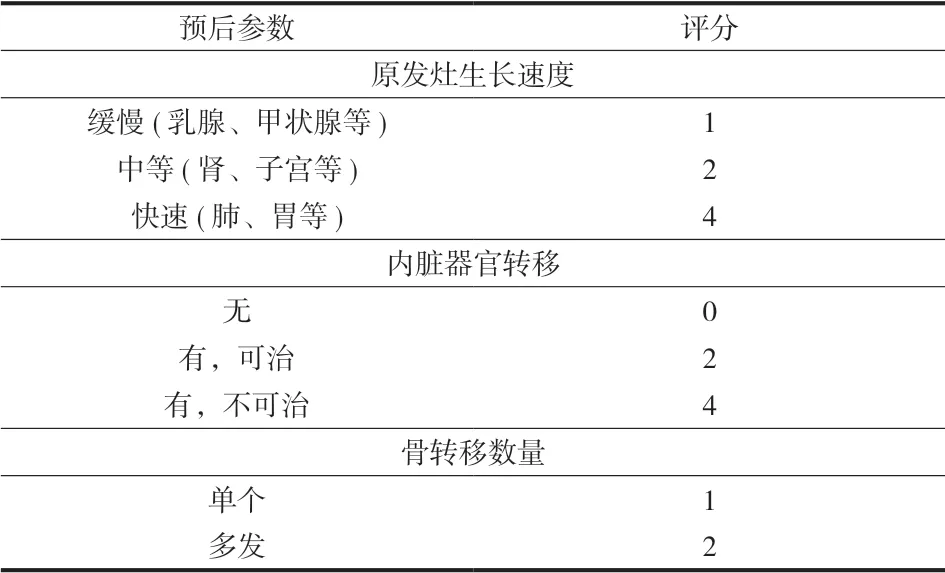
表1 Tomita 预后评分系统Tab.1Tomita scoring system
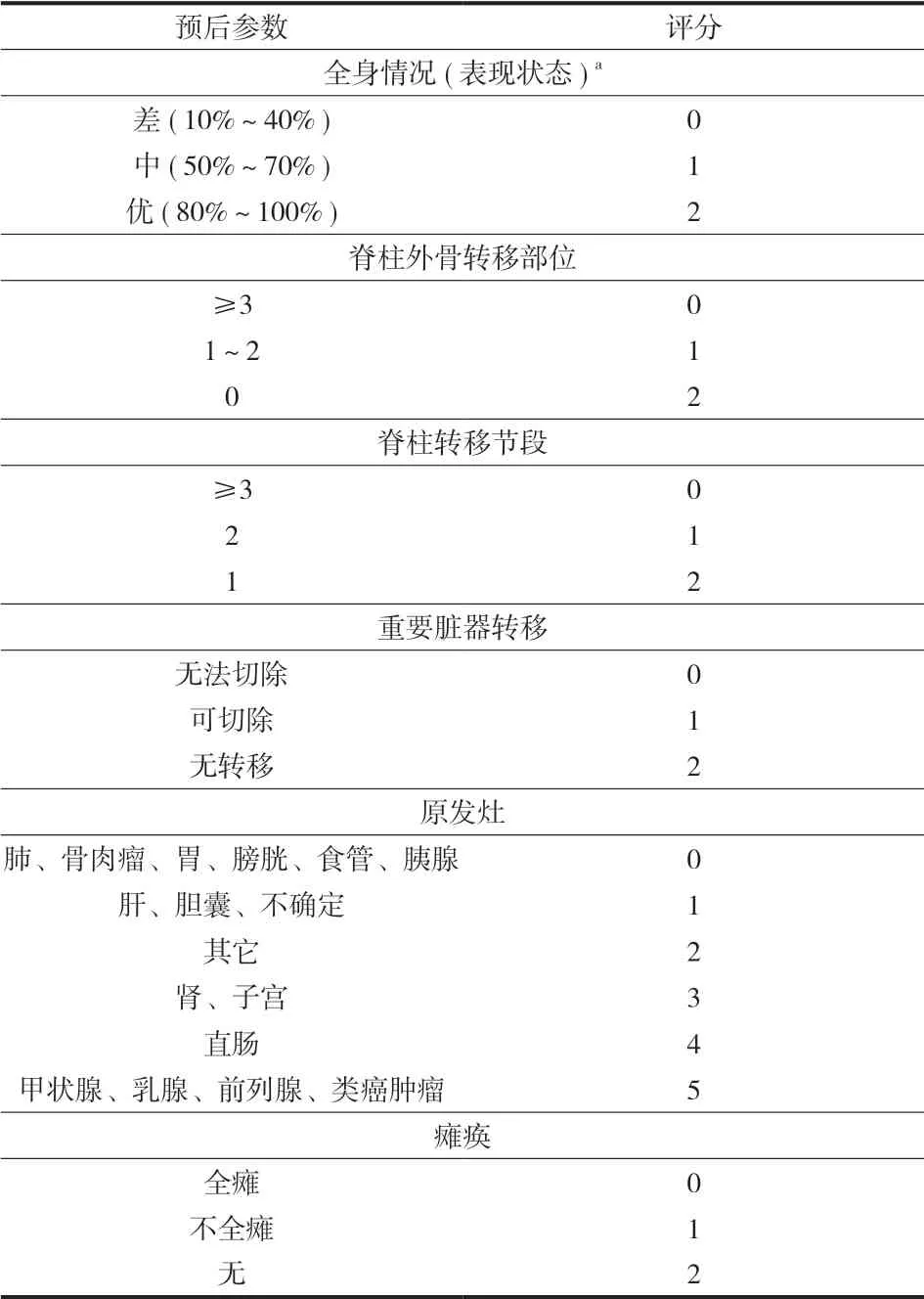
表2 改良 Tokuhashi 预后评分系统Tab.2Modified Tokuhashi scoring syste m
五、手术方法
全麻成功后患者俯卧于双横垫上使其处于适度过伸位。
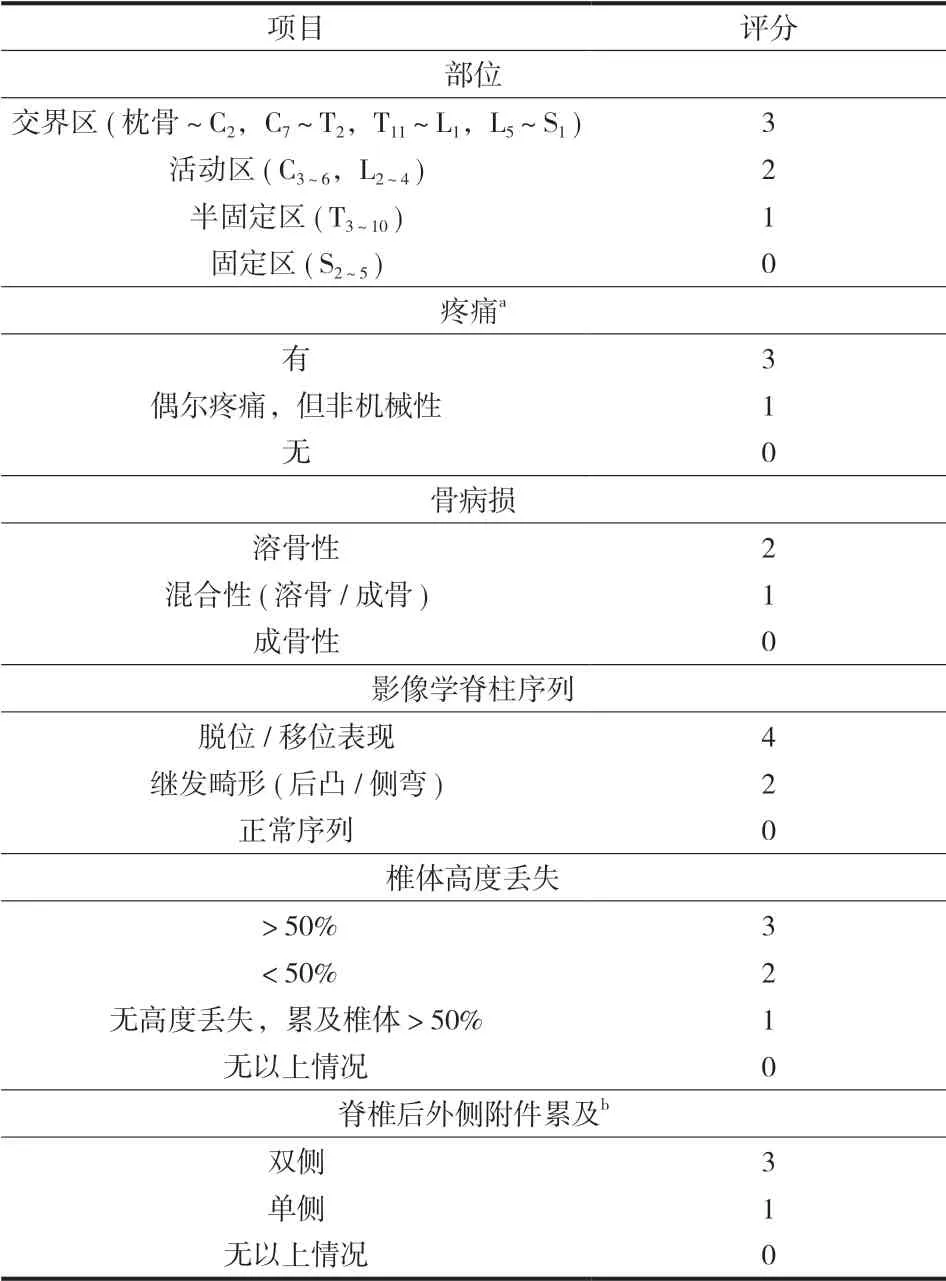
表3 脊柱肿瘤失稳评分系统 SΙNSTab.3Spinal instability neoplastic scoring system
1. 徒手微创置钉内固定+PVP:透视定位后胸腰背部正中旁开 3cm 处外侧 Wiltse 切口进入,各约1.0~1.5cm 长,通过多裂肌间隙显露患椎上下各2个椎体的上关节突及横突根部,T11、T12显露横突;直视下以上关节突外缘垂线与横突上中 1/ 3连线交点法定位胸椎椎弓根钉入点,以横突中点法定位 T11、T12椎弓根钉入点,以上关节突外缘垂线与横突中点连线交点法定位腰椎椎弓根钉入点,开口后用刮匙开路,球探触及钉道四周均为硬骨皮质后打入长度、直径合适的四对椎弓根钉 ( Viper,Depuy Spine,Raynham,Massachusetts,USA ) ( 图 1a )[13-19];C 型臂 X 线机透视引导下将穿刺针穿入患椎双侧椎弓根,直至椎体前中 1/ 3处,使用加压注射器 ( 上海瑞邦生物材料有限公司 ) 通过穿刺针将骨水泥注入椎体 ( 图 1b、c );连接棒预弯后皮下穿入与椎弓根钉固定 ( 图 1d )。
2. 正中小切口微创减压+肿瘤部分切除术:正对压迫神经的患椎水平取后正中小切口,长约3.5cm,切开皮肤、皮下及深筋膜,骨膜下剥离双侧椎旁肌,切除棘突、椎板后显露受压硬膜囊;进一步切除关节突及椎弓根到达椎体后缘,使用双极电凝、髓核钳、刮匙切除椎体后部肿瘤并制造一个空腔,将弧形神经剥离器插入硬膜囊与椎体后缘肿瘤之间并向前推挤肿瘤使其进入前方的空腔内,从而在硬膜囊与肿瘤间形成间隙完成减压,这个过程称为“肿瘤部分切除术”[19-20]( 图 2);若有出血,使用可吸收的止血纱布填入空腔压迫止血。术中注意保护脊髓、马尾或神经根以免损伤。

图1 a:徒手微创置钉;b:C 型臂 X 线机监视下行 PVP,将骨水泥注入病椎;c:PVP 的 C 型臂 X 线机透视图像;d:连接棒预弯后皮下穿入,然后旋入螺母锁定钉棒Fig.1a: Freehand minimally invasive pedicle screw fixation; b: Ιnjection of the cement into the target vertebral body under fluoroscopic guidance;c: Fluoroscopic image of PVP; d: Two contoured rods in appropriate size were placed to position pedicle screws
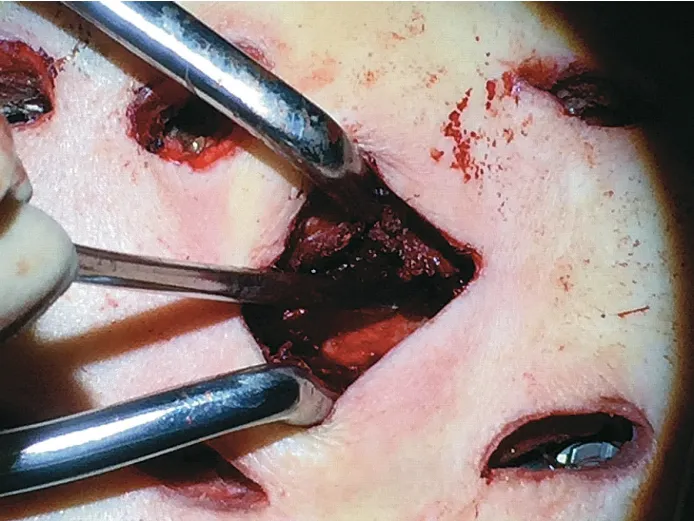
图2 正中小切口微创减压、肿瘤部分切除术Fig.2Minimally invasive neurologic decompression and partial tumor resection
六、术后处理
术后尽早下床功能锻炼,佩戴腰围 3~4周,适度进行腰背肌锻炼,术后 8周恢复日常活动和工作。
术后 2周切口愈合后行手术部位调强放疗以防止局部肿瘤复发。放疗总剂量通常为 4000cGy,在4周内分 20次完成,每周前 5天每天 1次,然后休息 2天,每次剂量 200cGy。身体状况好的患者行术后化疗。
七、观察指标
1. 临床疗效:术前、术后即刻、术后 1个月、2个月、3个月、半年、1年及末次随访时,使用疼痛视觉模拟评分 ( visual analogue scale,VAS ) 对腰背部疼痛进行临床评估同时对神经系统功能进行Frankel 分级,并评估行走能力和尿道括约肌功能。
2. 放射影像学评估:测量胸腰椎侧位 X 线片患椎前壁高度 H0,同时测量相应部位上位椎体前壁高度 H1和下位椎体前壁高度 H2。骨折椎体原始前壁高度 H=( H1+H2) / 2。椎体压缩率=( H-H0) / H。侧位 X 线片上患椎近端椎体下终板与患椎远端椎体上终板延长线的交角即为 Cobb's 角。分别测量并计算术前、术后即刻、术后 1个月、2个月、3个月、半年、1年及末次随访的椎体压缩率和 Cobb's 角。
八、统计学处理
采用 SPSS 11.5软件进行统计学分析。对手术前后各时点间的 VAS 评分、椎体压缩率和手术节段Cobb's 角进行线性混合效应模型 ( linear mixed effects model ) 分析,P<0.05为差异有统计学意义。
结 果
本组患者从发病至手术平均时间为 3.5( 1~7) 天,平均手术时间 ( 203.9±10.2) min,置钉平均透视次数 6( 5~11) 次,正中小切口平均长度( 3.2±0.4) cm,平均出血量 180( 60~800) ml,骨水泥平均注射量 ( 5.9±1.4) ml,住院平均 6( 4~7)天。无一例发生切口感染等并发症。所有患者中有40例得到平均 14.3个月 ( 12~18个月 ) 的随访,其余 3例术后存活半年以上,死于与手术并发症无关的病因。
一、临床疗效
胸腰背痛 VAS 评分由术前的 9分 ( 7~10分 ) 显著降至术后即刻的 3分 ( 2~4分 ) (P<0.001,F=1871.391),1年随访时 1分 ( 0~1分 ) (P<0.001,F=1871.391)。所有病例术后神经功能均得到改善,术后 3个月时 6例全瘫患者中有 2例由 Frankel B 级升至 D 级,37例不全瘫患者中有 31例由 C 或 D级升至 E 级,术后 1年时存活的 40例中有 33例达到 E 级。14例术前不能行走的患者中有 8例 ( 57% )术后重新获得行走功能,术前能行走的术后都仍然保持行走能力。16例术前尿道括约肌功能障碍的患者有 10例 ( 63% ) 恢复功能。
二、放射影像学评估
术后 X 线片及 CT 扫描显示所有患者椎弓根钉位置佳,椎管减压彻底,无骨水泥漏入椎管。术前患椎高度压缩率为 ( 34.6±8.6) %,术后即刻为( 33.9±8.5) %;术前 Cobb's 角为 ( 9.5±3.1) °,术后即刻为 ( 9.1±2.7) °。术后随访过程中 X 线片上患椎高度无明显丢失、Cobb's 角无明显改变,无一例出现内固定松动、脱落或断裂。典型病例见图 3。
讨 论
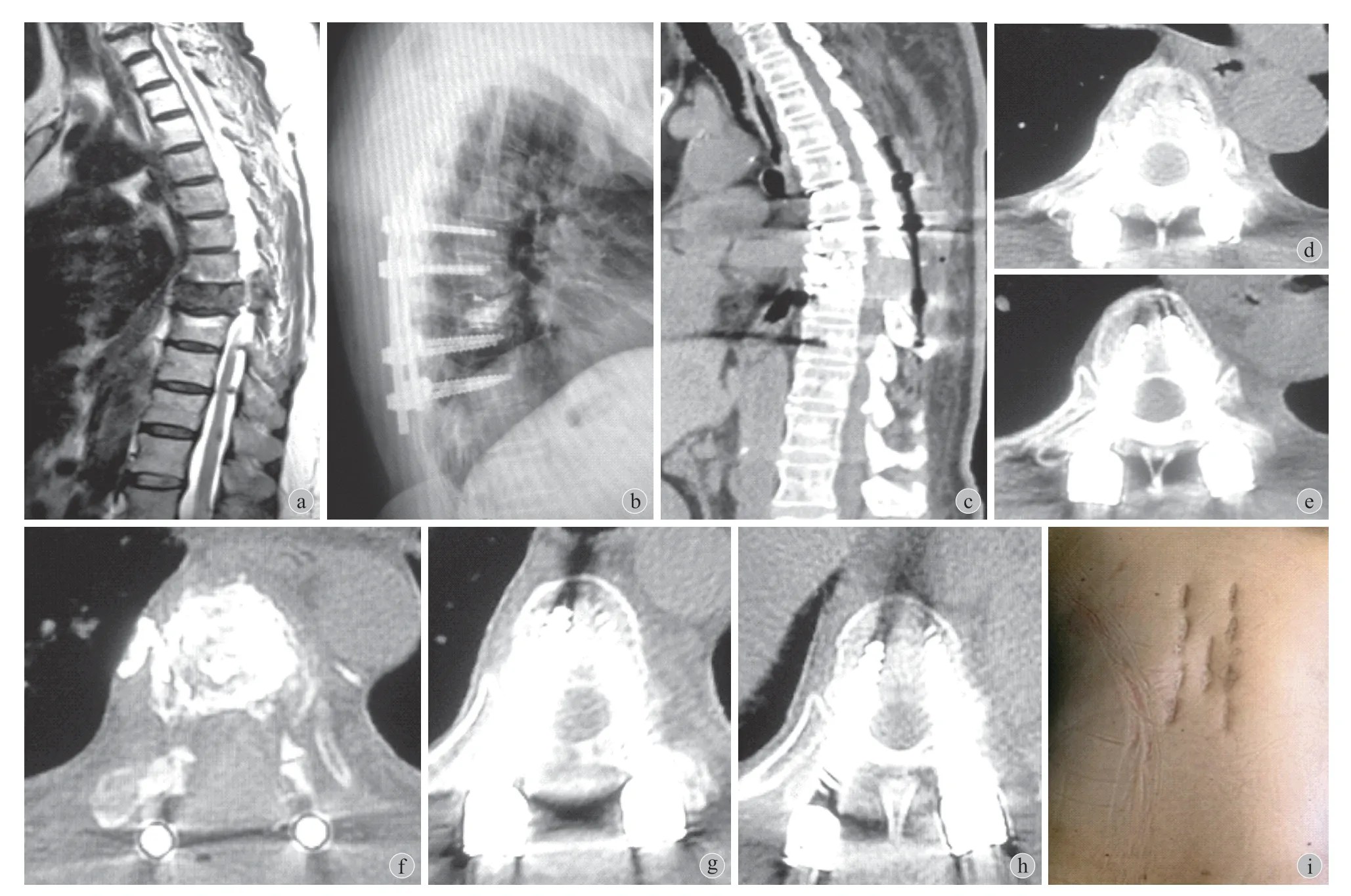
图3 患者,女,65岁,乳腺癌 T8 转移性肿瘤伴神经压迫,胸背痛 VAS 8分,神经功能 Frankel D 级,Tomita 6分,改良 Tokuhashi 12分,ESCC 3级,SΙNS 11分,行徒手微创置钉内固定 + PVP + 正中小切口微创减压、肿瘤部分切除术 a:术前 MRΙ 矢状位图像显示T8 转移性肿瘤,压迫脊髓;b:术后 X 线片示椎弓根钉位置佳、骨水泥未漏入椎管;c:术后 CT 矢状面重建显示神经减压彻底;d~h:术后 CT 横扫示 T6、T7、T9、T10 椎弓根钉位置佳,T8 节段神经减压彻底,骨水泥未漏入椎管;i:术后 18个月切口情况Fig.3Female, 65years old, T8 metastasis and neurologic compression from the breast cancer, VAS 8, Frankel D, Tomita 6, modified Tokuhashi 12, ESCC Grade 3, SΙNS 11. She underwent freehand MΙPS, PVP, minimally invasive decompression and partial tumor resection a: Preoperative sagittal MRΙ showed T8 metastasis with neurologic compression; b: Postoperative X-ray showed good pedicle screw position, no leakage of the cement into the spinal canal; c: Postoperative sagittal CT reconstruction showed complete decompression. d - h: Postoperative axial CT showed good position of pedicle screws at T6, T7, T9, T10, complete T8 decompression, no leakage of the cement into the spinal canal; i: Results 18months after surgery
脊柱转移性肿瘤的治疗策略可以根据 Tomita 预后评分相对应的治疗目标来制定,2~3分建议扩大或边缘切除,如脊椎全切、椎体全切、椎体矢状位切除或后弓切除,以达长期控制;4~5分建议边缘或囊内切除,如碎瘤切除、蛋壳刮除,以达中期控制;6~7分建议姑息性手术以达短期缓解;8~10分建议非手术治疗[8-9]。脊椎全切可完整切除脊柱肿瘤,可以治愈某些特定的肿瘤病例[25]。脊椎全切用来治疗脊柱原发性恶性肿瘤或侵袭性的良性肿瘤可以接受,但对于远离原发灶的脊柱转移性肿瘤存在争议[26],也没有数据表明脊椎全切术后患者生活质量及生存时间要优于其它创伤更小的手术方式。虽然技术大大提高,但脊椎全切、椎体全切及椎体矢状位切除仍是创伤较大的术式,手术切口大、出血多、剥离显露广泛、手术时间长,其相关的并发症及死亡的发生率较高[10-12]。另外碎瘤切除、蛋壳刮除及姑息性手术也有大出血的风险,有时尽管已用钉棒内固定,仍会发生肿瘤椎体塌陷,导致脊柱失稳。
经微小切口 Wiltse 入路的徒手微创置钉内固定技术及经皮穿刺椎体成形 PVP 技术可明显减小椎旁肌的医源性损伤[13-19]。与传统正中入路相比,椎旁肌间隙入路保护肌肉止点及棘上、棘间韧带,可直接到达横突根部、上关节突及椎弓根钉入点,减少出血、降低术后疼痛的风险[27]。与经皮椎弓根钉内固定技术相比,徒手微创置钉内固定技术的操作简便、术中透视少,而且所需切口的长度与前者相近。本研究采用徒手微创置钉内固定、PVP、正中小切口微创减压及肿瘤部分切除术治疗 43例伴神经压迫症状的胸腰椎转移性肿瘤,椎弓根钉植入及PVP 完成后连接棒经皮下穿棒安装于椎弓根钉上,然后再进行神经减压和肿瘤部分切除术,这样能减少术中出血。因为万一减压和切除肿瘤过程中出现大出血,可以在减压后尽快关闭切口结束手术。另外,采用正中微小切口进行微创减压和肿瘤切除能减少软组织创伤和术中失血。PVP 将骨水泥注射入肿瘤椎体可以栓塞丰富的肿瘤滋养血管,在切除压迫神经的椎体后缘肿瘤时出血可能减少。本研究虽然没有充分证据表明这样的微创手术可以延长患者生存时间,但手术并发症发生率和死亡率可以降至最低。
本研究中所有患者术前的胸腰背痛术后均得到缓解。术后 X 线片和 CT 显示正中微小切口微创减压同样彻底 ( 图 3)。虽然通过后路小切口不能将融合器或其它装置植入胸腰椎前柱,但可以进一步切除关节突及椎弓根以获得合适的内倾角到达椎体后缘并在椎体内制造一个空腔,推挤硬膜囊前方的椎体后缘肿瘤进入前方的空腔内,在硬膜囊与肿瘤间造成间隙完成椎管减压,即为“肿瘤部分切除术”[19-20]。与目前临床上常用的分离手术相比,正中小切口微创减压、肿瘤部分切除术可以获得与开放手术同样的效果,而且创伤小、出血少。所有患者术后神经功能均获得改善,术后 1年时存活的 40例患者中有 33例达到 E 级。神经功能恢复的预后与发病至手术的时间有关系,神经减压手术越早做,功能恢复越好,特别是运动功能完全瘫痪的A 级和 B 级患者,应尽量在发病后 48h 内完成手术。所有存活患者术后 1年随访时未发现脊柱失稳。Bilsky 等[28]在尸体生物力学研究中发现爆裂性骨折椎体内注射骨水泥可减小上下椎体椎弓根钉上的载荷,后路钉棒固定联合骨水泥椎体成形术可减少前柱塌陷发生率和内固定失败率。本研究也证明虽然未行融合术,Freehand MIPS 和 PVP 术后随访过程中并未发生内固定失败。
Hatrick 等[29]研究发现,脊柱转移性肿瘤伴神经压迫的病例行一期开放的后外侧经椎弓根入路360度神经减压植骨融合内固定术,平均出血量为1700( 200~4000) ml,术中平均输血量为 3.5个单位,平均手术时间 7h,平均住院天数为 11天,术后 30天内有 3例死亡,4% 的患者出现伤口裂开。与此相比,徒手微创置钉内固定加 PVP、正中小切口微创减压及肿瘤部分切除术在术中失血量、手术时间、住院天数及术后并发症上有一定的优势。另外,Hatrick 等[29]报告开放的 360° 减压融合术后 6例 D 级患者中有 5例神经功能恢复至基本正常( E 级 ),术前神经功能明显障碍的患者 ( C 级 ) 并没有恢复至正常,2例影像学上神经压迫比较严重的患者术后神经功能有减退,6例术前不能行走的患者中有 4例 ( 67% ) 术后恢复行走功能。Fourney等[30]、Sundaresan 等[31]、Patchell 等[32]发现脊柱转移性肿瘤至瘫痪无法行走的患者中分别有 57%、46%、94% 的病例在 360度神经减压术后重获行走能力。Jonsson 等[33]报告 16例无法行走的患者360度神经减压术后有 10例 ( 62% ) 恢复行走功能。Quan 等[34]研究发现 25例术前不能行走的脊柱转移性肿瘤患者在直接或间接神经减压、内固定术后有 19例 ( 76% ) 重获行走能力。Fisher 等[35]报告25例因椎体转移性肿瘤压迫神经而无法行走的患者术后有 17例 ( 68% ) 恢复行走功能,22例排尿困难患者术后有 13例 ( 59% ) 恢复尿道括约肌功能,但有 3例术前排尿正常的患者术后出现障碍。本研究显示,7例术前无法行走的患者微创手术后有 5例( 71% ) 重获行走功能,8例排尿障碍的患者术后有6例 ( 75% ) 恢复功能。在神经功能、行走能力、排尿功能的改善方面,微创手术的疗效并不次于已发表论文中的开放手术。
本研究中所有患者术后 X 线片和 CT 扫描显示椎弓根钉的位置均较理想,无一例骨水泥向后漏入椎管,无一例发生术后神经功能减退,证实徒手微创置钉内固定、PVP 技术的安全性和可行性。与所有外科手术一样,椎弓根钉内固定也有风险,有可能导致神经损伤,笔者的经验是微小切口直视下植入椎弓根钉前一定要仔细探测椎弓根骨道确保四壁均为硬性骨质,避免椎弓根破裂而螺钉侵入椎管或椎间孔。PVP 同样存在风险,有可能出现骨水泥渗漏入椎管,尤其在椎体后壁破裂时更容易出现,将骨水泥注入伤椎的操作过程必须在严密的 C 型臂X 线机监视下进行,少量多次推注,一旦骨水泥接近椎体后缘或漏入椎体周围间隙则立即停止注射。所有这些措施都是为了避免神经损伤,确保手术安全。虽然该微创术中需要 C 型臂 X 线机透视监控,但患者所受辐射量与单纯 PVP 一样有限,因为本研究中所使用的徒手微创置钉技术为直视下的操作,不依赖于透视定位。Saliou 等[5]研究表明椎体恶性肿瘤伴脊髓或马尾受压出现不可逆神经功能损害的患者只行 PVP 并未发现神经症状加重现象,也就是说对于伴有神经症状的脊柱转移性肿瘤患者来讲,神经减压前行 PVP 是安全可行的,并不会加重神经损害,本研究结果也证实这个观点。
本研究中微创手术的适应证是伴有神经压迫的单个胸椎或腰椎转移性肿瘤 ( ESCC 神经压迫分级2级或 3级 ),Tomita 评分 6~7分。一些学者提出的ESCC 神经压迫分级系统是一个可以指导治疗方案制订的工具[23]。没有生物力学失稳的情况下,ESCC 0、1a、1b、1c 级建议行放疗或 PVP 治疗,ESCC 2、3级表示神经压迫较严重,需要行神经减压术。SINS 脊柱肿瘤失稳评分系统也可用来指导手术方案的制订,0~6分表示脊柱稳定,7~18分代表目前脊柱可能失稳或已失稳。对于 SINS ≥ 7分的建议手术治疗,7~12分脊柱可能失稳的可行 PVP 或内固定术,13~18分脊柱已失稳的应该行内固定治疗。本研究中患者的 SINS 评分为 11( 6~14),虽然有些患者 SINS<7,但 ESCC 2或 3级需要椎管扩大、神经减压,所以需要内固定。
虽然 Tomita 预后评分 6~7分提示患者生存期为 6~12个月,但本研究中只有 3位患者死于 12个月以内。同时使用改良 Tokuhashi 预后评分系统[21]对患者状态进行评估 ( 表 3),其中包括 6项指标:全身状况、脊柱外骨转移数量、脊柱转移数量、重要脏器转移、原发灶及有无脊髓压迫所致瘫痪。根据总分可将患者预后分为 3种情况,≥ 12分预后较好,预计生存时间超过 12个月;9~11分预后中等,预计生存时间可过半年;≤ 8分预后较差,预计生存时间半年以内。本研究中患者改良 Tokuhashi评分 11( 9~12),预后中等偏优,在准确预估肿瘤患者生存时间上改良 Tokuhashi 要略优于 Tomita,虽然确定一个脊柱转移性肿瘤患者到底能活多久仍然是一个很大的挑战。
综上所述,徒手微创置钉内固定、PVP 加正中小切口微创减压及肿瘤部分切除术是治疗伴有神经压迫的胸腰椎转移性肿瘤的安全、有效而微创的方法。其手术适应证是 ESCC 神经压迫分级 2级或 3级的单个胸腰椎转移性肿瘤,Tomita 评分 6~7分。该研究也有一定的局限性,如没有设立开放手术对照组,以后笔者将进一步对胸腰椎转移性肿瘤的微创手术和开放手术进行对照研究。另外,该微创术式对于多发性胸腰椎转移性肿瘤是否适用?须进一步探讨。
