快速滤过型净化结合气相色谱-串联质谱法同时检测茶叶中10种拟除虫菊酯农药残留
2020-05-22黄云霞孟志娟赵丽敏孙文毅范素芳
黄云霞, 孟志娟, 赵丽敏, 孙文毅, 王 东, 范素芳, 李 强, 张 岩
(河北省食品检验研究院, 河北省食品安全重点实验室, 河北 石家庄 050000)
茶在中国有着源远流长的历史,茶中富含茶多酚、氨基酸、黄酮、茶多糖等营养物质,具有抗氧化、抗癌和抗炎的作用,并且有助于降低患高胆固醇和心血管疾病的风险,对人体健康有很大益处[1,2],因而是最受欢迎的饮品之一。许多亚洲国家,尤其是中国和日本以其闻名。然而近年来,随着各国在食品质量安全方面要求越来越高,以及日趋激烈的国际贸易竞争,在茶叶农药残留限量上,许多茶叶进口国家和地区(以日本和欧盟为代表)制定了更为严格的标准,因而茶叶中农药超标问题已成为中国茶叶出口最重要的技术贸易壁垒[3]。拟除虫菊酯类农药具有高效、低毒、低残留和对作物安全等特点,因而成为茶叶种植中被广泛使用的一类农药。我国在国家监督抽检中也把茶叶样品中的拟除虫菊酯农药列为检测项目。GB 2763-2019《食品中农药最大残留限量》对拟除虫菊酯类农药在茶叶中的最大残留限量(MRL)值做出了规定[4]。
茶叶中含有大量的茶多酚、嘌呤、生物碱和色素等物质[5],具有很强的基质效应(ME),而茶叶农药残留的含量往往很低,严重影响检测[6]。因此,对茶叶样品进行快速准确的分析,前处理过程中净化步骤是一个很重要的影响因素。此外,良好的净化前处理可以减少分析仪器受污染和损害,延长仪器寿命。目前,农药残留检测的样品前处理方法主要有固相萃取法[7-9]、分散固相萃取法[10,11]、加速溶剂萃取法[12,13]、液液萃取法[14,15]和QuEChERS法[16-18]等。但一些传统的样品制备方法存在一定缺陷,例如样品处理时间长,试剂消耗大,耗材用量多等,因而一种操作简便、样品处理成本低的茶叶农药残留测定的前处理方法成为研究人员的开发目标。QuEChERS法是由美国农业部Anastassiades教授于2003年开发的一种农产品检测的快速样品前处理技术[19]。该技术因其显著的样品前处理优点,在农药残留分析中快速应用起来,并得到不断改进。快速滤过型净化法(m-PFC)是一种基于QuEChERS法发展起来的用以去除基质样品中的共提取物的净化方法。该方法净化材料除含有常用的N-丙基乙二胺(PSA)和十八烷基硅烷键合硅胶(C18)外,还使用了多壁碳纳米管(MWCNTs)。该方法是将净化填料装于并固定在注射器中,通过吸取提取液再推送出去的方式,使提取液中的色素、有机酸、脂肪、糖类等杂质与填料层作用,但目标物不被吸附,从而实现净化。与传统QuEChERS方法相比,该方法无需称量吸附剂,提取液不需转移,萃取净化一步完成,大大缩短了净化时间,提高了前处理速率和效率[20]。目前该方法已成功应用于水果和蔬菜[21-23]等农药的多残留检测中,但尚未见用于茶叶中拟除虫菊酯类农药的多残留检测。本实验采取m-PFC净化柱进行前处理,选取在茶叶中常用的拟除虫菊酯类农药为研究对象,结合气相色谱-串联质谱检测技术,建立了茶叶中联苯菊酯(bifenthrin)、甲氰菊酯(fenpropathrin)、氯氟氰菊酯(cyhalothrin)、氯菊酯(permethrin)、氟氯氰菊酯(cyfluthrin)、氯氰菊酯(cypermethrin)、氟氰戊菊酯(flucythrinate)、氰戊菊酯(fenvalerate)、氟胺氰菊酯(fluvalinate)、溴氰菊酯(deltamethrin)10种拟除虫菊酯农药残留同时检测的方法,旨在为快速、准确检测茶叶中的农药多残留提供参考。
1 实验部分
1.1 仪器、试剂与材料
GC-MS-TQ 8050气相色谱-三重四极杆质谱联用仪、SH-Rxi-5Sil MS石英毛细管柱(30 m×0.25 mm×0.25 μm)(日本岛津公司);高速万能粉碎机(天津市泰斯特仪器有限公司); VM200旋涡振荡仪(托摩根生物科技有限公司); 3K15型高速冷冻离心机(德国Sigma公司)。
10种拟除虫菊酯农药标准品(100 mg/L)购自农业部环境保护科研监测所,于4 ℃冰箱保存。乙腈、丙酮和乙酸乙酯(色谱纯,德国Merck公司); QuEChERS净化管(简单基质)(含有150 mg MgSO4和50 mg PSA)、QuEChERS净化管(复杂基质)(含有150 mg MgSO4、50 mg PSA、50 mg C18和50 mg石墨化炭黑(GCB))(美国Thermo公司); m-PFC柱,含有120 mg MgSO4、45 mg PSA和45 mg MWCNTs(北京绿绵科技有限公司); Cleanert TPT固相萃取柱(2 000 mg/12 mL)、0.22 μm微孔滤膜(天津艾杰尔公司)。本实验用50例茶叶样品均购于当地超市。

表 1 10种拟除虫菊酯农药的CAS号、保留时间及质谱参数Table 1 CAS numbers., retention times (tR) and MS parameters of the 10 pyrethroid pesticides
CE: collision energy.
1.2 样品前处理
1.2.1 提取
称取已粉碎好的茶叶样品2 g(精确至0.001 g),置于50 mL离心管中,用移液管准确加入10 mL乙腈,拧紧瓶盖旋涡混匀2 min,以 9 500 r/min 离心3 min。
1.2.2 净化
(1)QuEChERS:用移液管准确移取上述提取液2 mL于QuEChERS净化管中,旋涡振荡2 min,以 9 500 r/min 离心3 min,上清液过0.22 μm有机滤膜,进GC-MS/MS分析。
(2)m-PFC:用移液管准确移取上述提取液2 mL,置于5 mL离心管中,向上缓慢抽动m-PFC柱(注射器型)的注射杆,使2 mL提取液全部经过填料层,m-PFC柱注射器端连接0.22 μm有机滤膜,置于进样小瓶上方,然后缓慢推动注射杆,即得待测液,待GC-MS/MS分析。
1.3 标准溶液的配制
空白基质溶液:称取2 g(精确至0.001 g)空白茶叶样品,按照1.2.1节描述进行提取,然后将提取液按照1.2.2节描述进行快速滤过型净化,得相应的空白基质溶液,将该溶液置于4 ℃冰箱中保存,备用。
混合标准储备液:取10种拟除虫菊酯标准品溶液各1.0 mL,配制成10 mg/L 的混合标准储备液,于4 ℃冰箱保存。
基质混合标准工作液:用空白基质溶液将混合标准储备液稀释,配制质量浓度分别为1.0 mg/L 和0.01 mg/L 的空白基质标准溶液;用空白基质标准溶液配制质量浓度分别为 0.000 6、0.002、0.003、0.004、0.01、0.05、0.2、0.4和0.8 mg/L 的系列基质混合标准工作液,现配现用。
1.4 分析条件
1.4.1 色谱条件
色谱柱:SH-Rxi-5Sil MS(30 m×0.25 mm×0.25 μm);进样口温度:250 ℃;升温程序:初始温度50 ℃,保持1 min,以25 ℃/min 升温至125 ℃,再以10 ℃/min 升温至300 ℃,保持15 min;载气:氦气(纯度≥99.999% ),流速:1.69 mL/min;进样方式:不分流进样,进样体积:1 μL。
1.4.2 质谱条件
离子源:EI源;离子源温度:200 ℃;传输线温度:250 ℃;电子能量:70 eV;采用Smart MRM软件建立10种拟除虫菊酯农药的三重四极杆质谱方法,质谱参数见表1。
2 结果与讨论
2.1 提取溶剂的选择
在农药残留测定过程中,可以用于前处理提取的溶剂有很多,考虑待测农药的极性和溶解程度,本实验选取乙腈、乙酸乙酯和丙酮作为提取溶剂,选取空白红茶样品,按照1.2.1节步骤提取,采用QuEChERS净化管(简单基质)净化。以10种拟除虫菊酯添加量分别为0.5 mg/kg 时的回收率和提取液颜色为指标,综合考察3种溶剂的提取效果。结果显示,乙腈作为提取溶剂时,10种拟除虫菊酯的回收率均在85%以上,优于乙酸乙酯和丙酮。同时,用丙酮提取时,提取液颜色最深,乙腈和乙酸乙酯相对较浅。综合考虑,后续实验选择乙腈作为提取溶剂。
2.2 提取方式的选择
QuEChERS法最初用于含水量大于75%的蔬菜和水果中多组分农药残留的净化。当样品中含水量少于25%时,需在处理过程中加入水来增加细胞的通透性,从而提高提取过程中农药残留的析出。本文考察了空白红茶样品中10种拟除虫菊酯添加水平为0.5 mg/kg 时,茶叶样品前处理过程中加水和不加水的提取效果。不加水提取过程,按照1.2.1节进行;加水提取,在2 g样品中先加入10 ml水,浸泡10 min,再加入10 mL乙腈,旋涡振荡2 min,然后加入氯化钠6 g,剧烈振荡1 min,以 9 500 r/min 离心3 min。提取液均按照1.2.2节采用QuEChERS净化管(简单基质)净化。对两种提取方式的回收率进行对比,结果表明,10种拟除虫菊酯的回收率分别为88.6% ~115.6%和87.1% ~113.9% ,无显著性差异。但茶叶样品加水后,部分水溶性杂质溶解出来,造成提取液颜色加深,不利于后续净化。因此,综合考虑回收率和后续净化问题,本研究选用不加水浸泡、乙腈直接提取的方法。
2.3 净化方式的选择
茶叶中富含茶多酚、脂肪酸、咖啡因和色素等物质,可以和待测目标物共提取,不仅干扰目标物的分离和测定,而且污染仪器,因而简便有效的净化方式至关重要。本研究考察了在空白红茶样品中添加1.0 mg/kg 目标化合物,采用QuEChERS净化离心管(简单基质)、QuEChERS净化离心管(复杂基质)和m-PFC柱时茶叶提取液的净化效果(见图1)和回收率。采用QuEChERS净化离心管(简单基质)净化后茶叶提取液颜色仍然较深,色谱图中杂峰较多,目标化合物回收率为89.2% ~105.5% ;采用QuEChERS净化离心管(复杂基质)净化后,提取液颜色几乎无色,色谱图中杂峰明显变少,回收率为51.4% ~76.2% ;采用m-PFC柱净化后,提取液颜色较浅,色谱图中杂峰相对较少,回收率为88.0% ~106.2% 。
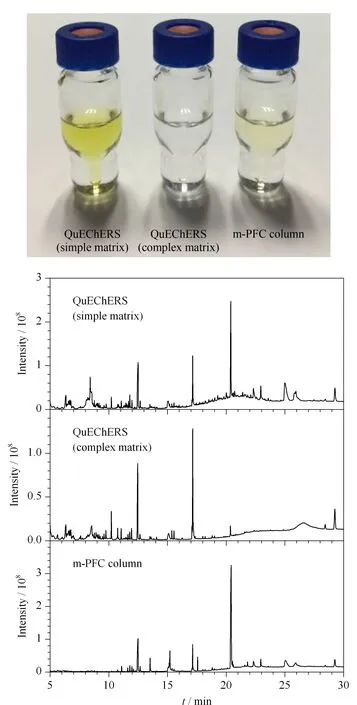
图 1 经不同净化方式处理后茶叶(1.0 mg/kg)提取液的照片和总离子流色谱图Fig. 1 Graph and total ion current chromatograms of the tea extracts (1.0 mg/kg) cleaned up by different purification methods
PSA是一种弱阴离子交换填料,可通过氢键萃取极性化合物,从而去除色素、有机酸、糖类等极性物质,但吸附能力有限,对于色素含量高的茶叶样品,净化效果并不理想。GCB虽然对于高色素含量的样品有强大的净化能力,但对具有平面结构的菊酯类农药有很大的吸附问题,易导致回收率较低。而m-PFC净化柱中的填料层不仅含有PSA,还有多壁碳纳米管净化填料。多壁碳纳米管材料是一种纳米级中空材料,具有高比表面积、优异的耐酸碱能力和耐热能力的特性。与PSA相比,多壁碳纳米管对茶叶中杂质如色素、有机酸等吸附容量更大,吸附能力更强,而且还能减少对具有苯并杂环类结构的菊酯类农药的吸附问题。综合考虑,后续实验选取m-PFC净化柱净化,不仅能对提取液起到良好的净化效果,而且能保证较高的回收率。

表 2 10种拟除虫菊酯农药的线性范围、线性方程、相关系数、检出限、定量限和最大残留限量Table 2 Linear ranges, linear equations, correlation coefficients (R2), LODs, LOQs and the maximum residue limits (MRL) of the 10 pyrethroid pesticides
y: peak area;x: mass concentration, mg/L; * GB 2763-2019; /: not given.
2.4 基质效应
农药残留测定中,普遍存在基质效应。茶叶中富含茶多酚,有机酸和色素等物质,可以和待测目标物共提取,这些物质进入色谱柱,在与目标物共洗脱时,会影响目标物的离子化效应[24],从而影响检测的准确性和重复性。ME=(基质标准溶液中目标化合物的峰面积/溶剂标准溶液的峰面积)×100%[25]。
本实验配制0.05 mg/L 基质标准溶液和同等浓度的乙腈标准溶液,重复测定3次,考察10种拟除虫菊酯农药在绿茶、乌龙茶、红茶和普洱茶4种不同类型茶叶中的基质效应。结果显示,10种拟除虫菊酯农药在4种茶叶样品中均呈现不同程度的基质增强效应,ME在107% ~162%之间。通过对比发现,10种拟除虫菊酯农药在同一种茶叶中基质增强效应存在差异。例如,在普洱茶中,10种拟除虫菊酯农药的基质效应在116% ~162%之间,其中联苯菊酯基质效应最强。此外,10种拟除虫菊酯农药在不同类型的茶叶中基质效应也有一定的差异性。例如,氯菊酯在绿茶、乌龙茶、红茶和普洱茶中基质效应分别为123% 、129% 、137%和146% ;溴氰菊酯和氰戊菊酯在红茶和普洱茶中的基质效应均大于140% ,而在绿茶和乌龙茶中的基质效应均小于132% 。这可能是由于不同类型的茶叶在茶多酚、色素、生物碱等含量上的差异造成的。基于不同类型茶叶之间基质效应的差异,实验中应配制同类型的茶叶基质混合标准工作液进行定量分析,以此保证定量结果的准确性。
2.5 线性范围、检出限和定量限
按照1.3节描述配制质量浓度为 0.000 6~0.8 mg/L 的系列基质混合标准工作液,以各个农药的峰面积为纵坐标,相应的质量浓度为横坐标,考察10种拟除虫菊酯农药的线性关系。结果显示,10种农药在相应的线性范围内线性关系良好,相关系数(R2)均>0.998 0;以信噪比(S/N)约为3和10时的空白样品添加浓度计算方法的检出限(LOD)和定量限(LOQ),分别为0.001~0.015 mg/kg 和0.003~0.050 mg/kg(见表2)。由表2可知,GB 2763-2019对氟胺氰菊酯在茶叶中的最大残留量未做规定,其余9种拟除虫菊酯农药的检出限和定量限远低于国标中规定的最大残留量。因此该实验方法不仅满足使用要求,也可为今后国家标准制定氟胺氰菊酯在茶叶中的限量提供依据。
2.6 回收率与精密度
选取空白红茶和绿茶样品进行添加回收试验,考察定量限、0.05、0.2和2 mg/kg 添加水平下,10种拟除虫菊酯的回收率和精密度,每个水平平行测定6次,结果见表3。结果表明,在不同的添加水平下,方法的平均回收率在87.5% ~111.3%之间,相对标准偏差(RSD)为2.1% ~8.9% ,表明该方法准确度较高,精密度良好,能够满足检测要求。
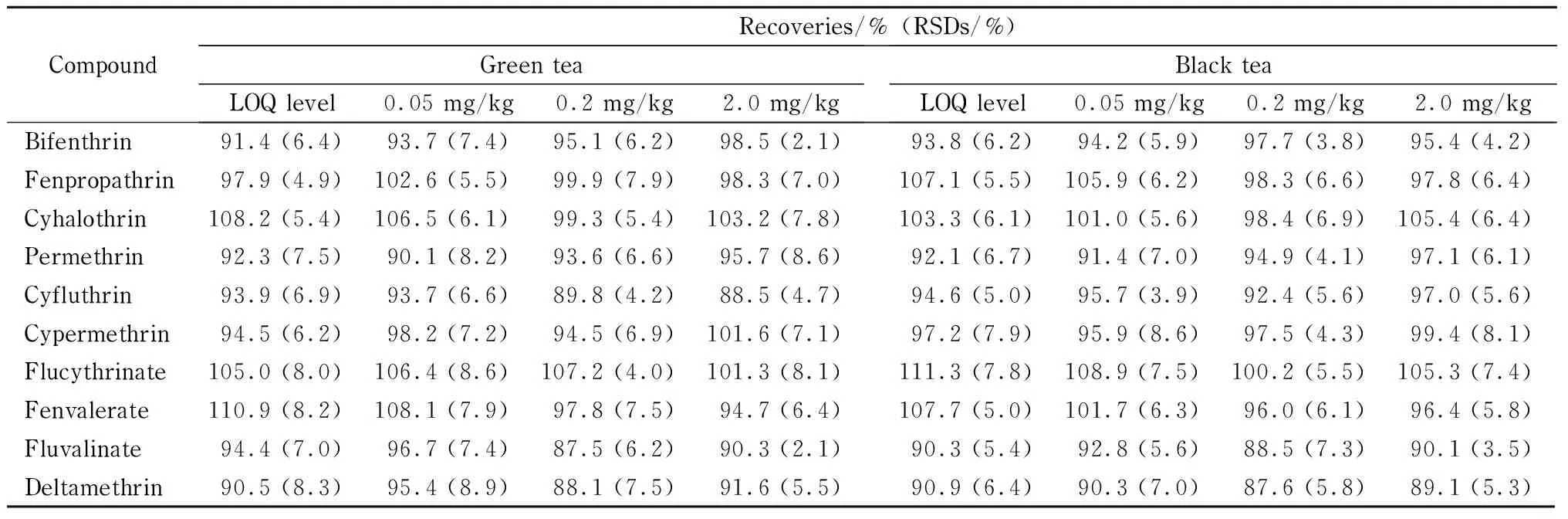
表 3 10种拟除虫菊酯农药在绿茶和红茶中的加标回收率和相对标准偏差(n=6)Table 3 Recoveries and RSDs of the 10 pyrethroid pesticides spiked in the green tea and black tea (n=6)
2.7 与国家标准方法比较
选取空白红茶样品,考察农药添加水平1.0 mg/kg ,采用本实验方法和GB/T 23204-2008方法前处理时10种拟除虫菊酯类农药的回收率。采用本方法净化后,方法的回收率为88.6% ~106.1%,采用国标方法中茶叶专用固相萃取柱Cleanert TPT净化后的回收率为89.5% ~108.7%,两者回收率无显著差异。但标准方法净化步骤过于繁琐,且洗脱液中含有甲苯,毒性较大。而本实验采用m-PFC柱,萃取净化一步完成,试剂用量少,提取液无需浓缩,净化过程直接吸附杂质,无需洗脱,单个样品前处理时间小于15 min,该方法在保证实验结果准确度和精密度的前提下大大提升了检测效率。
2.8 实际样品的测定
采用优化后的方法对市售的10种茶叶(龙井茶、碧螺春、铁观音、大红袍、白毫银针、白牡丹茶、祁门红茶、正山小种、普洱茶、安化黑茶)共50例样品进行测定,其中24个茶叶样品检出拟除虫菊酯农药残留,检出率为48% 。检出农药种类和频次为联苯菊酯20频次、氰戊菊酯14频次、氯氰菊酯6频次、溴氰菊酯5频次和氯氟氰菊酯3频次,其余农药未检出;同时检出农药的残留量均未超过国家标准规定的最大残留限量值。
3 结论
本文针对茶叶样品基质复杂的特点,采用乙腈直接提取,经m-PFC柱净化,结合GC-MS/MS,建立了茶叶中10种拟除虫菊酯农药的快速定性定量分析的方法,并运用所建方法检测50例茶叶样品。与传统样品预处理方法相比,该法具有操作简单、快速高效、准确可靠等优点,为日常大量茶叶样品中多种拟除虫菊酯农药残留进行快速筛查检测提供了一条新途径。
