慢性乙型病毒性肝炎合并非酒精性脂肪性肝病患者发生严重纤维化的危险因素分析
2020-05-22许维国王春艳天津市滨海新区塘沽传染病医院肝内科天津300454天津市西青医院消化内科天津300300
许维国,王春艳,李 海 (.天津市滨海新区塘沽传染病医院肝内科,天津 300454;.天津市西青医院消化内科,天津 300300)
非酒精性脂肪性肝病(Non-alcoholic Fatty Liver Disease,NAFLD)和慢性乙型病毒性肝炎(Chronic Hepatitis B,CHB)是目前我国重要的两大肝病负担[1-2]。NAFLD的疾病谱范围从单纯脂肪变性到脂肪性炎性反应,肝硬化甚至肝癌[3]。根据文献报道,25%~30%的CHB患者合并NAFLD发生,但目前为止慢性乙型肝炎病毒(HBV)感染与脂肪肝之间的联系仍未完全明确[4]。研究表明,肝脏脂肪变性(如NAFLD或者酒精性脂肪变)合并慢性病毒性肝炎(包括CHB等)可协同造成肝细胞氧化损伤加重肝损伤,因此基于此CHB合并NAFLD更易发生肝纤维化和肝细胞癌[5]。然而,CHB合并NAFLD患者发生肝纤维化的危险因素仍未完全明确,基于此笔者回顾了CHB合并NAFLD患者资料并分析其中严重肝纤维化患者的危险因素,以期为今后CHB合并NAFLD患者肝纤维化的筛查和早期诊断提供科学依据。
1 资料与方法
1.1一般资料:回顾性收集2015年11月~2019年8月于我院诊断为CHB合并NAFLD的患者临床资料。纳入标准:①符合我国非酒精性脂肪肝指南(2018版)诊断标准;②符合我国乙肝防治指南(2015版)CHB诊断标准(HBsAg阳性>6个月,HBV DNA>103 IU/ml);③经过肝穿标本证实诊断。排除标准:①丙型肝炎病毒或其他慢性肝病(包括酒精性肝病、自身免疫性肝病、遗传代谢性肝病等);②其他严重的肝外疾病,如慢性心力衰竭和慢性阻塞性肺疾病。
1.2研究方法
1.2.1患者资料收集: 收集患者的人口学信息包括年龄、性别,2型糖尿病(T2DM),吸烟史;体格检查,包括身高、体重、腰围,血压。实验室检查:包括血小板(PLT)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)等、肝硬度FibroScan检测LSM等;病理诊断情况。
1.2.2分组方法: 所有纳入患者根据METAVIR病理纤维化评分标准,将≥ F2定义为严重纤维化组,F0-F1为无/轻度纤维化组。比较两组患者临床资料差异,并探讨导致严重纤维化危险因素。

2 结果
2.1患者临床资料:根据纳入排除标准,共纳入研究者287例,其中无/轻度纤维化组175例,严重纤维化组112例。严重纤维化组较轻度纤维组具有更高的年龄、AST、TBIL、LSM水平,更低的PLT,更高的吸烟史、糖尿病史,详见表1。
表1 CHB合并NAFLD患者发生严重纤维化患者与无/轻度纤维化患者资料比较
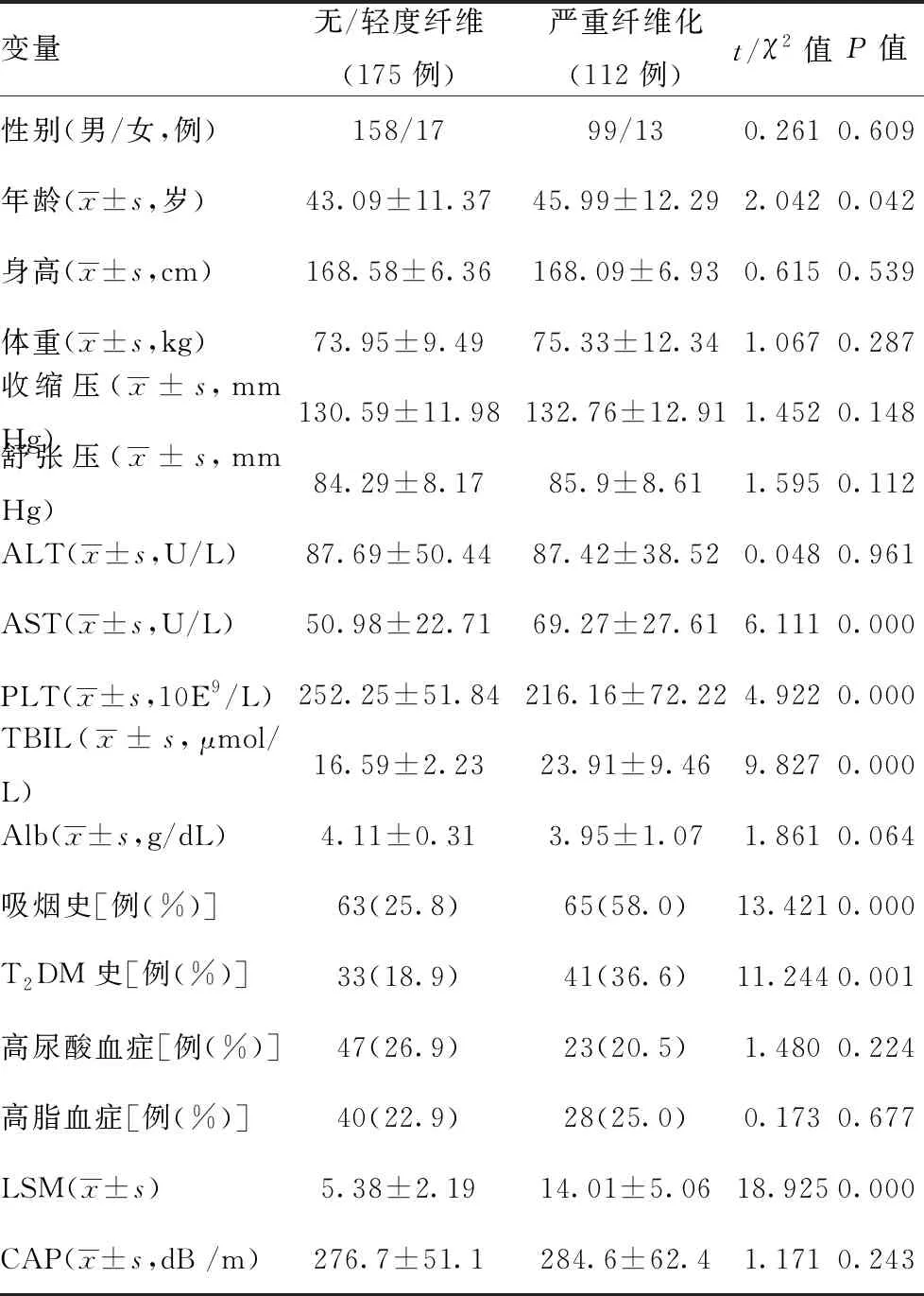
变量无/轻度纤维(175例)严重纤维化(112例)t/χ2值P值性别(男/女,例)158/1799/130.2610.609年龄(x±s,岁)43.09±11.3745.99±12.292.0420.042身高(x±s,cm)168.58±6.36168.09±6.930.6150.539体重(x±s,kg)73.95±9.4975.33±12.341.0670.287收缩压(x±s,mm Hg)130.59±11.98132.76±12.911.4520.148舒张压(x±s,mm Hg)84.29±8.1785.9±8.611.5950.112ALT(x±s,U/L)87.69±50.4487.42±38.520.0480.961AST(x±s,U/L)50.98±22.7169.27±27.616.1110.000PLT(x±s,10E9/L)252.25±51.84216.16±72.224.9220.000TBIL(x±s,μmol/L)16.59±2.2323.91±9.469.8270.000Alb(x±s,g/dL)4.11±0.313.95±1.071.8610.064吸烟史[例(%)]63(25.8)65(58.0)13.4210.000T2DM史[例(%)]33(18.9)41(36.6)11.2440.001高尿酸血症[例(%)]47(26.9)23(20.5)1.4800.224高脂血症[例(%)]40(22.9)28(25.0)0.1730.677LSM(x±s)5.38±2.1914.01±5.0618.9250.000CAP(x±s,dB /m)276.7±51.1284.6±62.41.1710.243
注:1 mm Hg=0.133 3 kPa
2.2患者发生严重纤维化的多因素Logistic回归分析:以严重纤维化为因变量,将表1中有统计学差异的因素纳入多因素Logistic回归分析分析,结果显示高LSM、高AST、低PLT、T2DM病史是CHB合并NAFLD患者发生严重纤维化的独立危险因素,其中LSM的OR值最大为2.256,见表2。
表2 CHB合并NAFLD患者发生严重纤维化的多因素logistic回归

危险因素B值SEWald值OR95%CIP值PLT-0.0090.0036.4270.9910.985~0.9970.011AST0.0240.0047.8911.0241.016~1.0320.004LSM0.8140.0194.9282.2562.174~2.3420.031T2DM0.6820.0134.3891.9771.860~2.1010.045
2.3诊断CHB合并NAFLD患者严重纤维化的ROC曲线分析:使用Logistic回归得出的危险因素LSM、AST、PLT构建预测CHB合并NAFLD患者严重纤维化的ROC曲线,结果显示LSM的AUC=0.894,其敏感度特异度为94.6%和91.3%,AST的AUC=0.703,其敏感度特异度为75.2%和78.5%,PLT的AUC=0.671,其敏感度特异度为72.6%和75.8%,详见图1。
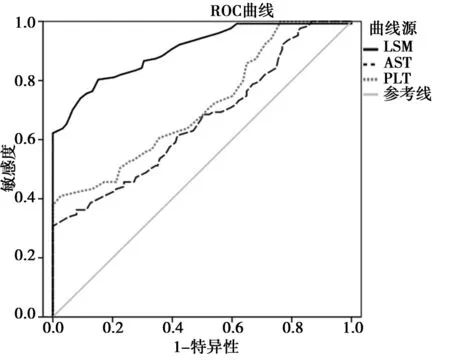
图1 不同因素预测CHB合并NAFLD患者发生严重纤维化的ROC曲线
3 讨论
目前CHB感染仍然是我国肝纤维化最主要原因,但近年来NAFLD的患病率不断增加,在未来也将逐渐成为肝纤维化的重要原因。在不干预治疗的情况下,弥漫性肝纤维化最终进展为肝硬化、假小叶形成,更为重要的是肝纤维化进展会增加HCC发生风险。大量研究证实了,肝纤维化与肝病患者预后密切相关[6],因此肝纤维化的早期诊断对于CHB合并NAFLD患者的管理至关重要。因此,笔者回顾了CHB合并NAFLD患者的资料并分析他们发生纤维化的原因,为今后早期防治提供参考。
笔者收集了具有肝穿标本的患者资料,根据纤维化严重程度不同探索了与纤维化相关的危险因素。本研究证实,高LSM、高AST、低PLT水平、T2DM史是CHB合并NAFLD患者肝纤维化的独立预测指标。既往研究已经证明了糖尿病是导致肝纤维化的重要原因,尤其对于NAFLD患者,糖尿病可增加患者的胰岛素抵抗水平使肝脏组织学进展明显[7]。也有研究证明,合并糖尿病可能会增加HBV患者HCC的发生风险[8]。因此,对于CHB合并NAFLD患者应对合并糖尿病的患者尤为重视。
CHB合并NAFLD患者的纤维化进展可能相对缓慢。一项韩国队列研究表明,HBsAg阳性可能与非酒精性脂肪肝发生的风险降低有关[9]。尽管HBV感染影响肝脏脂肪变性的机制尚不清楚,在另外一项大型病例对照研究中也发现了HBV感染与NAFLD的发生风险较低显著相关,即使在对可能的混杂因素进行调整之后,这种效应仍然存在[10]。更为重要的是Chan等表明在CHB合并肝脏脂肪变的患者中,肝癌的风险增加了7.3倍[11]。因此,早期发现并干预CHB合并NAFLD患者的纤维化可能对患者预后带来一定帮助。
笔者利用CHB合并NAFLD患者严重纤维化的危险因素构建预测诊断的ROC曲线可见LSM的AUC=0.894面积最大,可见肝脏硬度是判断纤维化的最佳指标,但LSM的测量需要借助Fibroscan或Fibrotuch机器的测量[12],对于缺少上述设备的基层医院AST、PLT可能具有一定帮助。由于只需要进行血常规、肝功能检测,AST、PLT检测具有更好的可及性和经济性,因此,他们在预测CHB合并NAFLD患者的纤维化方面也具有一定优势。
当然本研究存在一定的不足,由于纳入患者均为经过肝穿证实的患者,因此纳入患者病例数相对不足,更多的轻症患者和健康人群由于没有肝穿资料而未纳入进本研究,这可能导致其他潜在因素未被发现,同时研究所得出的肝纤维化危险因素OR值可能因此存在一定偏倚,但这些不足并不影响我们得出结果的趋势。CHB合并NAFLD一直是临床中感兴趣的话题,也值得今后更多的前瞻性研究进一步分析其纤维化因素,并开展对危险因素的干预研究。
综上所述,笔者研究发现高LSM、高AST、低PLT水平、T2DM史是CHB合并NAFLD患者发生严重肝纤维化的危险因素,并对严重肝纤维化发生预测具有一定价值。其中LSM具有最佳的预测价值,但需要借助肝硬度检测设备,对于基层医院AST、PLT也是预测CHB合并NAFLD严重纤维化的重要选择。
