敲除核因子E2相关因子对肾肌成纤维细胞活化与纤维化的影响
2020-05-22程水兵郭洋洋朱恒悦肖言一郑士樟戚如意周俊雷杨梅白永恒
程水兵,郭洋洋,朱恒悦,肖言一,郑士樟,戚如意,周俊雷,杨梅,白永恒
(温州医科大学附属第一医院,浙江温州325015,1.创伤外科;2.浙江省胰腺肝脏危重性疾病诊治新技术研究重点实验室;3.重症医学科)
肾间质纤维化是肾脏损伤逐步进展的结果,同时也是造成肾脏功能减退不可逆的原因之一。典型的肾纤维化发生机制为各种原因(缺血缺氧、氧化应激等)引起转化生长因子-β(transforminggrowthfactor-β,TGF-β)等促纤维化因子的过度产生和释放,诱导α-平滑肌肌动蛋白(α-smoothmuscleactin,α-SMA)阳性的肌成纤维细胞活化和积聚,最终导致大量的细胞外基质(如I型和III型胶原)成分在肾间质沉积所致[1]。然而,目前尚不十分清楚肾损伤过程中促纤维化因子如何被诱导产生,进而活化肌成纤维细胞。前期研究显示,氧化应激重要的调节分子—核因子E2 相关因子(nuclearfactorerythroid-2relatedfactor2,Nrf2)可能参与肾纤维化进程[2-3]。Nrf2 可以通过抗氧化和抑制炎症反应,从而实现减轻肾损伤,保护肾小管间质纤维化作用[4]。本研究通过体内应用Nrf2 基因敲除小鼠构建单侧输尿管梗阻(unilateralureteralobstruction,UUO)动物模型,观察敲除Nrf2对肾肌成纤维细胞产生和间质纤维化的作用,及敲除Nrf2对TGF-β1分泌水平的影响。
1 材料和方法
1.1 材料 Nrf2(又称Nfe212)基因敲除小鼠(B6.129X1-Nfe212tm1ywk/J)购自南京大学南京生物医药研究院,动物许可证号:SCXK(苏)2015-0001。野生型B6小鼠(C57BL/6)购自温州医科大学实验动物中心,动物许可证号:SYXK(浙)2019-0009。PAS染色试剂盒购自上海太阳生物技术公司;Masson试剂盒购自北京Solarbio公司;免疫组织化学试剂盒购自北京中杉金桥公司;兔抗α-SMA抗体(美国CST公司);兔抗TGF-β1 和III型胶原抗体(美国Bioworld公司);TRIzol试剂,购自美国Invitrogen公司;RNA反转录试剂盒,购自日本Toyobo公司;AU5800全自动生化分析仪(美国贝克曼库尔特公司);MyCycler梯度PCR仪(美国Bio-Rod公司);7500Fast定量PCR仪(美国AppliedBiosystens公司);VarioskanFlash全波长多功能扫描仪(美国ThermoScientific公司);DM4000BLED荧光正置显微镜(德国Leica公司)。
1.2 方法
1.2.1 动物分组和模型制备:将实验小鼠分成Nrf2野生型假手术组、Nrf2野生型UUO组、Nrf2敲除型假手术组、Nrf2敲除型UUO组4个小组,每组6只。UUO模型组进行左侧输尿管结扎,假手术组开腹后游离左侧输尿管不予结扎,于术后第7天取梗阻侧肾组织用于指标检测。UUO模型标准化关键在于无菌操作和结扎于输尿管上1/3处。
1.2.2 生化分析仪检测血肌酐和尿素氮水平:取每只小鼠的外周血,1500r/min离心10min分离出血清,全自动生化分析仪检测血肌酐和尿素氮水平。
1.2.3 PAS染色观察肾组织病理变化:梗阻侧肾取出后,进行纵轴和横轴测量。横截面切割切开后加入4%多聚甲醛固定,按常规方法进行组织脱水、透明、浸蜡和包埋。切成约4μm厚的切片,经脱蜡、梯度乙醇脱水,根据试剂盒说明书进行PAS染色,中性树胶封片。通过显微镜观察肾组织切片,对肾小管间质损伤程度进行评分,评分标准参照文献[5]。
1.2.4 Masson染色观察肾组织纤维化:石蜡切片脱蜡后,按试剂盒说明书操作。苏木素-三氯化铁染核10min;盐酸乙醇分化、水洗;氨水反蓝,水洗;丽春红酸性染液染色10min,醋酸洗1min;1%磷钼酸作用2min,直接用苯胺蓝染色2min;直接95%乙醇分化30s;脱水、透明、封片、镜检。Masson染色后肌纤维为红色,胶原纤维呈蓝色。评分标准参照文献[5]。
1.2.5 免疫组织化学染色检测TGF-β1、α-SMA和III型胶原的表达:用免疫组织化学链霉菌抗生物素蛋白连接的过氧化酶法。标本用4%多聚甲醛溶液固定,石蜡包埋后连续切片,厚4μm。枸橼酸盐微波辐射进行抗原修复,二氨基联苯胺显色后经苏木精复染。以一抗稀释液代替一抗作为阴性对照,细胞浆或胞膜出现棕黄色颗粒为阳性表达。光镜下每张切片随机选取10个高倍视野(×200),应用Image-ProPlus6.0软件,计算每个视野下阳性表达区域的平均光密度值(累积光密度/分析面积)。
1.2.6 RT-qPCR检测TGF-β1mRNA的表达:采用TRIzol试剂提取小鼠肾组织中的RNA,于260/280nm测定吸光度值以确定样本纯度和浓度。根据试剂说明书将RNA反转录成cDNA。应用Primer5.0软件设计小鼠TGF-β1mRNA的特异性引物,以β-actin作为内参,引物由上海生工公司合成,见表1。PCR扩增体系:5μL2×SYBRGreen荧光定量试剂、2μL引物(上、下游各1μL,终浓度200nmol/L)、2μL反应缓冲液、1μLcDNA。PCR程序为:95℃3min预变性,1 个循环;95℃5s,60℃35s,40 个循环。采用相对定量法计算获得结果,溶解曲线分析结果的可靠性。相对表达量=2-ΔΔCt,ΔΔCt=
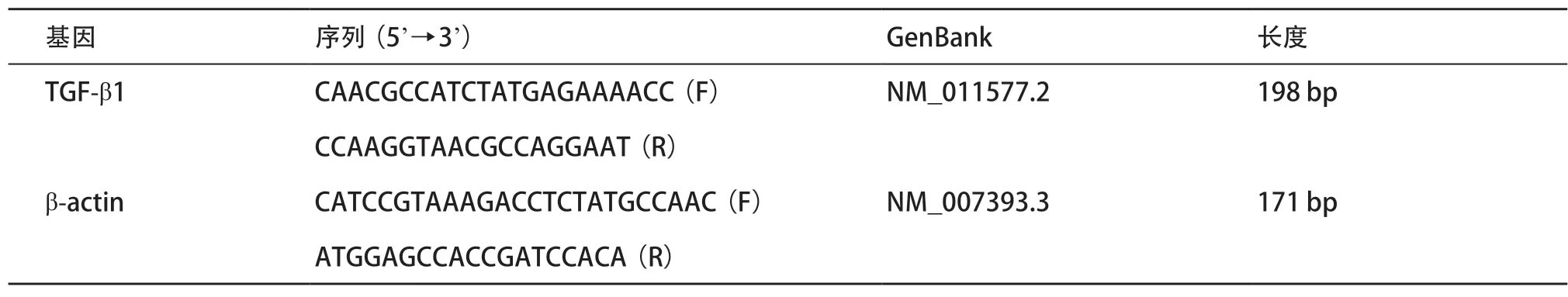
表1 TGF-β1和内参β-actin的mRNA引物序列
1.3 统计学处理方法 采用GraphPadPrism7.0软件对数据进行统计学分析,计量资料用表示,多组间的比较用单因素方差分析,组间两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 4组小鼠肾功能比较 与Nrf2 野生型假手术组比,Nrf2野生型UUO组外周血清中血肌酐和尿素氮水平明显升高,差异有统计学意义(P <0.05)。Nrf2敲除型UUO组血肌酐和尿素氮水平与Nrf2野生型UUO组比,差异无统计学意义(P>0.05)。见图1。
2.2 4组小鼠肾组织损伤程度比较 与Nrf2野生型假手术组比,Nrf2野生型UUO组肾小管扩张和间质面积扩大,差异有统计学意义(P<0.01)。与Nrf2敲除型假手术组比,Nrf2敲除型UUO组肾小管扩张和间质面积扩大,差异有统计学意义(P<0.01)。与Nrf2野生型UUO组比,Nrf2敲除型UUO组肾小管扩张和间质面积扩大,差异有统计学意义(P<0.01),见图2。
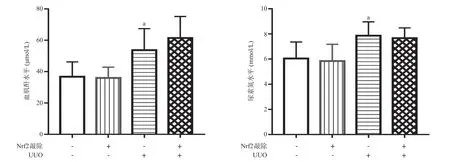
图1 4组小鼠肾功能比较
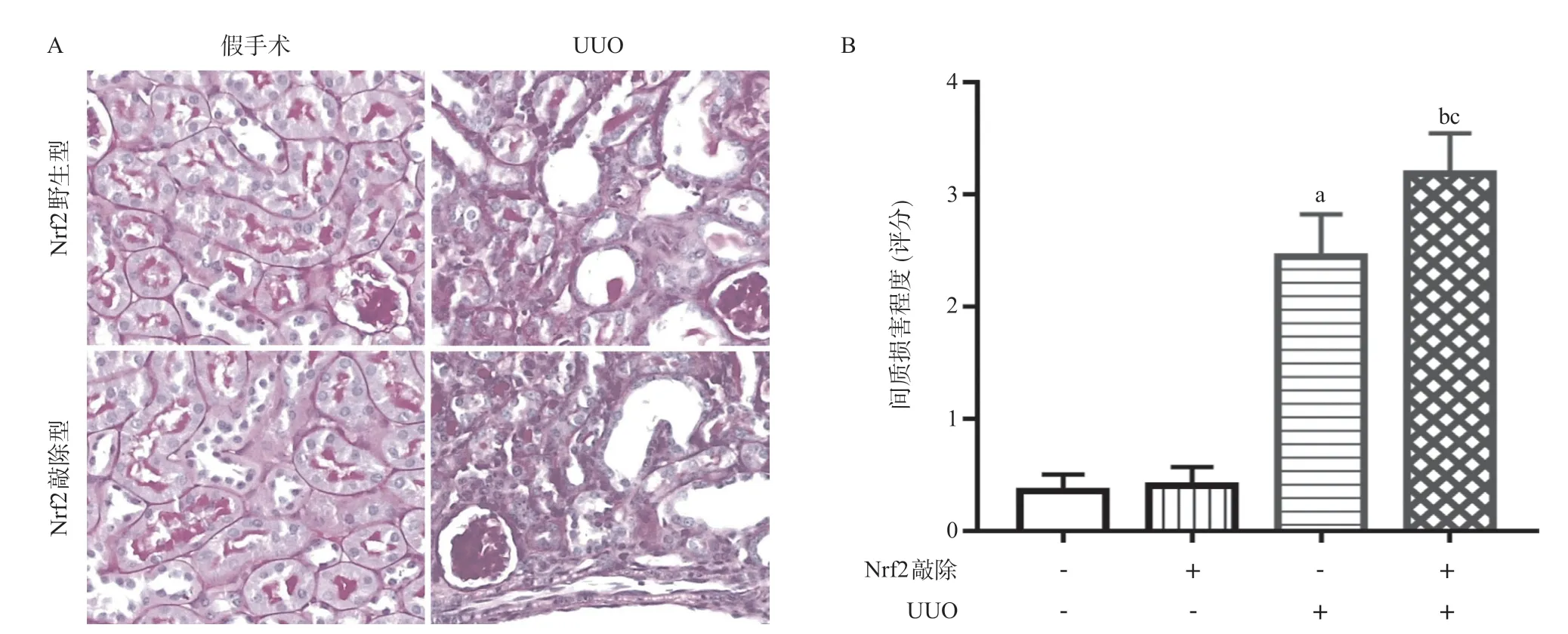
图2 4组小鼠肾组织损伤程度比较
2.3 4组小鼠肾组织纤维化的比较 与Nrf2野生型假手术组比,Nrf2野生型UUO组肾间质总胶原累积显著增加,差异有统计学意义(P<0.01)。与Nrf2敲除型假手术组比,Nrf2敲除型UUO组的胶原累积显著增加,差异有统计学意义(P<0.01)。与Nrf2野生型UUO组比,Nrf2敲除型UUO组肾胶原累积显著增加,差异有统计学意义(P<0.05),见图3。
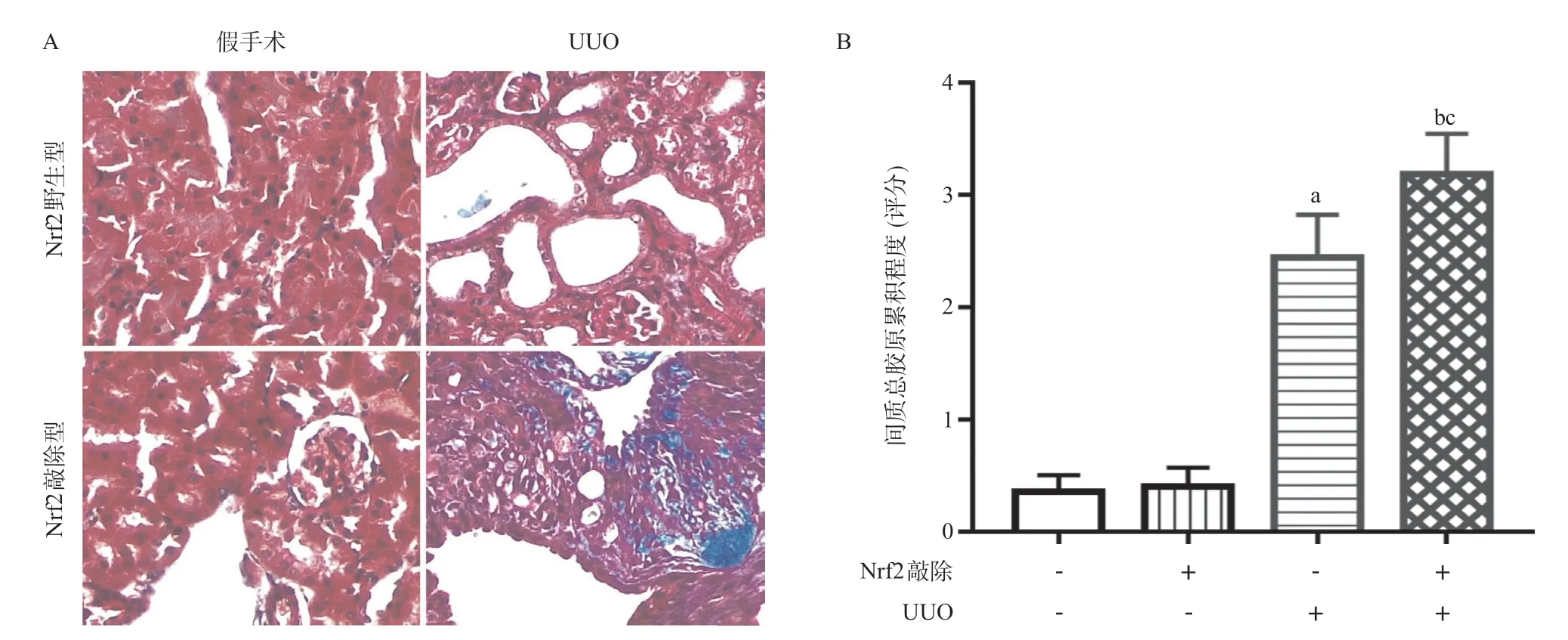
图3 4组小鼠肾组织纤维化的比较
2.4 4组小鼠肾组织肌成纤维细胞活化的比较 与Nrf2野生型假手术组比,Nrf2野生型UUO组肾组织α-SMA蛋白的表达水平显著增加,差异有统计学意义(P<0.05)。与Nrf2敲除型假手术组比,Nrf2敲除型UUO组α-SMA蛋白表达水平显著增加,差异有统计学意义(P<0.01)。与Nrf2野生型UUO组比,Nrf2敲除型UUO组α-SMA的表达明显增加,差异有统计学意义(P<0.05),见图4。
2.5 4组小鼠肾组织胶原累积水平比较 与Nrf2野生型假手术组比,Nrf2野生型UUO组III型胶原蛋白的表达水平显著增加,差异有统计学意义(P <0.01)。Nrf2敲除型假手术组比,Nrf2敲除型UUO组III型胶原蛋白表达水平显著增加,差异有统计学意义(P<0.01)。与Nrf2野生型UUO组比,Nrf2敲除型UUO组III型胶原蛋白的表达明显增加,差异有统计学意义(P<0.05),见图5。
2.6 4组小鼠肾组织TGF-β1表达水平比较 与Nrf2野生型假手术组比,Nrf2野生型UUO组TGF-β1mRNA和蛋白的表达水平显著增加,差异有统计学意义(P<0.01)。与Nrf2敲除型假手术组比,Nrf2敲除型UUO组TGF-β1表达水平明显增加,差异有统计学意义(P<0.01)。与Nrf2野生型UUO组比,Nrf2敲除小鼠UUO组TGF-β1mRNA和蛋白的表达明显增加,差异有统计学意义(P<0.05)。见图6。

图4 4组小鼠肾组织肌成纤维细胞活化的比较
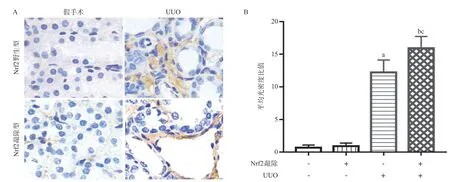
图5 4组小鼠肾组织胶原累积水平比较
3 讨论
核转录因子Nrf2 属于帽和领(Cap'n'Collar,CNC)亮氨酸拉链转录激活因子家族(CNC-bZIP)成员,可通过编码一系列抗氧化剂保护相关蛋白,调节多种细胞内氧化还原微环境,因此Nrf2成为细胞抗氧化应激的重要分子。多项研究表明,Nrf2与各种原因诱导的肾损伤及纤维化病变密切相关[2-4]。在链脲佐菌素诱发的糖尿病肾病中,Nrf2基因敲除会加剧小鼠肾损伤程度和纤维化[6],而应用药物靶向提高Nrf2活性,则能减轻慢性肾损害与纤维化程度[7]。因此,Nrf2可能是人类肾脏疾病潜在的治疗靶点[8]。
本研究应用Nrf2基因敲除小鼠,通过构建UUO模型以形成纤维化,来研究Nrf2对肾肌成纤维细胞的活化与纤维化的影响。首先,本研究评价了敲除Nrf2对肾功能的影响,发现敲除Nrf2并未能明显下调肾功能。推测这一方面可能与标本量有关,另一方面可能与对侧肾的代偿作用有关。其次,与Nrf2野生型UUO组比,Nrf2敲除型UUO组肾损伤更明显,总胶原累积更严重。深入分析,Nrf2敲除型UUO组α-SMA的表达较Nrf2野生型UUO组更高,同时III型胶原的表达也明显增强。这些证据表明:Nrf2与肾损伤及纤维化呈现明显负相关。Nrf2可能通过抑制肾组织氧化应激反应,降低局部炎症损伤,缓解肾肌成纤维细胞活化和胶原积聚[4]。同时,Nrf2也可能通过调控巨噬细胞浸润和极化,抑制炎症小体形成,最终影响肾纤维化进程[9]。基于此,Nrf2可以 预防或者减轻包括砷、铬和镉在内的多种重金属引起的肾毒性[10-12],也可以抑制免疫抑制剂环孢菌素A所致的TGF-β1表达增加,进而引起肾小管上皮细胞表型转化和间质纤维化[13]。

图6 4组小鼠肾组织TGF-β1表达水平比较
本研究也发现Nrf2 影响肾纤维化的机制与TGF-β1有关,TGF-β1是介导EMT最重要的诱导因子。对肾小管上皮细胞而言,TGF-β1可以通过细胞膜上受体TGF-β1R的介导,影响下游信号分子Smad2/3的磷酸化及入核表达,最终引起小管上皮细胞向肌成纤维细胞转化[1]。同样,TGF-β1的作用也可以促进肾间质成纤维细胞分化为肌成纤维细胞,并诱导肌成纤维细胞的活化。在肺纤维化模型中,敲减Nrf2可诱导TGF-β1介导的表型转化和纤维化[14]。同样,在糖尿病肾病中Nrf2 可抑制TGF-β1 转录水平,进而缓解纤维化病变[15]。Nrf2对TGF-β1转录水平的调控主要是通过与转录因子c-Jun和SP1 的相互作用,进而结合到TGF-β1启动子的特定区域影响其转录[15]。本研究结果也支持了上述观点,即Nrf2 对TGF-β1及肌成纤维细胞表型转化的抑制作用。在构建的UUO模型中,肾TGF-β1mRNA和蛋白的表达均明显升高,敲除Nrf2可加剧TGF-β1的表达。因此,TGF-β1可能是Nrf2抗肾纤维化作用重要的下游分子靶点。
