基于RNA-seq 筛选不同饲养模式下肉鸡肌肉发育代谢相关差异基因
2020-05-22王佳洁沈中浩周晓龙杨松柏赵阿勇
王佳洁,沈中浩,周晓龙,杨松柏,赵阿勇,汪 涵
(浙江农林大学动物科技学院·动物医学院,浙江临安 311300)
目前,地面平养和笼养是世界范围内肉鸡最主要的饲养方式。Castellini 等[1]研究发现,平养模式更有利于鸡肌肉发育,该模式饲养的鸡肌肉能量和脂肪含量较低,水分含量高,腿肌肌肉氧化性强,饱和脂肪酸含量高,单不饱和脂肪酸水平低。鸡肌肉中脂肪酸含量不仅在肌肉代谢中发挥着十分重要的生理作用,而且与鸡肉风味密切相关[2]。有研究发现,平养模式下,鸡增重速度快,具有较大的运动量,更有利于肌肉发育,但肌肉中营养成分(水分、蛋白质、脂肪)、持水能力、剪切力、pH 等无显著改变[3]。然而,关于不同饲养模式影响肉鸡肌肉发育及代谢的分子机制仍有待进一步研究。
当前,转录组测序技术(RNA-seq)已成为生物学、医学、临床等各领域研究中最常用的技术手段[4];RNAseq 技术也为筛选畜禽肌肉相关性状差异关键基因及探究肌肉相关基因功能提供了至关重要的研究途径[5-6]。因此,本实验以不同饲养模式下的肉鸡为研究对象,通过RNAseq 技术对2 种饲养模式下的肉鸡腿肌进行测序分析,筛选出与肌肉发育代谢相关的差异基因,为今后通过科学的饲养管理提高肉鸡肌肉品质提供重要的科学依据。
1 材料与方法
1.1 材料
1.1.1 实验材料 RNA 提取TRIzon Reagent 购自北京康为世纪生物科技有限公司;反转录试剂盒5X All-In-One RT Master Mix、定量试剂盒EvaGreen 2X Qpcr Master Mix 均购自苏州爱必梦生物科技有限公司;Pax7 抗体(ab187339)、Desmin 抗体(ab6322)均购自abcam公司;Myhc 抗体(sc-20641)购自Santa Cruz Biotechnology公司;磷酸盐缓冲液(PBS)、胎牛血清(FBS)、马血清、DMEM 培养基均购自于HyClone 公司;青链霉素混合液、胶原酶、抗荧光衰减封片剂均购自于Solarbio 公司;胰酶(0.25%Trypsin-EDTA 1X)、荧光二抗(Alexa Fluor®488 goat anti-mouse IgG 和Alexa Fluor®488 goat anti-rabbit IgG)均购自于Thermo Fisher 公司;Lipofectamine 3000 脂质体购自于Invitrogen 公 司;OPTI-MEM 培养基购自于Gibco 公司;普通siRNA、阴性对照siRNA、EdU 检测试剂盒(Cell-Light EdU Apollo567 In Vitro Kit)均购自于广州锐博生物技术有限公司。
1.1.2 实验动物 选取210 只体重相近的1 日龄 Ross308肉鸡,随机分为2 组,笼养组10 个鸡笼,每个鸡笼6只肉鸡(n=10);地面栏养组10 个围栏,每个围栏15只鸡,地面上铺设10 cm 的新木屑(n=10)。2 组肉鸡饲料相同,均根据不同阶段(雏鸡阶段、中期阶段和肉大鸡阶段)所需的营养进行科学配比,均自由采食和饮水。在笼养和地面平养鸡中各随机选取5 只42 日龄肉鸡母鸡进行称重,计算2 组肉鸡的平均日增重,随后进行屠宰。
10 日龄鸡胚由本实验室取种蛋孵化10 d 后所得,种蛋购自浙江某种禽有限公司。
1.2 转录组测序及数据分析
1.2.1 样本采集及处理 使用Trizol 法提取肉鸡腿肌RNA,通过北京百迈客样品检测中心进行质量检测,保证样品质量满足建库要求。以RNA 为模板反转录得到cDNA。
1.2.2 测序文库构建与序列测序 基于边合成边测序(Sequencing By Synthesis,SBS)技术,通过Illumina高通量测序平台对样品进行测序并构建文库。本研究将平养模式和笼养模式下的腿肌组织分别编号为C1T-C5T和P1T-P5T,以便后续进行结果分析。
1.2.3 差异基因筛选 在差异表达基因检测过程中,将Fold Change≥2 且FDR<0.05 作为筛选标准。差异倍数(Fold Change)表示两样品(组)间表达量的比值。错误发现率(False Discovery Rate,FDR)是通过对差异显著性P值(p-value)进行校正得到的。并最终采用FDR 作为差异表达基因筛选的关键指标。
1.3 荧光定量PCR 验证 根据NCBI 中的基因序列,通过Primer Premier.5 软件对不同饲养模式下的差异基因PHGDH、ASNS、JPH2以及随机选取的2 个任意基因LDHA、BLOC1S4以及内参基因GAPDH进行引物设计,引物由杭州有康生物技术有限公司合成,具体序列如表1。将反转录合成的cDNA 模板,加入已验证好的引物进行10 μL 体系的荧光定量PCR 反应分析,反应体系:Eva Green 2x qPCR Master Mix 5 μL,Forward Primer 0.3 μL,Reverse Primer 0.3 μL,cDNA 3.5 μL,ddH2O 0.9 μL;qPCR 程序:95℃ 3 min,95℃ 10 s,60℃ 30 s,进行39 个循环,每个样本3 个重复。采用 2-△△CT法计算相关基因的相对表达水平。
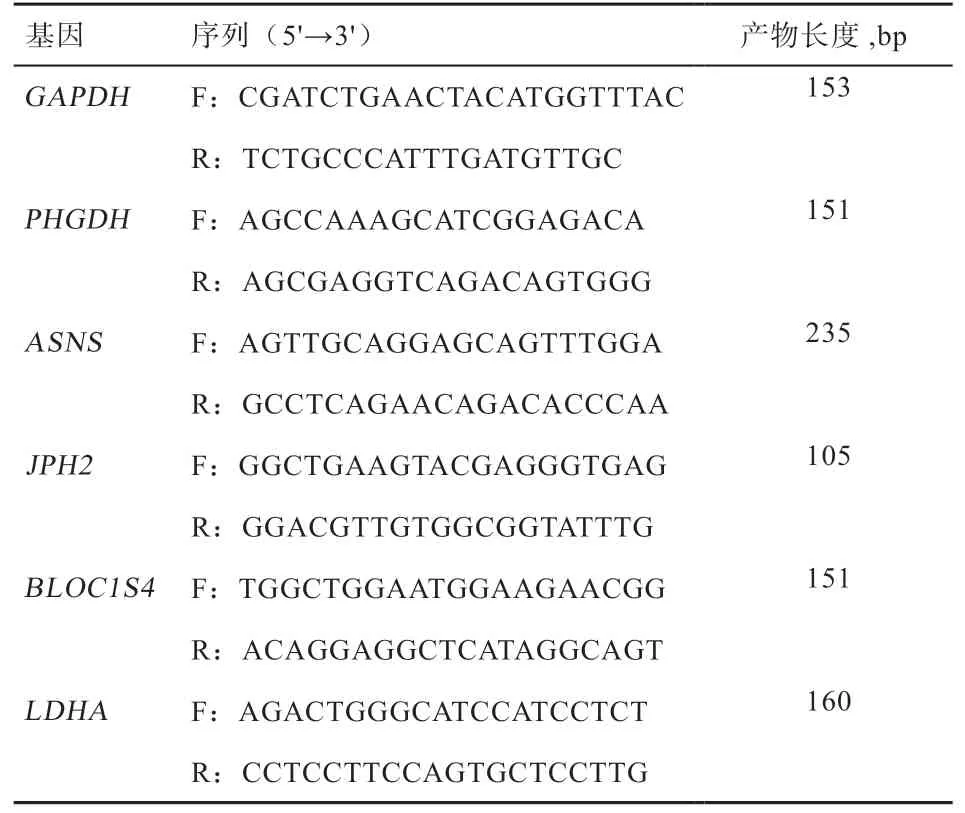
表1 用于荧光定量的引物序列
1.4 肉鸡骨骼肌卫星细胞的分离培养与鉴定
1.4.1 肉鸡骨骼肌卫星细胞的分离培养 将10 日龄种蛋用酒精消毒后,置于蛋托上,用镊子轻轻敲破蛋壳,将气室上部蛋壳剔除,用另一把镊子撕开气室薄膜,注意不要污染蛋清。使用一把新镊子将鸡胚夹出,置于细胞培养皿上,剔除鸡胚腿部肌肉皮肤后将鸡胚腿部肌肉剪下,置于一个新的培养皿中,用含双抗的PBS 洗涤3 次,剔除皮、血管、脂肪、结缔组织。将鸡胚腿部肌肉剪至肉糜状,将肉糜吸入移至15 mL 离心管中,加入0.25%的胰酶37℃消化10 min。加入含10% FBS 的DMEM 全培养基终止消化,用70 μm 的滤网过滤到另一新的细胞培养皿中。将细胞滤液移至新的15 mL 离心管中,1 000 r/min 离心8 min,弃上清,用含15%FBS 的DMEM 培养液重悬细胞,将细胞悬液加入新的培养皿中,37℃、5% CO2培养箱中培养1 h 后,吸取细胞悬液至新的培养瓶,进行连续平板培养以富集肌卫星细胞并消除成纤维细胞,用2% 马血清替换15% 胎牛血清诱导细胞分化。
1.4.2 肉鸡骨骼肌卫星细胞的鉴定 取分离的鸡骨骼肌卫星进行培养,待细胞长至70%~80%融合度时,参考Luo 等[7]采用的免疫荧光检测方法,将培养的细胞用爬片处理后,对骨骼肌卫星细胞标志基因Pax7及Desmin进行免疫荧光染色。取另一批分离的鸡骨骼肌卫星细胞,待细胞长至70%~80%融合度时,更换为分化培养基培养,分化4 d 后对骨骼肌细胞分化标志基因Myhc进行免疫荧光染色。随后,用荧光倒置显微镜拍照。
1.5 肉鸡骨骼肌卫星细胞体外培养不同时期的RNA 提取 取分离的鸡骨骼肌卫星进行培养,待细胞分裂、增殖至70%~80% 细胞融合度时,更换成分化培养基继续培养 2、4、6 d,70%~80%细胞融合度的时间记为0 d。收集提取处于增殖期30% 细胞融合度、50% 细胞融合度、70%~80% 细胞融合度(0 d)以及处于分化期2、4、6 d 的骨骼肌细胞RNA,反转录后置于-20℃冻存。以GAPDH作为内参基因,对关键差异基因PHGDH进行荧光定量PCR 检测分析。
1.6 细胞的转染 取培养的鸡骨骼肌卫星细胞铺于6 孔板中,待细胞分裂、增殖至70%~80%细胞融合度时,更换无血清无双抗培养基。将合成的PHGDH特异性的siRNA 试剂及阴性对照(NC)按照Lipofectamine™3000 脂质体转染说明书转染至鸡骨骼肌细胞中。将细胞放入37℃、5% CO2培养箱中培养4~6 h 后换液。
1.7 EdU 细胞增殖检测 转染4~6 h 后,将鸡骨骼肌卫星细胞在含有10 mmol/L EdU 的新鲜生长培养基中继续培养。培养24 h 后,每5 min 用PBS 清洗细胞2 次,随后在每孔中加入4% 多聚甲醛进行固定,室温静置30 min 后吸去细胞固定液。随后加入2 mg/mL 的甘氨酸,置于脱色摇床孵育5 min,吸去溶液。在脱色摇床上用PBS 清洗细胞5 min,加入配制好的渗透剂,置于脱色摇床孵育10 min,再用PBS 清洗5 min。避光加入Apollo 染色反应液,室温下置于脱色摇床上30 min 后吸去染色反应液。再次加入渗透剂清洗2~3 次,每次均置于脱色摇床上10 min,后弃去渗透液。每5 min 加入甲醇清洗1~2 次,再用PBS 清洗5 min。避光加入1×Hoechst 33342 反应液,在室温下置于脱色摇床30 min,后弃去染色反应液。PBS 清洗3 次后封片拍照,也可避光置于4℃湿润保存待测。
2 结果与分析
2.1 日增重数据分析 由图1 可知,地面平养肉鸡的日增重极显著高于笼养肉鸡。
2.2 测序质量评估 对10 个样本进行质量检测,从表2 中可以看出其中Q20 和Q30 均在90% 以上,GC 含量在49%~53%,说明测序碱基识别时出错的概率较低,碱基含量接近,样本组成情况良好。

表2 测序数据质量评估
将测序获得的数据与参考基因组进行Map(表3),结果发现比对到参考基因组上的 Reads 数目均大于75%,比对到参考基因组唯一位置的Reads 数目在74%~92%,从比对结果统计来看,各样品的Reads 与参考基因组的比对效率在78.29%~91.18%,这表明样本的可利用率较高。综上分析,测序数据良好,可以进行下一步数据分析。
与此同时,对测序数据进行了基因表达相关性散点图分析,偏离对角线的点越少,则说明样本间相关性越高,样品的重复性越好(图2)。
2.3 差异表达基因筛选 根据差异表达的基因构建火山图,以-lg(FDR)为纵坐标,log2(FC)为横坐标(图3),横坐标表示某一个基因在两样品中表达量差异倍数的对数值,结果表明差异基因在两组样品间的差异表达倍数较大。纵坐标表示差异表达显著性,结果表明差异基因显著性较高,筛选得到的差异表达基因较为可靠。将FDR<0.05 作为差异表达基因筛选条件,筛选2 组样品中的差异表达基因,最终筛选出3 个上调基因,分别为亲联蛋白2 基因(JPH2)、3-磷酸甘油酸脱氢酶基因(PHGDH)、天冬酰胺合成酶基因(ASNS)(表4)。

表3 与参考基因组比对统计结果
2.4 荧光定量PCR 验证 图4 显示,3 个差异表达基因在不同饲养模式下的表达水平均存在显著或极显著的差异,而随机选取的2 个任意基因差异不显著。表明荧光定量PCR 验证的结果与RNA-Seq 中基因表达检测的结果一致。

表4 差异表达基因统计表
2.5 肉鸡骨骼肌卫星细胞的分离培养与鉴定 结果显示,Pax7在细胞核中呈阳性表达(图5-A),Desmin和Myhc在细胞质中呈阳性表达(图5-D 和图5-G)。表明本实验所分离的细胞是肉鸡骨骼肌卫星细胞。
2.6PHGDH在肉鸡骨骼肌卫星细胞体外培养不同时期的表达谱检测 如图6 所示,PHGDH基因的表达水平在细胞增殖期逐渐升高。在细胞分化第2~6 天逐渐降低,但在分化第2 天PHGDH基因的表达量显著高于第0 天。表明PHGDH可能在不同饲养模式肉鸡的骨骼肌形成过程中发挥重要作用。
2.7 抑制PHGDH对肉鸡骨骼肌卫星细胞增殖的影响如图7 所示,siRNA-PHGDH组细胞与NC 对照组相比,EdU 阳性细胞的比例极显著减少,表明处于增殖状态下的细胞比例减少。
3 讨 论
饲养模式是影响肉鸡肌肉发育代谢的一个重要因素,已有研究表明饲养方式能够很大程度上影响肉鸡肌肉发育,同时也与鸡肉肉质品质变化密切相关[8]。分析不同饲养模式下肉鸡肌肉中差异表达的基因,对进一步科学地利用适宜的饲养方式改良肉鸡生长与肉质性状具有重要的推动作用。
本实验通过对平养和笼养2 种饲养模式下的肉鸡肌肉组织进行转录组测序,共筛选出3 个与肌肉发育代谢相关的重要差异表达基因,分别为ASNS、JPH2和PHGDH基因,且差异基因均在平养模式鸡腿肌中高表达,在笼养模式中低表达。ASNS 与天冬酰胺的合成密切相关,是氨基转移酶家族成员之一[9]。研究发现在仔猪日粮中添加天冬酰胺能够有效促进肌肉中蛋白质的合成[10],而在之前的一项研究中发现平养鸡肌肉中总蛋白含量要显著高于笼养鸡[11]。因此,本研究中发现的ASNS基因在平养鸡肌肉中高表达的结果,可能正是阐明饲养模式影响鸡肌肉总蛋白含量变化的关键所在。JPH2 是肌肉横管和肌质网缝隙连接中的重要功能蛋白,它在维持横管结构和调节钙离子稳态方面发挥着关键作用。在肌肉中,JPH2的表达可以加快钙离子释放,促进肌肉兴奋-收缩耦联机制,更有利于肌肉的运动[12]。有研究发现JPH2的表达对小鼠肌肉发育至关重要[13]。平养模式下的肉鸡运动量往往高于笼养鸡,运动强度的增加势必需要进一步加快骨骼肌兴奋收缩机制,因此JPH2基因的表达就显得尤为重要。本研究发现JPH2基因在平养鸡肌肉中高表达,这进一步说明JPH2基因可能是影响平养肉鸡肌肉发育代谢的关键基因之一。PHGDH 是丝氨酸合成途径中的限速酶,在该合成途径中会产生许多代谢中间产物,如丝氨酸、甘氨酸、半胱氨酸和磷脂等,这些产物对于蛋白质合成和细胞生长是不可或缺的[14]。尽管目前PHGDH在肌肉细胞中发挥作用的具体机制还未可知,但已有研究表明PHGDH是调控细胞生长的一个基本调节因子,过表达PHGDH能够显著促进细胞的增殖[15]。本研究发现,PHGDH基因在平养鸡肌肉中高表达,这表明在该饲养方式下肌肉中丝氨酸的合成速率可能较快。
对目的基因进行表达谱检测,通常是初步探究其生理功能的重要手段之一。鉴于PHGDH在肌肉生长发育中可能发挥的关键作用,本研究成功分离、鉴定并构建了鸡骨骼肌卫星细胞增殖分化模型,发现PHGDH基因在鸡骨骼肌细胞增殖期间的表达量逐渐上调,表明PHGDH基因可能在鸡骨骼肌细胞增殖过程中起到正调控作用。而已有研究发现,抑制PHGDH表达可显著抑制癌细胞的增殖[16]。此外,本研究通过EdU 细胞增殖检测发现,抑制PHGDH表达可显著减少处在增殖期的肉鸡骨骼肌卫星细胞比例。由此推测,PHGDH基因可能对鸡肌肉细胞的增殖起正调控作用,可能是不同饲养模式影响肌肉生长发育的一个关键基因。
本研究还发现在骨骼肌细胞分化期间,PHGDH的表达量逐渐降低,这表明PHGDH可能在鸡骨骼肌细胞分化过程中起到负调控作用。而PHGDH在分化第2 天出现的高表达现象可能是由于在本分化模型前期大部分鸡骨骼肌细胞仍短时处于增殖状态。综上,本研究下一步将主要侧重于对PHGDH在鸡骨骼肌卫星细胞增殖分化过程中的调控机制进行探究。
4 结 论
本研究基于RNA-seq 技术,对不同饲养模式下的肉鸡腿肌进行高通量转录组测序和分析,发现了3 个与肌肉发育代谢相关的关键差异基因(ASNS、JPH2、PHGDH),且均在平养模式鸡腿肌肌肉中高表达;对PHGDH基因在肉鸡骨骼肌卫星细胞体外培养的不同时期进行表达谱检测分析,以及结合抑制PHGDH表达的EdU 细胞增殖检测结果中发现PHGDH基因可能在肉鸡骨骼肌卫星细胞的增殖过程中发挥正向调控作用,PHGDH基因可能是饲养模式影响肉鸡肌肉发育的一个关键基因。
