桑葚酒中花青素含量的测定方法优化
2020-05-21郭浩然郑心怡李小定
郭浩然,郑心怡,张 静,李小定
(环境食品学教育部重点实验室,华中农业大学食品科学技术学院,湖北武汉 430070)
花青素(Anthocyanin)又称为花色素,在天然状态下花青素常与各种单糖结合形成花色苷[1]。花青素有较强的体外抗氧化能力,可以作为氧自由基的清除剂,可以保护H2O2引起的细胞凋亡[2]。并且花色苷具有显著的抗疲劳作用[3],对血糖调节、降低血脂、保护神经系统有重要作用[4],对于治疗心血管疾病也具有重要的意义[5]。桑葚富含丰富的营养物质和有效的生物活性物质[6],有明目、保肝、降血压等作用[7]。桑葚的储藏性较差,含糖量较高且酸度适宜,是一种较好酿酒原料[8]。近年来,有研究表明,在长时间存放的果酒和果汁中存在一类吡喃型花青素衍生物。这类吡喃型花青素相对于普通花青素呈现出更高的pH、SO2以及储藏稳定性,具有更加优越的色泽稳定性[9];并且,吡喃型花青素具有一定的抗氧化能力、抗癌和抗炎症等生理活性功能[10],这些发现均为花青素广泛应用于食品从而发挥其生理功能提供了新的可能。
常用的花青素分析方法主要有高效液相色谱法、单一pH法、差减法和pH示差法等[11-16]。其中pH示差法的原理是基于花青素在不同pH环境中结构和呈色转变是pH的函数,而样品中其他干扰物的特征光谱却不会随环境pH变化而变化,通过加入不同pH缓冲溶液后测定吸光值,根据两者最大的吸光值的差异通过公式计算出花青素的含量[17]。pH示差法测定花青素的含量不需要纯度较高的标准品,因此该方法成本较低,并且操作简便,是花青素定量分析最常用的方法之一。一般在使用pH示差法前,需要对测定波长、使用缓冲液的pH、反应的平衡温度和时间进行确定,以达到最准确的测定效果。测定波长的确定大多研究方法是选择花青素处理液的最大吸收波长,通常在520 nm左右;缓冲液pH则是选择两个具有最大吸光值差异且较为稳定的pH。pH示差法的反应平衡温度一般不会选择较高温度,因为温度对花青素的稳定性有较大的影响[18];而对于反应平衡时间,不同研究报道的平衡时间具有一定差异,因为花青素的稳定性与其所处的食品基质的酸度、加工方式有很大关系[19]。
本文在以上研究的基础上,为获得发酵酒及其他发酵饮品中花青素测定的优化方法,对pH示差法测定桑葚酒中花青素含量的最佳测定波长、缓冲液的最适pH、平衡温度和时间等条件进行优化,并进行方法学评价,为今后pH示差法应用于发酵酒中花青素测定提供参考。
1 材料与方法
1.1 材料与仪器
桑葚干红 由湖北省圣源酒业提供;矢车菊素-3-葡萄糖苷标准品 色谱级,成都瑞芬思生物技术有限公司;乙酸、乙酸钠、盐酸、氯化钾、柠檬酸、柠檬酸钠 均为分析纯,国药集团化学试剂;蒸馏水 实验室自制。
紫外分光光度计 日本岛津有限公司;721可见分光光度计 天津冠泽科技有限公司;HH-2数显恒温水浴锅 国华电器有限公司;pH计 梅特勒-托利多仪器(上海)有限公司;高速冷冻离心机 湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 缓冲液的配制 配制不同pH的缓冲液,具体方法参考文献[14]。pH为0.5和2.0的缓冲溶液的配制:向0.1 mol/L的柠檬酸溶液中逐滴加入盐酸,并使用pH计校准至所需的pH即可。pH为1.0的缓冲液的配制:0.2 mol/L的氯化钾溶液和0.2 mol/L的盐酸溶液以25∶67的体积比混合。pH=4.5的缓冲液的配制:0.2 mol/L的乙酸钠溶液与0.2 mol/L的乙酸溶液按照体积比1∶1混合后即得。pH=3、4、5、6的柠檬酸缓冲液配制方法见表1。
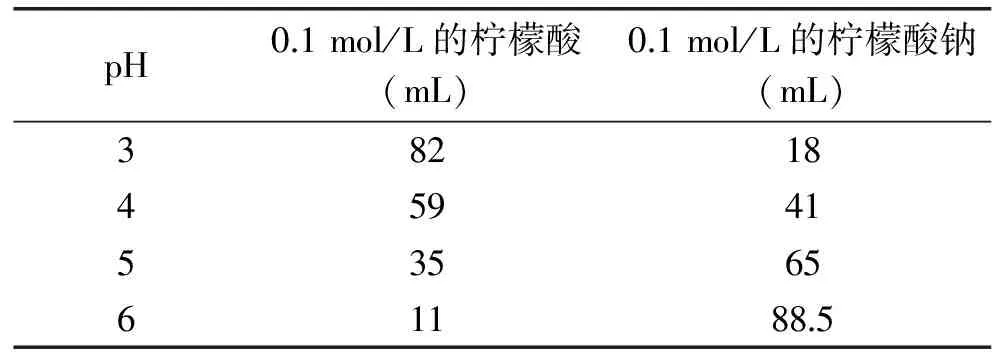
表1 不同pH柠檬酸缓冲液配制方法Table 1 Different pH citrate buffer configuration method
1.2.2 样品前处理 将桑葚酒样品装入离心管后配平,放置于高速冷冻离心机中,以10000 r/min的速度离心15 min,吸取上层清液待用。
1.2.3 花青素的定量分析 准确吸取离心后的桑葚酒1 mL至20 mL的具塞试管中,分别用pH为1.0和4.5的缓冲溶液定容至20 mL,后置于30 ℃下水浴恒温40 min,取出试管冷却至室温。以蒸馏水为空白对照,分别测定用pH=1.0和pH=4.5的缓冲液稀释后在519和700 nm下的吸光值,以矢车菊素-3-葡萄糖苷计,按照Fuleki公式计算出桑葚酒中花青素的含量[20]。
ΔA=(A519 nm-A700 nm)pH=1.0-(A519 nm-A700 nm)pH=4.5
式(1)
式(2)
式中:ΔA为桑葚酒中花青素的总吸光值;A519 nm为样品在519 nm处测定的吸光值;A700 nm为样品在700 nm处测定的吸光值;DF为稀释倍数;M为矢车菊素-3-葡萄糖苷的相对分子质量449.2 g/mol;ε为矢车菊素-3-葡萄糖苷的消光系数,26900 L·mol-1·cm-1;L为光程,值为1 cm。
1.2.4 样品测定波长的选择 分别用pH为1.0和4.5的缓冲液稀释处理后的桑葚酒样品,后在520 nm处测定样品吸光值,使得吸光值在0.2~0.7范围左右同时不影响缓冲液的缓冲能力下,确定稀释倍数。后将分别用两种缓冲液稀释一定倍数的处理液在370~800 nm进行光谱扫描,根据吸光值的差值确定最佳吸收波长。
1.2.5 样品测定pH的选择 用不同pH的缓冲溶液将样品稀释至1.2.4中确定的稀释倍数后,在扫描光谱中的最佳测定波长下测定吸光值,确定最适合的缓冲液pH。要求在最适pH时吸光值左右波动不大、较稳定,且两个缓冲pH所测吸光值具有最大的差异。
1.2.6 样品体系反应平衡温度和时间的选择 根据1.2.4和1.2.5得到的稀释倍数和缓冲液的pH,将缓冲液稀释过的待测液分别置于20、30、40 ℃下,以蒸馏水为空白对照,每隔10 min测定一次在最大吸收波长下的吸光值。
1.2.7 精密度实验 根据上述实验所得确定的条件,分别用pH为1.0和4.5的缓冲溶液将样品稀释20倍,后置于30 ℃下水浴恒温40 min,取出试管冷却至室温。以蒸馏水为空白对照,分别测定用pH=1.0和pH=4.5的缓冲液稀释后在519和700 nm下的吸光值。连续8次进行花青素的定量分析,评价条件优化后方法的精确度。
1.2.8 加标回收率实验 准确称取一定量的矢车菊素-3-葡萄糖苷的标准品,溶解后用pH示差法测定标准品溶液中花青素的含量,然后进行标准品溶液的二倍和四倍稀释。取四份处理后的桑葚酒样品,其中一份直接利用pH示差法测定其花青素的含量。其他3份分别取10 mL,后分别加入0.1 mL的标准品原液、标准品二倍稀释液和四倍稀释液。分别用pH示差法测定加入标准品后样品中花青素的含量,并根据以下公式计算加标回收率。
其中:P为加标回收率;C1为空白式样测定量;C2为加入标准品后测定含量;C3为加入标准品量。
1.3 数据处理
2 结果与分析
2.1 测定波长的选择
吸收光谱图曲线如图1所示,在370~800 nm的波长范围下,加入pH为4.5和1.0的缓冲溶液后,两者吸光值的差值在519 nm处有最大的吸收峰。单一的花色苷在可见区有一个最大吸收峰,且吸收带范围较窄,在80~100 nm之间;但是花色苷种类较为复杂时就可能有多个峰值或者更宽的吸收带范围[21]。且桑葚酒中花青素经不同pH的缓冲溶液稀释后,花青素生色团所处的pH环境随之发生改变,使得扫描光谱在高度和宽度发生变化或者波长发生位移,因此出现由pH变化引起的紫外差光谱现象。有研究表明矢车菊素葡萄糖苷在pH=1.0条件下最大吸收波长为510 nm,而随pH增加最大吸收波长发生红移,在中性条件下最大吸收波长为554 nm[22]。而花青素在不同的pH条件下有不同的存在结构形式,当处于pH为1.0的环境条件下,花青素以花色烊离子形式存在,呈现红色;当以pH为4.5的缓冲液稀释时,花青素以甲醇假碱形式存在,呈无色[17],所以当样品其他介质特征光谱不变时,能够表征由花青素结构变化导致的吸光值差异最大所对应的波长为最佳测定波长,因此519 nm为最佳测定波长。而花青素在700 nm处应无吸收,因此选择700 nm处作为另一测定波长,以消去食品中其他非花青素成分产生的影响。
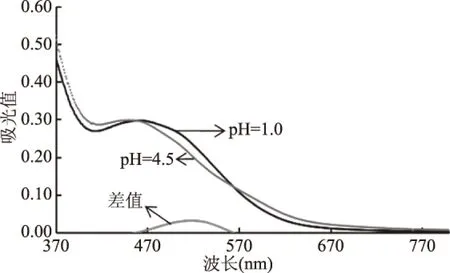
图1 桑葚酒样品的扫描光谱图Fig.1 Scanning spectra of mulberry wine samples
此外,针对pH示差法测定花青素的波长,有研究选择用花色苷标准品而非待测样品在可见区扫描出的最大吸收波长或缓冲液稀释标准品后扫描出的最大吸收波长[12,14],但是这种方法忽略了花青素存在的食品介质以及pH变化对扫描结果的影响。也有学者选择样品扫描出的在可见区的最大吸收波长[13],但是同样忽略了pH对花青素结构变化的影响以及pH示差法测定花青素含量的原理。
2.2 测定缓冲液pH的选择
在519 nm条件下,测定在pH为0.5、1.0、2.0、3.0、4.0、4.5、5.0、6.0的缓冲溶液中桑葚酒样品的吸光值结果如图2。由图2得出,在pH为0.5时具有最大吸光值,且与pH=1.0时吸光值差异不显著(P<0.05);在pH大于1.0后吸光值逐渐下降,并且于pH=4.5趋于稳定,且有最小的吸光值,pH=4.5之后吸光值无显著差异(P>0.05)。当pH为0.5和4.5时,具有最大的吸光值的差异,然而考虑到pH为1.0时的吸光值与0.5时吸光值差异不显著且与2.0时的吸光值不显著,即pH为1.0左右时具有较为不显著的吸光值波动,因此使用pH1.0和4.5的缓冲液。
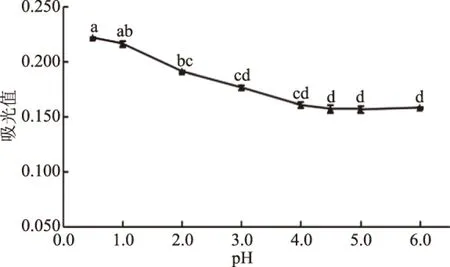
图2 不同pH条件下桑葚酒样品的吸光值Fig.2 Absorbance of mulberry wineunder different pH conditions注:不同字母表示差异显著(P<0.05)。
2.3 反应平衡时间和温度的确定
使用pH为1.0的缓冲液将桑葚酒样品稀释20倍后,分别放置于20、30、40 ℃下每隔10 min测定吸光值,所得结果如图3。在30 ℃下,测定样品的吸光值较稳定,当恒温水浴40 min后样品吸光值基本达到平衡。在40 ℃下恒温10~70 min时,反应体系吸光值出现增加的现象,可能是由于温度导致花青素损失同时伴随着褐变指数和聚合物色值的增加导致[23]。而在80 min时出现吸光值下降的现象,这可能是由于温度使游离型花青素分解。图4是pH=4.5的缓冲溶液在不同温度下吸光值随温度变化的结果,20 ℃下吸光值随时间变化的波动较大;30 ℃下水浴恒温40 min后反应趋于平衡。因此,选择优化后的反应平衡条件为30 ℃下恒温40 min。针对pH示差法测定花青素含量的报道选择平稳温度和时间一般为20 ℃下平衡100 min左右[12,16],或者是于40 ℃下平衡20~30 min[11,14]。而本文优化后条件相比于之前研究而言,既避免了温度较高导致花青素稳定性变差,从而降低方法测定的准确性,又缩短了反应体系的平衡时间。

图3 桑葚酒在pH=1.0条件下的平衡结果Fig.3 Balance results of mulberry wine at pH1.0

图4 桑葚酒在pH=4.5条件下的平衡结果Fig.4 Balance results of mulberry wine at pH4.5
2.4 精密度实验
根据上述确定的条件,将桑葚酒样品使用pH为1.0和4.5的缓冲溶液稀释20倍,在30 ℃条件下恒温水浴40 min,后冷却分别在519和700 nm下测定吸光值,根据公式计算花青素的含量。按照这个方法连续取样8次,重复测定花青素的含量。结果如表2所示,桑葚酒中花青素含量平均为23.80 mg/L,花青素含量的相对标准偏差(RSD)为2.076%。实验表明,使用该方法进行桑葚酒中花青素的定量分析重复性好、准确率高。

表2 pH示差法测定桑葚酒中花青素含量精密度实验结果Table 2 Precision experiment results of anthocyanin content in mulberry wine by pH differential method
2.5 加标回收率
根据上述条件优化后应用pH示差法测定花青素的加标回收率结果如表3所示。当加标量为0.1062 mg时,平均加标回收率为99.59%;当加入0.0531 mg时,加标回收率为102.70%;加标量为0.0266 mg时,平均加标回收率为100.6%。上述加标回收率均在可接受范围内,该结果表明,优化条件后的pH示差法能够准确可靠地测定桑葚酒中花青素的含量。

表3 桑葚酒中花青素加标回收率实验结果Table 3 Anthocyanin recovery experimentresults in mulberry wine
3 讨论与结论
针对pH示差法测定波长的选择,有研究以矢车菊素葡萄糖苷在pH为1.0环境下扫描出的最大波长[12],或是选用矢车菊素葡萄糖苷在pH为1.0环境下的摩尔系数对应的最大吸收波长为最佳测定波长[14],然而这两种方法均忽略食品介质对花青素扫描结果的影响,波长选择应该根据具体样品进行优化。另有研究选择样品分别在pH1.0和4.5处的最大吸收波长[13],忽略了环境pH变化会影响花青素结构从而对扫描结果产生影响。本文则选择样品在pH为1.0和4.5环境下吸光值差值最大处为最佳吸收波长进行方法优化,具有更好的合理性。缓冲液稀释桑葚酒处理液扫描后显示在两种缓冲液稀释后都未在可见光区出现吸收峰值,且吸光值大小差异不大,这与其他研究结果有较大出入。笔者认为出现这样的现象的原因与花色苷所处的介质有很大关系。桑葚酒中花色苷的种类较为复杂,在发酵和后续陈酿等过程中,花色苷和一些糖代谢的中间产物例如丙酮酸以及乙醛等发生反应,形成许多新型的花色苷。已有研究表明在发酵过程中会形成吡喃型花青素、花色双糖苷、聚合型花青素衍生物等结构的花青素[24-26]。而这些花色苷因结构不同,在显色性能、吸收波长以及pH稳定性等方面都有所不同。例如Vitisin B会发生较大的吸收波长的位移,吸收波长在490 nm附近,并且颜色呈橙黄色[26];Portisins型吡喃花青素具有极高的pH稳定性,在pH为3.6和1.0的环境下仍具有相同显色[9]。因此,由于介质不同导致的种类繁多且复杂的花色苷结构组成的样品体系和较为简单结构组成的样品体系获得的扫描结果必定不同。这也是本文对经过发酵酒或其他发酵处理后的饮品作为花青素介质的样品进行pH示差法的测定波长条件优化研究的意义之一。
对于反应平衡时间的确定,不同的学者研究结果不同。基于温度对花青素稳定性有较大影响,不同研究中反应平衡时间确定虽多有差异,但平衡时间都不长。因此,本文确定平衡时间为40 min具有一定合理性。在pH<7.0的环境中花色苷结构不同,化学平衡的时间不同。因此,反应平衡时间的确定除了与温度有关外,与花色苷的结构密不可分。由此,不同介质对pH示差法的测定条件有极大的影响。
然而,pH示差法测定酒中或者饮料中花青素含量是具有一定局限的,体现在计算中使用的消光系数ε不同。由消光系数不同引起的花青素含量测定结果与真实结果的差异可能是非常显著的。不同的学者研究中选定的消光系数不尽相同[11-16],然而ε值不仅与选定的基准花色苷有关,也与样品的基质有关,例如酸度、极性等[27]。因此为保证方法的准确,不同食品基质类型使用pH示差法时具有不同的参数和条件。
本文对桑葚酒中测定花青素含量方法的波长、缓冲液pH以及平衡温度和时间进行优化,发现消光系数对测定结果会产生一定影响。最佳的条件为:在波长519 nm,缓冲液pH为1.0和4.5,于30 ℃下恒温40 min。此时测定桑葚酒中花青素的含量为23.80 mg/L。该方法的RSD为2.076%,加标回收率为99.59%~102.70%,表明该方法具有较高的精确性,为发酵酒类食品测定花青素含量提供一定参考。然而,为进一步准确定量分析,应继续根据食品介质普遍特性确定消光系数,并进一步完善方法。
