具有潜在改善炎症反应益生菌的筛选
2020-05-21崔鹏月1灿3刘松玲2朱宗涛2敦2
崔鹏月1,2,彭 灿3,刘松玲2,4,5,朱宗涛2,苏 敦2,4,5,双 全
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018; 2.深圳市华大农业应用研究院,广东深圳 518120; 3.深圳市环境微生物基因组学与应用重点实验室,广东深圳 518083; 4.深圳华大生命科学研究院,广东深圳 518083; 5.深圳国家基因库,广东深圳 518120)
炎症反应是由组织损伤或病原体感染引发的免疫反应过程,当免疫反应发生紊乱或者持续时间过长,会使细胞持续分泌促炎因子,从而引发慢性炎症损伤,进一步引发多种慢性疾病,包括动脉粥样硬化、肥胖、糖尿病等[1]。过去几十年来,人们对益生菌在这些慢性疾病的炎症反应中所起的作用表现出浓厚的兴趣[2-3]。越来越多的研究发现,益生菌可通过其免疫作用[4]、代谢作用[5]和调节肠道菌群[6]等多种机制来缓解炎症反应进而维持机体稳态。
目前的研究主要集中在改善炎症反应益生菌的鉴定[7-8]和改善炎症反应机理[9]。然而,如何筛选具有炎症调节作用的益生菌菌株是个难题。巨噬细胞是主要的免疫细胞,分泌细胞因子的水平在评价细胞免疫功能中至关重要[10],因此研究益生菌与炎症巨噬细胞体外的相互作用对具有炎症调节作用益生菌的筛选有着重要意义。
为了找到具有潜在调节炎症反应的益生菌,本文利用细胞模型分析10株供试菌株对炎症模型细胞分泌炎性细胞因子的调节作用,并比较优选出的4株潜在益生菌的胃肠道耐受能力、粘附能力、抑菌能力和抗生素敏感性,以期为特定功能益生菌的开发与利用提供理论依据。
1 材料与方法
1.1 材料与仪器
菌株来源 深圳华大农业应用研究院,试验所用10株菌的菌株来源如表1所示,菌种存于50%甘油管中,放置于-20 ℃保存备用;BS培养基和MRS培养基 中国青岛海博生物技术有限公司;佛波酯、脂多糖Lipopolysaccharides(LPS) Sigma;ELISA:3种免疫因子检测试剂盒 R&D Systems;PRMI 1640培养基、胎牛血清(FBS)、FALCON胰蛋白酶(1∶250) Gibco;胃蛋白酶(1∶10000) Coolaber;细胞培养板 Axygen;PBS缓冲液 Beyotime;庆大霉素、链霉素、卡那霉素、新霉素、氨苄青霉素、四环素、红霉素、克林霉素、氯霉素、甲氧苄啶、环丙沙星、利福平、万古霉素 BBI Life Sciences;实验所用其他试剂 均为国产分析纯;HT-29人结肠癌细胞 协和医科大学基础所细胞中心。

表1 实验菌种Table 1 Lactobacillus strains in experiment
YXQ-30SII立式压力蒸汽灭菌锅 上海博讯实业有限公司;FP1100全自动生长曲线仪 芬兰百奥斯科林公司;58108冷冻高速离心机 德国Eppendorf;Galaxy170R CO2培养箱 德国Eppendorf;Synergy 2酶标仪 美国BioTek;SHP-250Y生化培养箱 上海精宏实验设备有限公司;DW-86L490超低温保存箱 青岛海尔股份有限公司。
1.2 实验方法
1.2.1 菌株对LPS诱导的THP-1细胞炎性细胞因子调节作用 参考徐栋花等[11]、谢超等[12]的方法加以改进。将待测菌株中的双歧杆菌以3%接种量接种于BS培养基中(厌氧管),其余待测菌株以相同的接种量接种于MRS培养基,37 ℃培养18 h,传代培养2次。将活化好的待测菌株,37 ℃培养至稳定期,离心收集菌体,PBS洗涤2~3次,热灭活后,将菌体悬浮于RPMI 1640基础培养基中,调整为1×107CFU/mL备用。
从液氮罐中取出THP-1细胞进行常规复苏、传代培养,培养细胞数量扩增至所需用量。调整THP-1细胞数为1×106cell/mL,接种于6孔板(共2 mL培养基),加入100 ng/mL的佛波酯(PMA)对THP-1进行诱导处理72 h成为巨噬细胞(Macrophage)。去除培养上清,用RPMI1640基础培养基洗涤2~3次,加入含有受试菌株菌悬液(1×107CFU/mL)的RPMI 1640培养基进行共培养16 h,每个受试菌株设置3个复孔。对照组为Macrophage+RPMI 1640基础培养基。模型组为Macrophage+RPMI 1640基础培养基,然后除对照组以外各孔添加脂多糖(LPS)母液,至终浓度为1 μg/mL,处理6 h后,用相应的试剂盒检测细胞培养上清液中炎性细胞因子TNF-α、IL-1β和IL-6的含量变化,用以筛选出具有抗炎能力的益生菌。
1.2.2 模拟胃肠液耐受试验 参考文献[13-14]方法加以改进后进行试验。在pH2.0和pH3.0无菌PBS中,加入3.5 g/L胃蛋白酶过滤除菌,制成模拟胃液。在pH8.0无菌PBS中,加入1.0 g/L胰蛋白酶和0.3%胆盐过滤除菌,制成模拟肠液,试验前需要对人工模拟胃液、肠液进行37 ℃预热,备用。
供试菌株传代培养2次,菌株长至稳定期时,各取1 mL菌液,离心收集菌体,PBS洗涤2~3次,分别加入与培养液等量的pH2.0和pH3.0模拟胃液,37 ℃培养3 h,用平板计数法测活菌数。菌株存活率的计算公式为:菌株的存活率(%)=3 h活菌数/0 h活菌数×100。
取1 mL菌液,离心收集菌体,PBS洗涤2~3次,分别加入与培养液等量的pH3.0模拟胃液,37 ℃培养3 h,离心收集菌体,加入1 mL模拟肠液继续37 ℃培养3 h,用平板计数法分别检测菌体与人工模拟胃液37 ℃共培养0 h时的活菌数和检测菌体与肠液37 ℃共培养3 h后的活菌数,菌株的存活率的计算公式为:菌株的存活率(%)=3 h活菌数/0 h活菌数×100。
1.2.3 菌株粘附能力试验 参考Gagnon等[15]方法并加以改进。离心收集培养至稳定期的供试菌株,并用PBS洗涤2~3次,最后用细胞完全培养基(RPMI 1640+10%胎牛血清)将其重悬至5×108CFU/mL备用。从液氮罐中取出HT-29细胞,进行复苏、传代培养,培养细胞数量扩增至所需用量后,将HT-29细胞接种于12孔板中,待细胞长至单层后,用无菌PBS冲洗细胞2~3次,然后加入1 mL供试菌株悬浮液。培养2 h后,PBS冲洗2~3次,用300 μL的胰蛋白酶消化3 min,加入700 μL含有10%胎牛血清的1640培养液终止反应。并将所得溶液收集至无菌EP管中,并将收集的溶液进行10倍梯度稀释,涂板计数。同时对空白组的细胞进行计数。供试菌株的粘附能力的计算公式为:粘附能力(CFU/cells)=每个培养皿内粘附的细菌总数/每个培养皿的总细胞数。
1.2.4 抑菌试验 采用牛津杯法[16]检测供试菌株对四种致病菌(大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和阴沟肠杆菌)的抑制活性。分别取0.1 mL四种致病菌悬液(108CFU/mL)于凝固的营养琼脂平板涂布,平衡30 min。用无菌的镊子把无菌的牛津杯放在涂有病原菌平板上,然后吸取0.25 mL供试菌株发酵液109CFU/mL于牛津杯中。平放37 ℃恒温培养24 h,检测抑菌圈直径大小。
1.2.5 药敏试验 参考文献[17]进行试验,对供试菌株进行13种抗生素敏感性试验。依据实验室原有说明书配制各类抗生素母液,取50 μL添加于96孔板中。活化菌株,调整菌液浓度到1×109CFU/mL,取50 μL菌液置于各样孔,培养48 h,OD625分光光度计扫描检测。以干酪乳杆菌ATCC334为质控,阴性对照组添加50 μL去离子水和50 μL MRS培养液,阳性对照组添加50 μL去离子水和50 μL待测菌株的MRS菌液。当阳性对照组孔内细菌明显生长时,试验才有意义。样品孔的检测值(OD625)低于阴性对照组的2倍即可视为停止生长,并读取该孔抗生素浓度即为抗生素对实验菌株的最小抑菌浓度(MIC)。
1.3 数据处理
试验中涉及的试验数据表示为平均值±标准差(Mean士SD)。采用SPSS 17.0软件对试验中涉及的数据进行显著性分析。
2 结果与讨论
2.1 改善模型细胞炎症反应益生菌的筛选
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌外膜的主要成分,作为一种天然免疫刺激剂,能刺激THP-1巨噬细胞合成并释放多种细胞因子,如肿瘤坏死因子α(tumor necrosis factorα,TNF-α)及白细胞介素6(interleukin 6,IL-6)和白细胞介素1β(interleukin1β,IL-1β)等[18-19],因此以炎症巨噬细胞为模型评价供试菌株的抗炎作用。由图1可知,与空白组相比经LPS诱导的模型组的TNF-α、IL-1β、IL-6水平均显著升高(P<0.05),说明炎症模型建立成功。供试菌株对炎症细胞进行干预发现,10株菌对不同的炎症性细胞因子的表达显示了不同的作用。由图1A可知,与模型组相比,各组均未显著降低TNF-α的水平。而SS-9、JQI-7、SD-H9和LLY-606均显著降低了炎症模型细胞的IL-1β的表达(P<0.05),并且与空白对照组无显著差异(图1B)。同时,菌株WX-94和SS-9显著降低了炎症模型细胞的IL-6的表达(P<0.05),并且与空白对照组无显著差异(图1C)。菌株SD-L8虽未显著降低炎症模型细胞IL-1β和IL-6的分泌,但可以发现其干预结果从数值上是降低了炎症模型细胞IL-1β和IL-6的分泌,并与SS-9干预的结果无显著差异(图1B、图1C)。因此推测菌株SD-L8具有降低炎性细胞因子分泌的潜能。目前研究证明,许多菌株可以在体外具有降低炎性细胞因子分泌的能力,但其作用的炎性细胞因子的类型存在差异。王侃[20]在研究中验证了乳酸杆菌(LactobacilluscaseiCICC6002)能显著降低炎症模型细胞TNF-a的分泌(P<0.05)。Yoon等[21]研究表明,鼠李糖乳杆菌BFE5264和植物乳杆菌NR74能抑制由LPS刺激、PMA诱导的THP-1细胞分泌炎性细胞因子IL-1β和TNF-α。池海波等[22]研究发现罗伊氏乳杆菌ATCC53608能够明显抑制脂多糖(LPS)刺激的小鼠巨噬细胞系RAW 264.7R分泌炎性细胞因子IL-6。本试验中的供试菌株除不能显著降低炎症模型细胞TNF-a的分泌外,SS-9、SD-H9、WX-94和SD-L8对模型细胞炎症反应的干预情况与以上研究结果相近。

图1 菌株对巨噬细胞THP-1炎症性细胞因子分泌的调节作用Fig.1 Regulatory of strains on macrophagesTHP-1 inflammatory cytokine secretion注:*代表与空白组相比较,差异显著,P<0.05;#代表与模型组相比较,差异显著,P<0.05;Δ代表与SS-9组相比较,差异不显著,P>0.05。
综合考虑试验菌株对模型细胞炎症反应的干预情况,认为SS-9、SD-H9、WX-94和SD-L8具有改善炎症反应的潜力,因此选取以上四株菌对胃肠道耐受能力、粘附能力、抑菌能力和抗生素敏感性进行评价。
2.2 菌株胃肠道耐受能力评价
益生菌相关产品通常以口服方式,经过胃到达肠道发挥其益生作用。摄入食物不同时胃的pH也不尽相同,其范围为1.5~5,并且正常人体内,十二指肠中胆汁盐的浓度可达到0.3~3 g/kg[18-19]。因此,对胃液低pH和肠液中的胆盐在一定时间内有良好的耐受性是选择益生菌的重要标准之一[20]。从表2可以看出所有菌株在pH3.0的人工胃液3 h后均能保持较高的存活率(81.02%~98.55%),表现出对pH3.0的人工胃液有良好的耐受性;而经过pH2.0的人工胃液处理后,所有菌株的存活率较pH3.0的人工胃液低,SD-L8的存活率最高可达到46.82%;SS-9的存活率次之,可达到12.30%;其余两株菌的存活率均未达到1%,推测以上4株菌在pH2.0的人工胃液下耐受性较差。
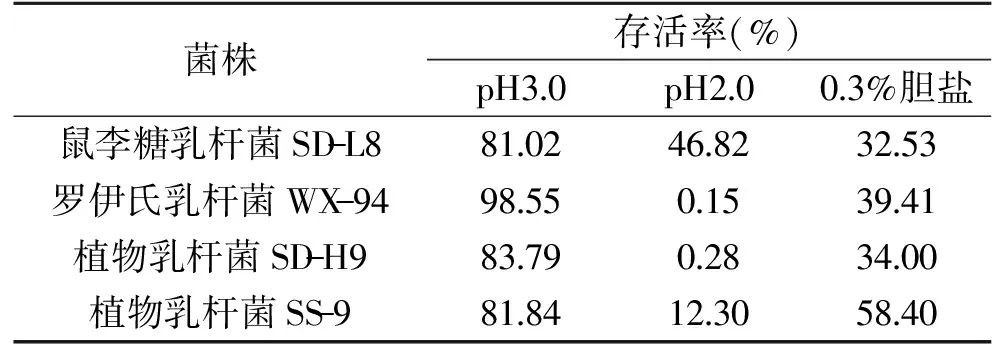
表2 菌株在模拟胃肠道环境下的存活率Table 2 Survival rate of bacteria insimulated gastrointestinal environment
所有菌株在pH3.0的人工胃液3 h后进入人工肠液,处理3 h后,表现出对人工胃肠液具有不同程度的耐受能力,SS-9的存活率最高可达到58.40%;SD-L8、WX-94和SD-H9存活率分别为32.53%、39.41%和34.00%。
本试验中供试菌株对人工胃液耐受结果与刘芸等[23]研究结果相近:植物乳杆菌FJAT-7926和干酪乳杆菌FJAT-7928对pH3.0人工胃液有良好的耐受性,处理2 h后,存活率分别为82.98%和77.42%。而pH2.0的人工胃液对植物乳杆菌FJAT-7926和干酪乳杆菌FJAT-7928的存活影响较大,处理2 h后,存活率分别为0.02%和0.07%。供试菌株对人工肠液耐受性优于高彩霞等[24]研究结果中干酪乳杆菌 BD0054、干酪乳杆菌LC2W和肠膜明串珠菌肠膜亚种BD1710对人工肠液的耐受性。
2.3 菌株粘附能力评价
菌株粘附于肠壁细胞的能力是其发挥作用的首要因素[25]。本研究以HT-29结肠细胞为模型评价菌株的粘附潜力。由图2可以看出各菌株粘附能力存在显著差异(P<0.05),SD-L8的粘附能力最强,可达到(14.5±1.3) CFU/cells,WX-94的粘附能力最弱,也可达到(5.2±1.0) CFU/cells,SD-H9与SS-9的粘附能力,分别为(9.5±0.8)、(7.5±0.8) CFU/cells。以上结果表明,四株菌均可定植于肠道上皮细胞,并且与李海红等[26]研究结果相似:鼠李糖乳杆菌具有较强的定植能力。乳酸菌对细胞粘附具有菌株差异性,即使是同源菌株对肠上皮细胞也具有不同的粘附特性[27]。目前普遍认为乳酸菌的粘附性是决定其免疫调节活性的重要因素之一,粘附能力强的乳酸菌能更好地增强机体的免疫应答[28]。菌株对细胞粘附能力的特异性与环境之间相互作用中涉及的结构分子直接相关,例如胞外多糖、菌毛、脂磷壁酸、表面蛋白等[27]。推测以上物质可能在菌株调节机体免疫应答中发挥一定作用。

图2 菌株对HT-29 细胞的粘附能力Fig.2 Adhesion of bacteria to HT-29 cells注:字母不同表示差异显著,P<0.05。
2.4 菌株抑菌能力评价
目前普遍认为益生菌可以通过产生有机酸、过氧化氢和类似细菌素的蛋白或肽类等物质,抑制或杀死病原菌,以维持肠道微生态平衡,保护人体免疫系统[29]。本试验采用牛津杯法分别探究以上四株乳酸菌对四株指示菌的抑制能力,结果如表3所示。四株乳酸菌对四株指示菌均有不同程度的抑制作用。SD-H9较其他三株菌相比对大肠杆菌的抑制能力较强,差异显著(P<0.05);WX-94对金黄色葡萄球菌、铜绿假单胞菌的抑制能力较强,差异显著(P<0.05);菌株SD-H9和WX-94对阴沟肠杆菌的抑制作用与菌株SD-L8和SS-9相比较弱,差异显著(P<0.05)。
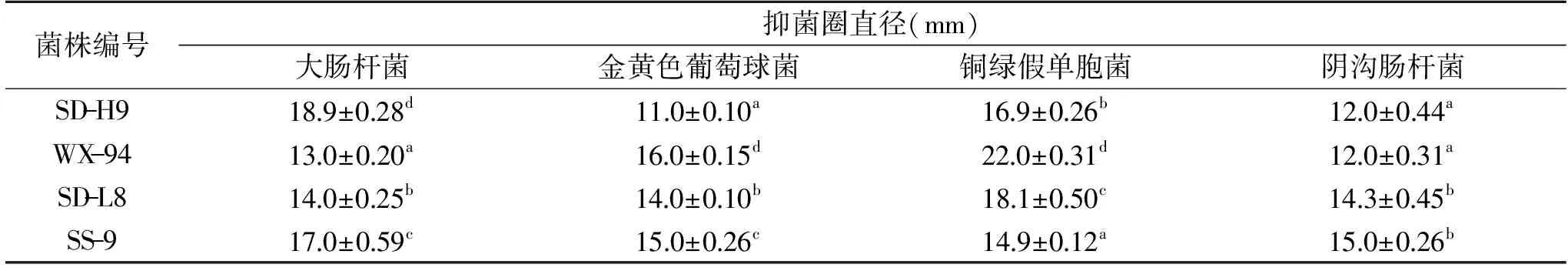
表3 菌株对指示菌的抑菌圈直径Table 3 Bacteriostatic zone of the bacterial strain against the indicator bacteria
2.5 菌株抗生素敏感性评价
在现代医学中,抗生素是防御细菌感染的主要方法,但细菌可以通过各种机制来对抗抗生素[30]。抗生素耐药性正在以惊人的速度发展,并已成为一个日益增长的全球公共卫生问题[31]。一些乳酸菌对一种或多种抗生素具有抗性[32]。本试验中抗生素敏感性测定参考欧洲食品安全局(EFSA)现行标准[33]和WHO提供的NCCLS标准[34]。分析以上四株乳酸菌对13种抗生素的敏感性,与其相应的MIC安全临界值进行比较,并选用干酪乳杆菌ATCC334为质控菌株。结果如表4所示,质控菌株干酪乳杆菌ATCC334对抗生素的敏感性与报道[17]中的相符,试验结果可信。SD-L8对新霉素的MIC值超过了其MIC安全临界值;WX-94对庆大霉素的MIC值超过了其MIC安全临界值;SS-9对红霉素和克林霉素的MIC值超过了其MIC安全临界值;SD-H9对13种抗生素的MIC值均符合MIC安全范围。因鼠李糖乳杆菌、罗伊氏乳杆菌和植物乳杆菌在中国食品药品监督管理局发布的《可用于保健食品的益生菌菌种名单》中,因此这三株菌可以在食品生产加工使用(婴幼儿食品除外)。
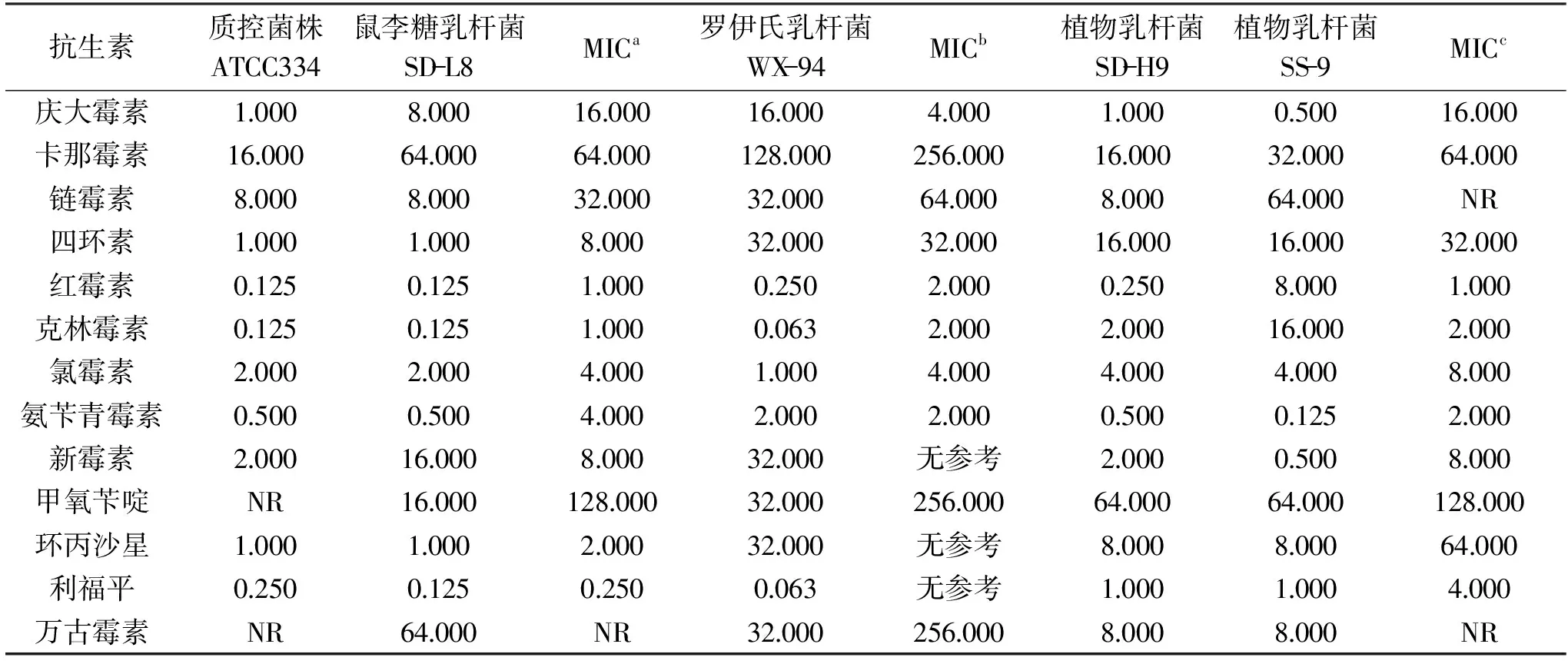
表4 菌株对13种抗生素的MIC(μg/mL)Table 4 MIC values of bacteria to 13 kinds of antibiotics(μg/mL)
3 结论
本研究通过评价菌株对巨噬细胞炎症模型的干预作用,筛选出四株(SD-H9、WX-94、SD-L8和SS-9)具有抑制模型细胞分泌炎性细胞因子的潜在益生菌,并且通过检测菌株的胃肠道耐受能力、粘附能力、抑菌能力和抗生素耐受性发现,SS-9的整体胃肠道耐受能力最好,SD-L8的粘附能力最强,SD-H9对13种抗生素的敏感性均在安全范围内,并且四株菌对指示菌都有抑制作用。因此以上四株菌可作为具有抗炎能力的潜在后选菌株,后续还需要进行动物试验和临床试验来进一步验证菌株在体内的功效。
