响应面法优化棘托竹荪孢子多糖提取工艺及抗氧化活性研究
2020-05-21,*
,*
(1.福建省农业科学院土壤肥料研究所,福建福州 350013; 2.邵武市沿山镇农技站,福建邵武 354002)
棘托竹荪(Dictyophoraechinovolvata)为鬼笔科(Phallaceae)竹荪属(Dictyophora)名贵食用菌,主产区为福建、四川、湖南等地,其香味浓郁,滋味鲜美,营养丰富,具有滋补强壮、宁神健体、益气补脑、润肺止咳、补气养阴及清热利湿等功效[1]。竹荪成熟子实体可分为菌体(菌柄和菌裙)、菌盖(附着孢体)以及菌托(外皮和胶质)三大部分[2],其中棘托竹荪孢子与菌体部分干重比约为1∶3,数据表明,以福建省年产竹荪0.3~0.5万吨计,每年就产有千余吨竹荪孢子[3]。但在竹荪采收过程只收集菌体部分,而菌盖及其上的孢子被直接遗弃,造成资源浪费和环境污染。食用菌加工过程产生的副产物具有极大的开发价值[4],迄今为止鲜见竹荪孢子开发利用的报道。仅有对短裙竹荪产孢组织电镜观察[5]、棘托竹荪孢子粉抗氧化活性[6]、孢子超临界萃取[3]和孢子传播[7]等报道。
研究发现竹荪多糖具有抗氧化[8-9]、抗肿瘤[10-12]、免疫调节[13-14]、抗疲劳[15]及保护肝功能[16-17]等功能。但对竹荪多糖的提取和研究主要以其菌体为主[8-11],少有报道从竹荪菌盖[18]、菌托[19]和菌丝[20]中提取多糖,未见采用竹荪孢子提取多糖及其活性的研究。王彦辉[21]检测发现破壁棘托竹荪孢子粉中粗多糖含量为8.61%,可见竹荪孢子可做为获取竹荪多糖的原料来源。
真菌多糖的分子量、糖苷键键型、空间结构和化学改性等对其生物活性有显著的影响[22]。大部分竹荪多糖提取仅以多糖得率为指标,未能兼顾提取条件对多糖活性的影响[23-24]。本研究通过单因素实验考察提取时间、提取温度、料液比、pH对多糖得率及多糖活性的影响,进而采用响应面试验方法,确定竹荪孢子活性多糖提取的最优参数,以期最大限度地从竹荪孢子中提取多糖,且不破坏多糖的抗氧化性,为分离、纯化及鉴定竹荪孢子活性多糖提供基础和依据。
1 材料与方法
1.1 材料与仪器
棘托竹荪菌球 由邵武市南山食用菌种植农民专业合作社提供;无水乙醇、苯酚、氯仿、正丁醇、硫酸、醋酸、氢氧化钠、三氯化铁、水杨酸(均为分析纯) 中国医药(集团)上海化学试剂公司。
UV-2800AH型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;DL SPW-10TJ型-5型低速大容量离心机 上海安亭科学仪器厂;R209型旋转蒸发器 上海申生科技有限公司;3-18K型低温超速离心机 Sigma公司;ALPHA1-4LD PLUS冷冻干燥机 Christ公司;WB-20恒温水浴锅 瑞士Salvis LAB;WZJ6型系列贝利微粉机 山东神爵机械设备有限公司。
1.2 实验方法
1.2.1 竹荪孢子的收集及破壁竹荪孢子的制备 新鲜的棘托竹荪菌球待其开伞后将菌盖剥离,纯水洗涤菌盖上的孢子,孢子液100目过滤,滤液4000 r/min离心20 min,将获得的沉淀冷冻干燥,使用贝利超微粉碎机,功率1.1 kW,电压380 V,粉碎时间20 min,获得破壁竹荪孢子(破壁率90%以上)。
1.2.2 竹荪孢子多糖的提取工艺 取破壁竹荪孢子按比例加去离子水,氢氧化钠和醋酸调节pH,热水浸提后4000 r/min离心20 min,取上清液60 ℃减压浓缩后加入4倍体积95%乙醇,静置过夜沉淀,采用低温超速离心机10000 r/min离心获取沉淀,加入去离子水溶解,Sevage法除蛋白,再次醇沉、低温冷冻干燥获得粗多糖。
1.2.3 单因素实验 考察提取温度、提取pH、料液比和提取时间对多糖得率和多糖活性的影响。基础条件[6,23-24]为料液比1∶20、pH7、提取温度70 ℃、提取时间90 min的条件下,设计各因素水平为:料液比1∶10、1∶15、1∶20、1∶25、1∶30;pH3、5、7、9、11;提取温度50、60、70、80、90 ℃;提取时间30、60、90、120、150 min。
1.2.4 响应面试验 在单因素实验结果的基础上,选择提取温度、提取时间、液料比和pH比4个因素为自变量,以竹荪孢子多糖提取率为响应值,依据Box-Benhnken中心组合试验原理设计4因素3水平响应面法试验优化竹荪菌托多糖提取工艺,以-1、0、1编码自变量低、中、高水平,因素水平编码见表1。

表1 响应面试验因素水平Table 1 Factors and levels of response surface experiment
1.2.5 竹荪孢子多糖得率的测定 按照苯酚-硫酸法测定孢子多糖,计算孢子多糖得率。分别取0.1 mg/mL葡萄糖标准溶液0.00、0.20、0.40、0.60、0.80、1.00 mL,加水至1.0 mL后,加入1 mL苯酚溶液、5 mL浓硫酸,充分混合,置于30 ℃水浴反应20 min后,于490 nm下测定吸光度,并以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。待测多糖溶液稀释20倍,取1.00 mL于具塞比色杯中,按标准曲线方法测定吸光度。按标准曲线方程y=8.8443x+0.0586,R2=0.9985,计算孢子多糖质量。
多糖得率(%)=(多糖质量/所用孢子粉质量)×100
1.2.6 竹荪孢子多糖清除羟基自由基(·OH)活性测定 研究发现竹荪多糖抗氧化实验模型中,多糖对羟基自由基清除效果较好[15,25]。因此本实验参考Smironff等[26]的方法,以清除羟基自由基(·OH)的IC50检测多糖活性。在25 mL的比色管中依次移取2 mL 6 mmol/L的FeSO4和2 mL的6 mmol/L水杨酸-乙醇溶液,混合均匀后加入2 mL不同浓度(2、4、6、8、10 mg/mL)的样品摇匀,再加入2 mL 6 mmol/L H2O2启动Fenton反应,在36~37 ℃的恒温水浴 30 min后在分光光度计上(510 nm)测其吸光度值(Ax);取2 mL H2O代替2 mL 6 mmol/L H2O2,测其吸光度值(As);取2 mL H2O代替不同浓度的样品,测其吸光度值(Ao)。每个样品每个浓度重复3次,取平均值。清除率R(%)按下式计算:
式中:Ax为加样品的吸光度;As为样品本底的吸光度;Ao为不加样品的吸光度。
1.3 数据处理
采用Excel 2007软件对实验数据进行处理;用SPSS 19.0软件对实验数据进行显著性分析和计算孢子多糖清除羟基自由基的IC50。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取温度对竹荪孢子多糖得率及抗氧化性的影响 由图1可见,随着提取温度的升高,多糖得率呈现先升高后降低的趋势。提取温度由50 ℃升高至60 ℃时,多糖得率显著升高(P<0.05),提取温度为60~90 ℃时,多糖得率呈现先升高后降低的趋势,但无显著性变化(P>0.05),在提取温度为80 ℃时,多糖得率最大,为9.19%。推测温度较高时多糖结构受破坏导致得率下降。多糖抗氧化活性随提取温度的升高而下降,50 ℃提取的多糖与高于80 ℃提取的多糖相比活性更高,达差异显著水平(P<0.05),60~90 ℃提取的多糖抗氧化活性无显著性差异(P>0.05)。由于提取温度较高,导致提取获得无抗氧化活性的多糖成分较多,即同等单位浓度下,高温提取的多糖活性较低温提取的活性更低。综合考虑,选择60、70、80 ℃进行后续实验。

图1 提取温度对竹荪孢子多糖得率及活性的影响Fig.1 Effect of extraction temperature of polysaccharidesfrom the spores of Dictyophora echinovolvata注:数据为3次重复的平均值,小写字母代表差异显著(P<0.05),图2~图4同。

图4 pH对竹荪孢子多糖得率及活性的影响Fig.4 Effect of pH value of polysaccharidesfrom the spores of Dictyophora echinovolvata
2.1.2 提取时间对多糖得率及多糖活性的影响 由图2可见,多糖得率随提取时间的延长而增加,但提取时间为150 min时的多糖得率与120 min时相比无显著性变化(P>0.05),原因可能是提取一定时间后,细胞膜内外的渗透浓度逐渐相等,多糖含量不再明显增加;对不同提取时间多糖活性的检测发现,在150 min内,提取时间对多糖活性影响不显著(P>0.05)。综合考虑选择60、90、120 min进行后续实验。
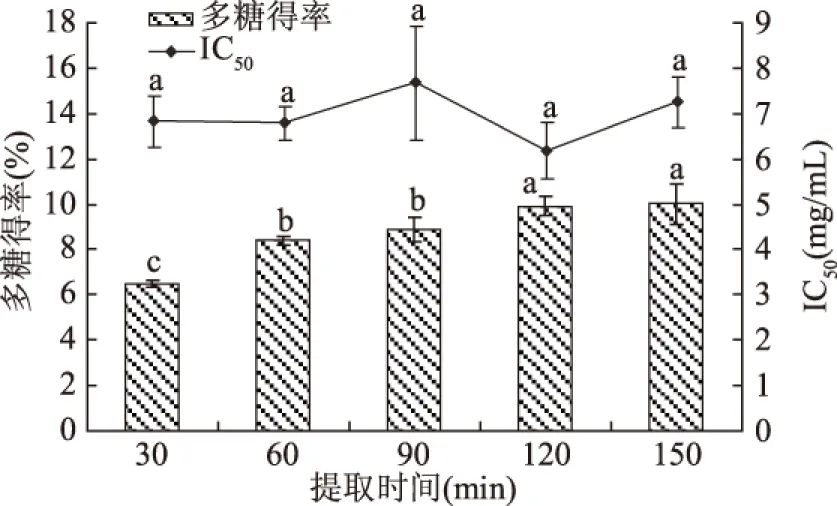
图2 提取时间对竹荪孢子多糖得率及活性的影响Fig.2 Effect of extraction time of polysaccharidesfrom the spores of Dictyophora echinovolvata
2.1.3 料液比对多糖得率及多糖活性的影响 由图3可见,料液比1∶10~1∶25间,多糖得率随加水量的增加而增加,按料液比1∶25提取时与料液比1∶10多糖率相比差异达显著性水平(P<0.05),但料液比在1∶20后,多糖提取率增长趋于缓慢。出现这种趋势的原因可能是对于一定量的破壁竹荪孢子粉,溶剂用量的增加可以增加固液接触面积和质量浓度差,有利于扩散速度的提高。当提取液用量继续增大,固液质量浓度差的增幅逐渐降低,多糖提取率的增加也趋于平缓。多糖活性随加水量的增加而略有下降,按料液比1∶25、1∶30提取时与料液比1∶15多糖活性相比活性更低,差异达显著水平(P<0.05),推测主要原因为溶剂用量较高时,提取获得的无活性多糖增加,导致单位浓度的多糖活性降低。综合考虑选择1∶15、1∶20、1∶25进行后续实验。

图3 料液比对竹荪孢子多糖得率及活性的影响Fig.3 Effect of solid-to-water ratio ofpolysaccharides from the spores of Dictyophora echinovolvata
2.1.4 pH对多糖得率及多糖活性的影响 结果如图4所示,多糖得率随pH的增加而增加,pH11条件下多糖得率与酸性条件下相比显著升高(P<0.05),但在pH9以下提取多糖得率无显著性变化(P>0.05),糖有酸性、中性及碱性之分,提取液的pH直接影响到带电状态,进而影响溶解度,因此在不同pH条件下,乙醇沉淀多糖得率也有所不同。竹荪孢子多糖在偏碱条件下得率更高,推测在碱性条件下多糖溶解度更高所致。对多糖活性的检测发现,强酸强碱条件下提取的多糖与pH5~9间的提取的多糖活性相比显著降低(P>0.05),强酸条件下活性多糖结构易被破坏而失活,而强碱条件下则可能提取得到更多无活性多糖。因此虽然在pH11条件下提取多糖得率最高,综合考虑选择pH5、7、9进行后续实验。
2.2 响应面试验结果
响应面Box-Behnken 试验设计及结果如表2所示。

表2 响应面试验设计和结果 Table 2 The design and results of response surface experiment
采用响应面软件Design Expert 8.0对表2试验数据进行多元回归拟合,得到的分析结果见表3。经回归拟合后,各影响因子对响应值的影响可用以下的方程表示:多糖得率(%)=8.08+0.17A+0.94B+1.39C-0.46D+0.11AB-0.44AC-0.14AD+0.15BC-0.86BD+0.49CD-0.10A2-0.28B2+0.24C2-0.70D2。回归模型P<0.0001,表明回归模型达极显著水平;失拟项P=0.0594,不显著,说明该模型成立。回归模型中一次项B(提取时间)和C(pH)、D(料液比)、二次项D2和交互项BD的影响极显著(P<0.01)。复决定系数R2=0.9327,说明响应值的变化有93.27%来源于所选变量,得到模型拟合程度好,实验误差小。综上分析,该模型能较好地分析和预测竹荪孢子提取工艺。

表3 回归方程的方差分析表Table 3 Analysis of variance table of regression equation
2.3 因素间的交互作用
提取温度与提取时间的交互作用如图5所示,当提取温度不变时,随着提取时间延长多糖得率呈现出增加的趋势;当提取时间较短时,多糖得率随提取温度升高增加不明显,而长时间提取条件下,多糖得率随温度升高而增加。因此,延长提取时间有利于竹荪多糖的提取。提取温度与pH间的交互作用如图6所示,当提取温度不变时,多糖得率随着pH增加而增加;在较强碱性条件下,多糖得率随温度升高而下降。可见较低温度及偏碱性条件有利于多糖提取。 提取温度与料液比间的交互作用如图7所示,当提取温度不变时,料液比对多糖得率的影响明显,随着溶剂的增加有先增后平缓的趋势;在不同料液比条件下,提取温度对多糖得率影响均不大。提取时间与pH的交互作用如图8所示,相同提取时间条件下,多糖得率均是随pH增加而增加;延长提取时间均可提高多糖得率,在偏碱条件下对多糖得率提高的影响更明显。pH与料液比的交互作用如图9所示,相同料液比条件下,多糖得率均随pH增加而增加,溶剂较少的条件下增加明显。同一pH条件下,料液比对多糖得率有先增后降的趋势。
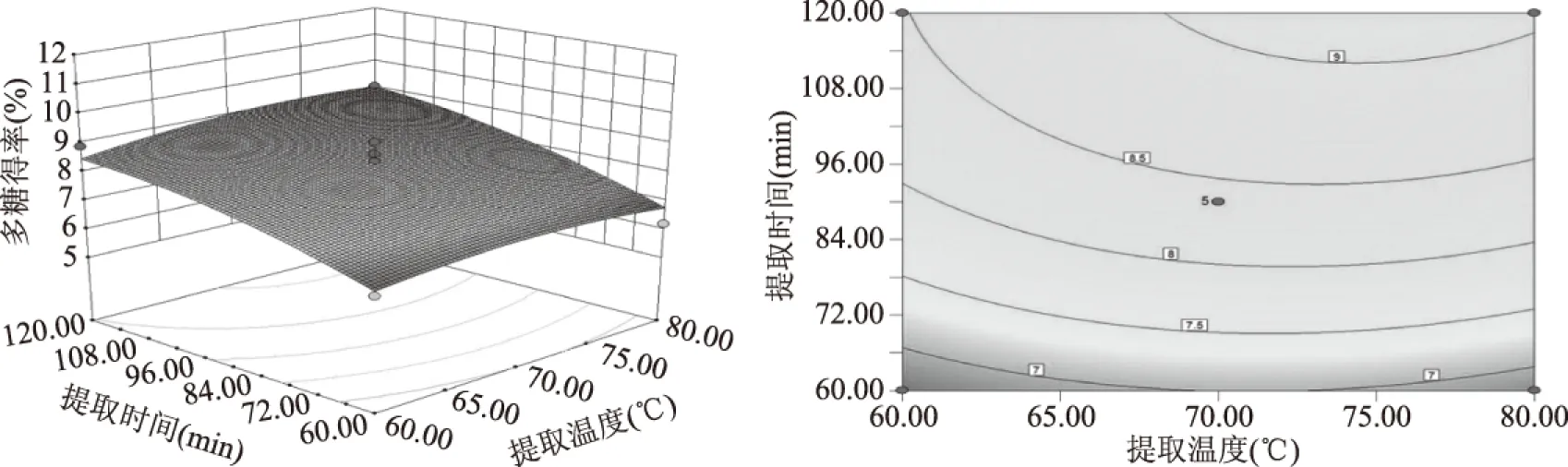
图5 提取温度与提取时间对多糖得率交互作用影响的响应面和等高线图Fig.5 Response surface plot and contour plot of extraction temperatureand extraction time and their interactions on polysaccharide content

图6 提取温度与pH对多糖得率交互作用影响的响应面和等高线图Fig.6 Response surface plot and contour plot of extraction temperature and pH and their interactions on polysaccharide content

图7 提取温度与料液比对多糖得率交互作用影响的响应面和等高线图Fig.7 Response surface plot and contour plot of extraction temperatureand solid-to-water ratio and their interactions on polysaccharide content

图8 提取时间与pH对多糖得率交互作用影响的响应面和等高线图Fig.8 Response surface plot and contour plot of extraction time and pH and their interactions on polysaccharide content
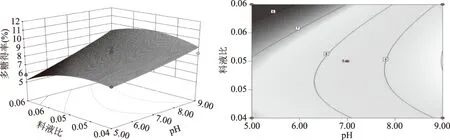
图9 pH与料液比对多糖得率交互作用影响的响应面和等高线图Fig.9 Response surface plot and contour plot of pH and solid-to-water ratio and their interactions on polysaccharide content
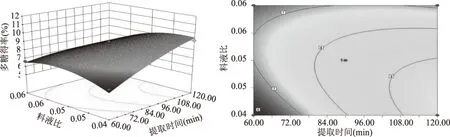
图10 提取时间与料液比对多糖得率交互作用影响的响应面和等高线图Fig.10 Response surface plot and contour plot of extraction timeand solid-to-water ratio and their interactions on polysaccharide content
响应面分析的等高线图可直观地反映各因素对响应值的影响及最佳参数和各参数之间的相互作用,圆形表示两因素交互作用不显著,而椭圆形与之相反。提取时间和料液比的交互作用极显著,且提取时间轴向等高线变化密集,料液比轴向等高线变化相对稀疏,在长时间提取条件下,料液比对多糖得率的影响明显,随着溶剂的增加而增加;但在较短提取时间条件下,随溶剂的增加多糖得率有先增后降的趋势。
2.4 竹荪孢子多糖提取工艺条件的确定
结合回归模型的数学分析,得到竹荪孢子多糖提取的最适工艺条件为:提取温度为70 ℃、提取时间120 min、pH=9.0、料液比为1∶20,多糖得率达到10.53%。采用上述最优工艺条件进行多糖提取的实验,以进一步检验该实验方法的可靠性。重复实验3次,测得实际多糖得率为9.87%,验证实验结果与理论预测值误差在1%以内。因此,采用响应面分析方法优化得到的最优工艺条件具有实际意义与实用价值。
2.5 优化后竹荪孢子多糖的清除羟基自由基活性
取优化条件后提取获得竹荪孢子多糖,检测其清除羟基自由基活性,结果如图11所示。在2~10 mg/mL范围内,孢子多糖对羟基自由基的清除率随浓度增加而增加,采用SPSS软件计算获得IC50为4.67 mg/mL。

图11 竹荪孢子多糖对·OH的清除率Fig.11 ·OH radical-scavenging activity of polysaccharidesfrom the spores of Dictyophora echinovolvata
3 讨论与结论
关于竹荪多糖提取工艺已有较多报道,主要围绕提取温度、提取时间和料液比等因素进行优化。其中料液比及提取时间各研究结果差异不大,料液比为1∶15~1∶40之间[19,27],提取时间2~4 h[19,24],而提取温度结果差异较大,60[27]、80[25]、8518]、95 ℃[28]均有报道。本实验发现,提取温度50~80 ℃间,多糖得率随温度升高而增加,90 ℃时略有下降。但温度较高时,多糖活性明显降低。可见高温虽然可提高多糖得率,但对多糖活性有一定的负面影响,以提取活性多糖为目标时,应尽可能选择较低温度。料液比和提取时间均对多糖得率有正向影响,随提取时间的延长和溶剂增加,多糖得率都有提高,但提取时间高于120 min后多糖得率增加不明显,料液比1∶20后增加溶剂对得率增高影响不大,且降低了多糖活性,推测是由于杂多糖含量的增加。在多糖提取过程中,在酸性条件下可能引起多糖中糖苷键的断裂;而碱性条件有利于酸性多糖的浸出,可提高多糖的得率,但提取液中含有其它杂质或无活性多糖。本文发现偏碱条件有利于多糖提取,但强酸强碱条件下获得多糖活性较低。
综上所述,竹荪孢子多糖具有抗氧化活性,提取工艺条件的变化不仅影响多糖得率,也影响多糖活性。竹荪孢子多糖的最优提取工艺条件为:提取温度为70 ℃、提取时间120 min、pH=9.0、料液比为1∶20,测得实际多糖得率为9.87%,并测得竹荪孢子多糖清除羟基自由的IC50为4.67 mg/mL,为下一步分离、纯化及鉴定竹荪孢子活性多糖提供基础。
