麦冬皂苷B通过抑制PI3K/Akt/mTOR通路诱导人黑色素瘤A375细胞凋亡
2020-05-21胡惠清李静方坤卢彩红刘斌
胡惠清,李静,方坤,卢彩红,刘斌
(武汉市第九医院,湖北 武汉438000)
黑色素瘤(Melanoma)是一种来源于黑色素细胞或黑色素前体细胞的恶性肿瘤,常见于皮肤,但也可见于黏膜,是人类皮肤癌中恶性程度最高的肿瘤之一[1]。黑色素瘤恶性程度高,易转移,预后差[2]。PI3K/Akt/mTOR信号通路广泛参与调控细胞的增殖、凋亡和细胞周期等生理病理活动。该通路在人黑色素瘤的发生发展中扮演重要角色。因此,抑制该通路可能成为治疗黑色素瘤的有效手段[3]。最近的研究表明,麦冬有效成分麦冬皂苷B对多种肿瘤细胞增殖有抑制作用[4-5]。本研究以人黑色素瘤细胞系A375为实验材料,探讨麦冬皂苷B抑制黑色素瘤细胞增殖的分子机制,观察麦冬皂苷B对A375细胞增殖,凋亡和细胞周期的影响。
1 材料与方法
1.1 实验材料 麦冬皂苷B粉剂(四川省维克奇生物科技有限公司生产,批号38971-41-4),用二甲亚砜溶解,用改良杜氏伊格尔培养基(DMEM)培养基稀释,DMSO终体积分数≤0.01%;人黑色素瘤细胞A375(中国科学院细胞库);100 U/L青霉素和100 μg/L链霉素、细胞计数试剂盒CCK-8(武汉博士德生物公司);胎牛血清购自Gibco公司;Annexin V-FITC/PI凋亡检测试剂盒购自BD Biosciences公司;β-actin抗体、PI3K 抗体,p-PI3K 抗体,Akt抗体,p-Akt抗体,mTOR 抗体,p-mTOR 抗体、Bax、Bcl-2、Cleaved-caspase3、Cyclin D1 抗体购自 CST公司;2抗均购自北京中杉金桥生物技术有限公司。化学发光检测试剂盒购自美国Thermo公司。
1.2 方法
1.2.1 细胞培养 取人黑色素瘤A375细胞,用含10%胎牛血清、青霉素(100 U/mL)及链霉素(100 mg/L)的DMEM培养液,于37℃、5%CO2下培养,胰酶消化传代。取对数生长期细胞进行试验。由健康男性包皮中提取黑色素细胞[6],在M254培养基(含HMGS)中培养,钙离子结合蛋白S100免疫组化染色证实纯度超过95%。
1.2.2 CCK-8法检测麦冬皂苷B对正常黑色素细胞增殖的影响 将对数生长期正常黑色素细胞消化后,按5×104/孔接种于 96孔板中,培养 24 h,实验分为只含有培养基和CCK-8的空白组、终浓度分别为 0(溶剂对照组)、5、10、20、40、60 μmol/L 麦冬皂苷B组,每组6孔,培养48 h后,加入CCK-8 10 μL,待培养液显色后,用酶标仪测各孔450 nm波长的吸光度A值,以细胞的存活率表示细胞的增殖程度。细胞的存活率(%)=[(A1-A3)/(A2-A3)]×100%。A1:试验组;A2:对照组;A3:只含有培养基和CCK-8空白组。
1.2.3 CCK-8法检测麦冬皂苷B对A375细胞增殖的影响 将对数生长期A375细胞消化后于96孔板中培养 24h,实验分为 0(对照组)、5、10、20 μmol/L麦冬皂苷B组,各组培养48h后,加入CCK-810μL,待培养液显色,用酶标仪测各孔450nm波长的A值。
1.2.4 细胞凋亡的检测 取对数生长期A375细胞,按5×104/L置于细胞培养瓶内,每瓶加细胞悬液2mL,培养 24 h,实验分为 0(对照组)、5、10、20 μmol/L麦冬皂苷 B组、20 μmol/L麦冬皂苷B+20 mg/L胰岛素样生长因子(IGF)-1,孵育48 h,收集细胞,1 000转/min离心弃上清液,磷酸盐缓冲液(PBS)洗涤,收集细胞,在冰浴中避光进行如下操作:用试剂盒中结合缓冲液悬浮细胞,调整细胞浓度为5.0×104/L,加入Annexin-FITC和PI染色液,混匀后孵育15min,于1 h内用流式细胞仪检测细胞凋亡。
1.2.5 流式细胞仪检测A375细胞周期变化 取对数生长期细胞,调整细胞浓度至5.0×104/L,接种于6孔板,培养24 h,实验分组同方法3,培养48 h,消化,1 000转/min离心,弃上清液,预冷PBS重悬细胞,离心洗涤3次,用体积分数为70%的乙醇4℃固定过夜。测定前用PBS洗去乙醇,加入含有核糖核酸酶RNase的0.05%PI染色液,避光染色30 min后,上流式细胞仪分析细胞脱氧核糖核酸(DNA)含量的变化。
1.2.6 免疫印迹实验 实验分组同1.2.4,细胞经不同剂量麦冬皂苷B处理24h后,进行免疫印迹分析。各组细胞经PBS洗涤2次后,用预冷的蛋白裂解液冰上裂解30 min,然后4℃12 000转/min离心20 min,收集上清并用BCA法定量。经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将凝胶上的蛋白质电转至硝酸纤维素膜上;再用5%脱脂奶粉封闭过夜,加入Ⅰ抗,室温孵育3 h后加入Ⅱ抗,最后化学发光液曝光显影。实验重复3次。
1.3 统计学处理 采用SPSS 23.0统计软件分析,数据用均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析,组间两两比较应用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 麦冬皂苷B对正常黑色素细胞增殖的影响 与对照组(麦冬皂苷B浓度0 μg/mL)比较[存活率为(99.08±0.89)%],5、10、20 μmol/L mg/L 麦冬皂苷 B组[存活率分别为(98.67±0.59)%、(98.43±1.17)%、(98.06±1.06)%]对正常黑色素细胞存活率无明显影响(F=1.21,P>0.05)。当麦冬皂苷B浓度为40,60 μmol/L时,比较对照组,细胞存活率显著下降(F=65.67,P<0.01),存活率分别为(85.24±3.427)%、(75.33±5.15)%。因此选定麦冬皂苷B的工作浓度为5、10、20μmol/L 。
2.2 麦冬皂苷B对A375细胞增殖的影响 对照组(麦冬皂苷 B 浓度 0 mg/L)和 5、10、20 μmol/L 麦冬皂苷B组细胞存活率分别为(97.34±8.12)%、(69.27±6.78)%、(57.91±6.87)%、(42.70±5.54)%,随着麦冬皂苷B浓度增加,细胞存活率下降,且呈浓度依赖性,组间差异均有统计学意义(F=67.41,P<0.01;P<0.05)。
2.3 麦冬皂苷B抑制了PI3K/Akt/mTOR信号通路的活化 免疫印迹结果显示经麦冬皂苷B处理24 h后,细胞内PI3K、Akt、mTOR的磷酸化水平受到明显抑制,且抑制作用呈剂量依赖性(F=40.42,P<0.01;F=51.23,P<0.01;F=31.82,P<0.01)。细胞内总 PI3K,Akt,mTOR 的表达量无明显变化(F=0.72,P<0.01;F=0.90,P<0.01;F=0.20,P<0.01)。但加用 20 mg/L IGF-1处理后,与20 μmol/L麦冬皂苷B组比较,A375细胞内PI3K/Akt/mTOR信号通路明显活化(q=4.52,P<0.05;q=7.63,P<0.01;q=3.11,P<0.05),见图1。
2.4 麦冬皂苷B通过抑制PI3K/Akt/mTOR信号通路诱导A375细胞凋亡和阻滞细胞周期AnnexinV/PI双染法结果显示,用不同浓度麦冬皂苷 B(终浓度分别为 5、10、20 μmol/L)处理 A375 细胞48 h后,细胞总凋亡率分别为(13.39±1.48)%、(24.38±2.44)%、(36.87±2.03)%,与对照组(3.87±0.56)%相比,呈明显浓度依赖性,组间差异均有统计学意义(F=386.38,P<0.01;P<0.05),加用 20 mg/L IGF-1处理后,细胞总凋亡率为(14.63±2.44)%,较20 μmol/L麦冬皂苷 B组明显降低(q=28.31,P<0.01)。与对照组相比,5、10、20 μmol/L 麦冬皂苷 B组A375细胞G0/G1期细胞比例差异均有统计学意义(F=56.14,P<0.01)。对照组细胞 G0/G1期比例低于5 μmol/L麦冬皂苷B组、5 μmol/L麦冬皂苷B组低于10 μmol/L麦冬皂苷B组、10 μmol/L麦冬皂苷B组低于20 μmol/L麦冬皂苷B组,差异有统计学意义(q 值分别为 4.10、3.97、9.45,P<0.05)。而 IGF-1 处理抑制了麦冬皂苷B的上述效应(q=28.31,P<0.01)。见图2。
2.5 麦冬皂苷B通过抑制PI3K/Akt/mTOR信号通路对凋亡相关蛋白的影响 经Hoechst染色后,对照组中的A375细胞大而饱满,呈均匀蓝色荧光;在麦冬皂苷B处理组中细胞核可见浓染致密的颗粒荧光,细胞缩小;随麦冬皂苷B浓度的增加,细胞出现典型的凋亡形态,高倍镜下可观察到细胞变小,胞核皱缩、碎裂,染色质浓缩,聚集在核膜边缘,形成染色质边集。见图3A。
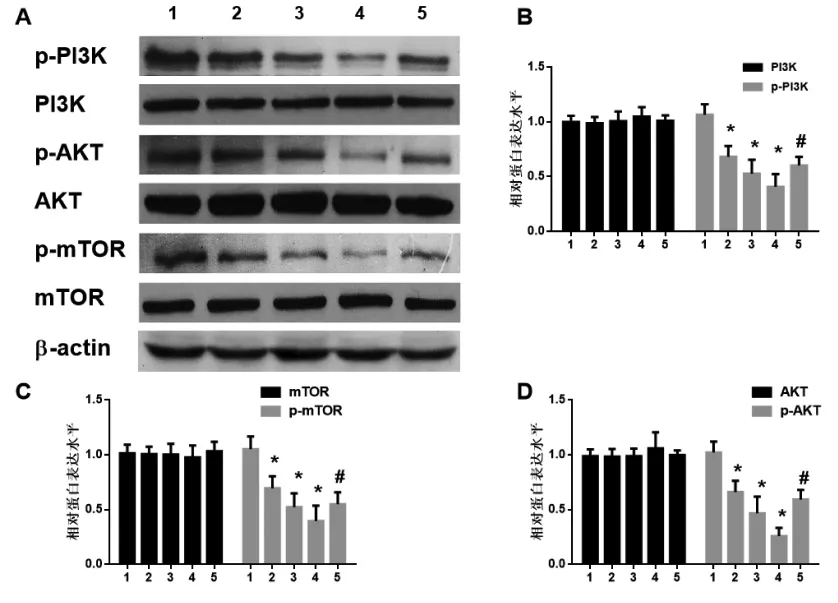
图1 麦冬皂苷B对A375细胞PI3K/Akt/mTOR信号通路的影响
5、10、20μmol/L麦冬皂苷B组与对照组A375细胞Bcl-2的表达组间差异有统计学意义(F=185.155,P<0.01),对照组高于 5 μmol/L 组、5 μmol/L 组高于10 μmol/L 组、10 μmol/L 组高于20 μmol/L组(q值分别为 6.7945、14.5883、8.5598,P<0.05),加用 20 mg/L IGF-1处理后,A375细胞Bcl-2的表达较20 μmol/L麦冬皂苷 B 组明显降低(q=8.936 85,P<0.01);Bax的表达组间差异有统计学意义(F=102.508,P<0.01),对照组低于 5 μmol/L 组、5 μmol/L 组低于 10 μmol/L组、10 μmol/L 组低于 20 μmol/L组(q值分别为5.177、10.303、7.041,P<0.05),加用 20 mg/L IGF-1处理后,A375细胞Bax的表达较20 μmol/L麦冬皂苷B组明显降低(q=20.519 2,P<0.01)。Cleaved-caspase3 的组间差异有统计学意义(F=131.635,P<0.01),对照组低于 5 μmol/L 组、5 μmol/L 组低于 10 μmol/L 组、10μmol/L组低于20μmol/L组(q值分别为13.1086、3.999 8、10.654 9,P<0.05),加用20 mg/L IGF-1 处理后,A375细胞Cleaved-caspase3的表达较20 μmol/L麦冬皂苷 B 组明显降低(q=23.078 7,P<0.01)。见图 3B、C。
3 讨论
黑色素瘤的发病率和死亡率很高,已被证明占皮肤癌死亡例数的85%以上,在世界范围内造成严重的社会经济问题[7]。近年来,恶性黑色素瘤的发病率一直在上升,年增长率为3%~7%[8]。早期黑色素瘤可通过手术切除治愈,但转移性黑色素瘤在扩散的情况下可抵抗放疗和化疗,导致晚期患者的高死亡率。因此,有必要寻找新的治疗靶点和策略来有效阻止黑色素瘤的进展和转移。
近年来,越来越多的证据表明,多种中药及其生物活性成分有抗肿瘤作用,是一种新的肿瘤治疗策略[9]。几十年来,麦冬的药理研究一直广泛地关注其在心血管疾病防治中的作用。然而,最近的一项研究表明,麦冬皂苷B是从麦冬中分离出的一种皂苷化合物,能剂量依赖性地提高非小细胞肺癌细胞的增强细胞自噬和凋亡,阻滞细胞周期,有抗肿瘤作用[4]。此外,麦冬皂苷B还可以通过促进JNK1/2和ERK1/2途径的磷酸化来降低线粒体膜电位和增强活性氧,从而增强SGC-7901人胃癌细胞的凋亡[5]。

图2 麦冬皂苷B通过抑制PI3K/Akt/mTOR信号通路诱导A375细胞凋亡并阻滞细胞周期。
本研究表明,麦冬皂苷B在所选浓度内处理正常人黑色素细胞对细胞的增殖无影响,而对A375细胞增殖有明显抑制作用。随着促凋亡蛋白的增加和抗凋亡蛋白的减少,麦冬皂苷B剂量依赖性地促进了A375细胞的凋亡。众所周知,Bcl-2和Bax是参与线粒体依赖性凋亡途径的2个重要调控因子,而Caspase-3作为一种关键蛋白酶在细胞凋亡的执行阶段起着关键作用[10]。在细胞凋亡过程中,凋亡前蛋白Bax在死亡信号的作用下升高,形成Bax/Bax凋亡前同二聚体,这也可以促进细胞色素C的释放和Caspase-9的活化,从而导致Caspase-3的活化[11-12]。相反,Bcl-2过表达,通过与Bax形成异二聚体发挥抗凋亡作用,可能中和Bax的促凋亡活性,抑制细胞凋亡[13-15]。此外,笔者的研究显示麦冬皂苷B通过在G0/G1阶段诱导细胞周期停止和阻止细胞进入S阶段抑制黑色素瘤细胞的生长。细胞增殖调控存在2个重要调控点即G1/S期和G2/M期,当正向调节因子积累到越过G1/S期临界点的浓度水平,细胞就会按照一定的顺序完成整个周期,所以G1/S期是细胞周期的重要节点[16];Cyclin D1是G1/S调控点的关键因子之一[17]。麦冬皂苷B处理细胞后,Cyclin D1的表达明显下降。Chen等[18]结果表明,不同浓度的OPB能抑制PI3K/AKT/mTOR通路的激活,并在G0/G1期引起细胞周期停滞,从而减缓NSCLC NCI-H157和NCI-H460细胞的生长,与本文研究结果相似。
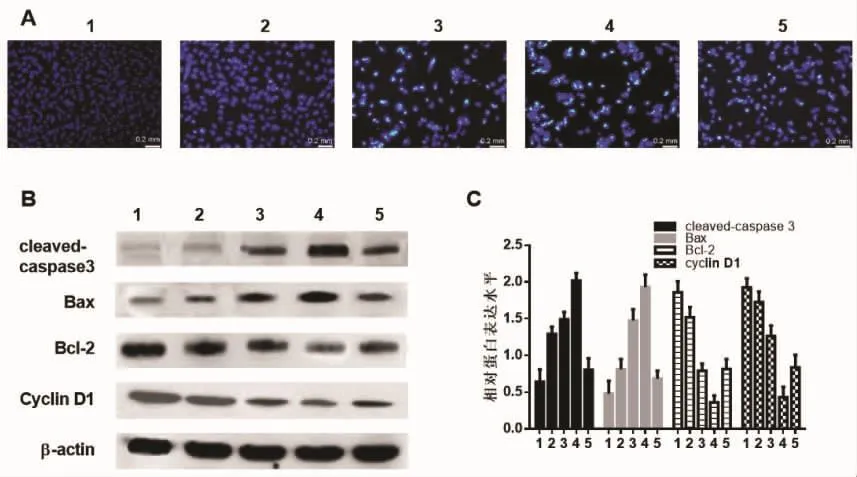
图3 麦冬皂苷B通过抑制PI3K/Akt/mTOR信号通路调节A375细胞凋亡相关蛋白的表达
PI3K/Akt/mTOR信号通路广泛存在于细胞中,在细胞周期和凋亡中扮演重要角色。研究发现,PI3K/Akt/mTOR信号途径在人黑色素瘤中过度活化,提示该通路与人黑色素瘤的发生发展关系密切[3],mTOR活化并磷酸化4E-BP1,参与形成eIF4F复合物,启动翻译并编码细胞周期调节蛋白[19]。本研究发现麦冬皂苷B可抑制A375细胞中PI3K、Akt、mTOR的磷酸化,抑制PI3K/Akt/mTOR通路的活化,促进人黑色素瘤细胞凋亡,阻滞了细胞周期。当采用PI3K/Akt/mTOR通路激活剂IGF-1处理细胞后,麦冬皂苷B的上述作用被明显抑制。
总之,麦冬皂苷B能够诱导促进人黑色素瘤细胞凋亡,阻滞了细胞周期,抑制细胞增殖,本研究为人黑色素瘤的临床辅助治疗提供了新的策略。
