硅基高分散钴氧化物活化亚硫酸盐降解有机污染物的效能
2020-05-21郑怀礼肖伟龙黄文璇丁魏李关侠胡超
郑怀礼,肖伟龙,黄文璇,丁魏,李关侠,胡超
(1.重庆大学 a.环境与生态学院;b.重庆市水处理混凝剂工程技术研究中心,重庆 400045; 2.深圳准诺检测有限公司,广东 深圳 518117)
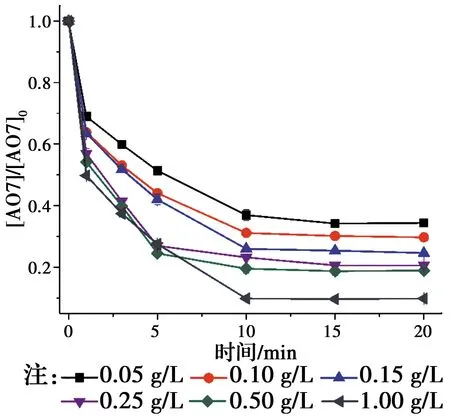
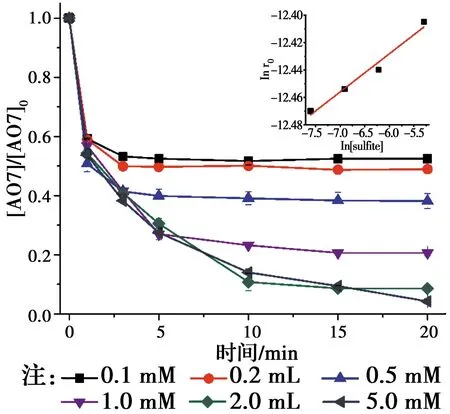
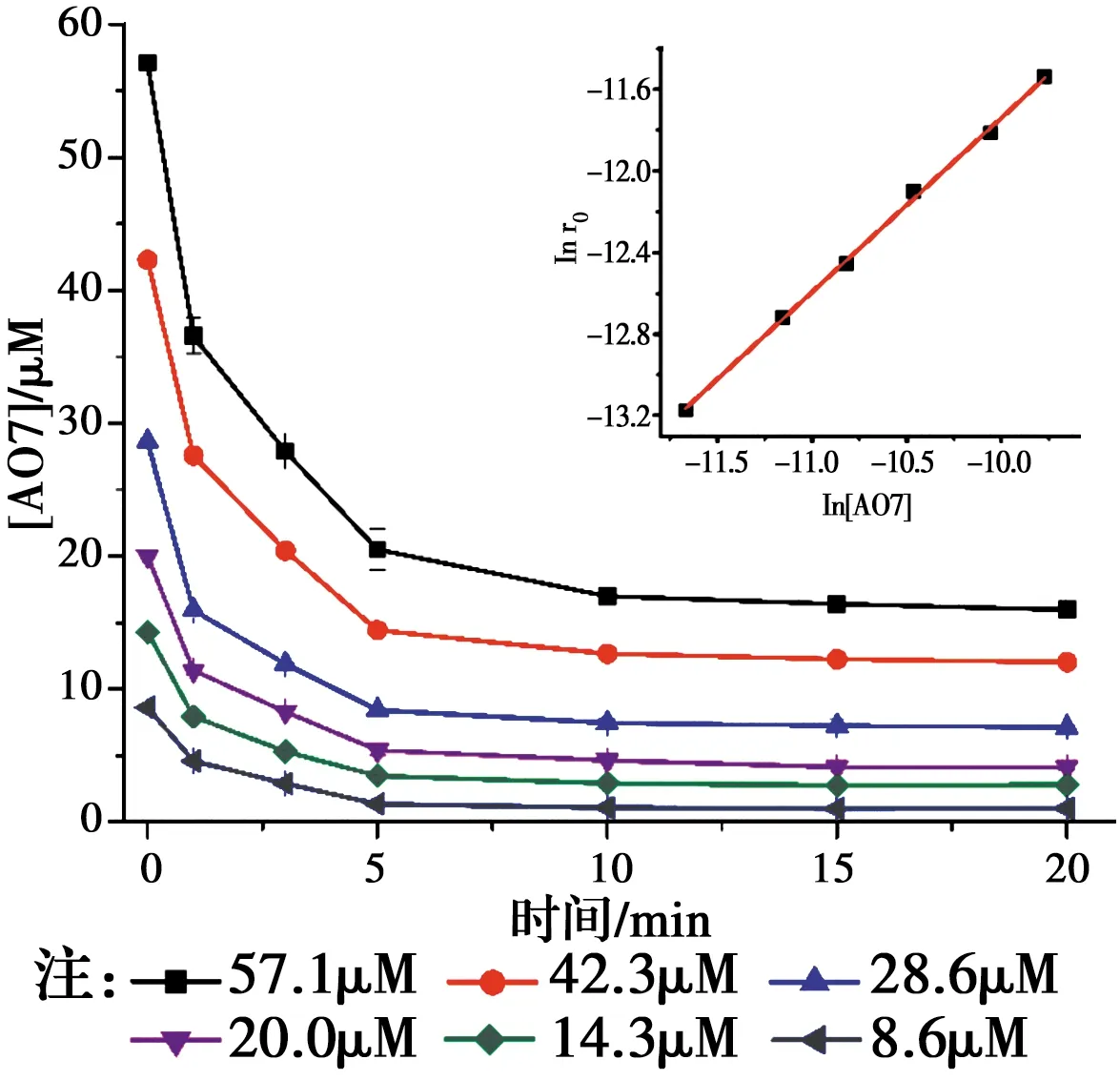
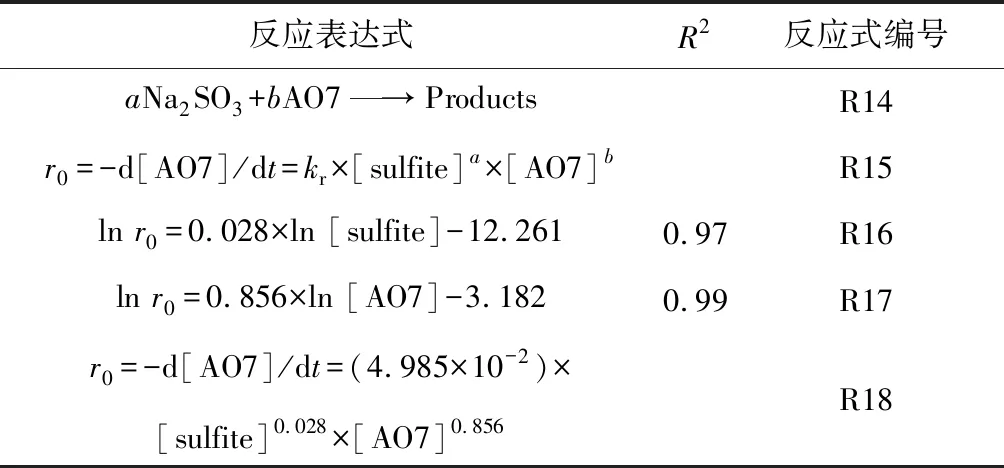
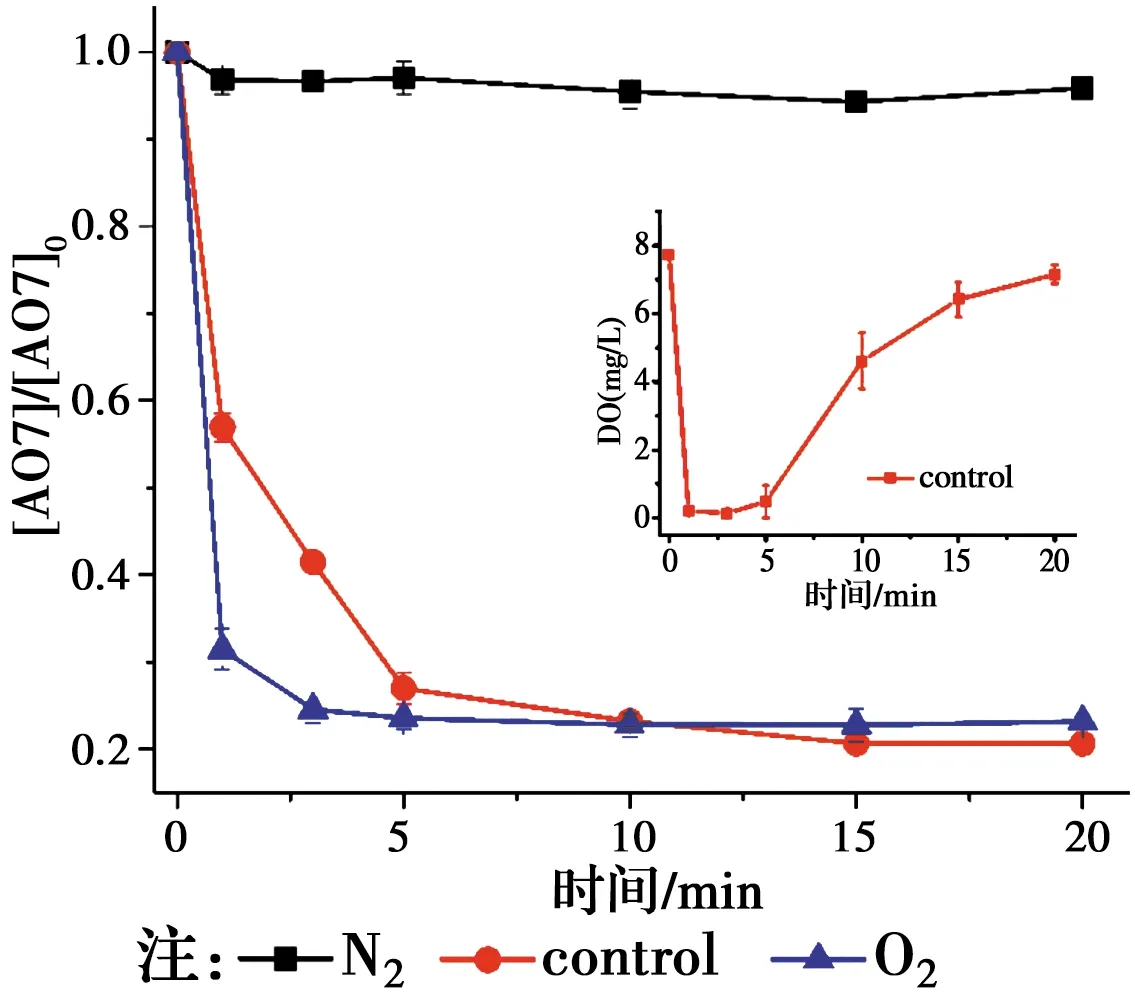
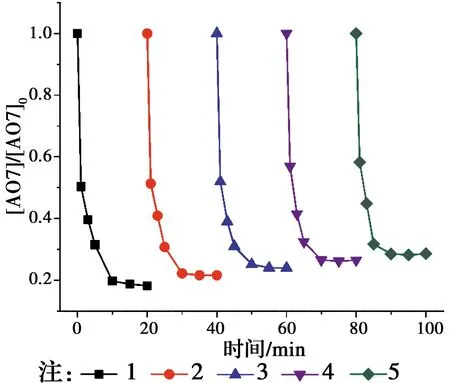
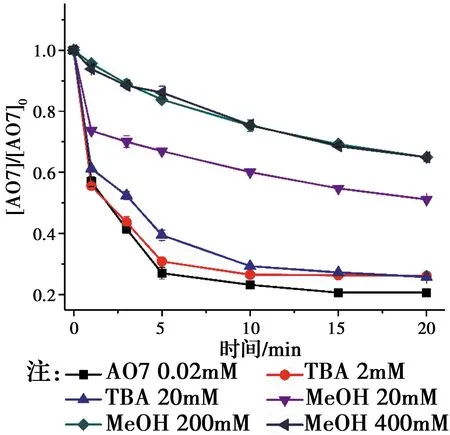
相对于传统的基于羟基自由基(HO•)的高级氧化技术,基于SO4•-自由基的高级氧化技术具有pH值适用范围更广,氧化还原电位(2.5~3.1 V)更高,作用时间更持久的优点[1-2]。近年来,生成SO4•-自由基的主要方法是使用过渡金属活化过硫酸盐(PS)和过一硫酸氢盐(PMS)[3-4]。如Jiang等[5]采用Fe2+活化PS产生SO4•-降解了双酚A,Anipsitakis等[6]研究了不同过渡金属活化PMS生成了SO4•-降解有机污染物2,4-二氯酚的效能,其活性按对有机物的效果排序:Ni2+ 实验使用的所有化学药品均为分析纯,由成都市科隆化工品有限公司提供;用于制备硅基高分散钴氧化物的二氧化硅的颗粒大小在120~180 μm范围内,由青岛邦凯高新技术材料有限公司提供;实验主要使用的仪器有ME104电子天平,TU-1901双光束紫外可见分光光度计,pHS-3C型pH计等;实验使用的水均为去离子水(18.2 MΩ cm)。 采用氨水改性吸附焙烧法制备了硅基高分散钴氧化物催化剂。制备方法:准确称取一定质量的六水硝酸钴溶于40 mL去离子水中,之后逐滴加入10 mL氨水(15 mM),迅速用硝酸调节溶液的pH值至11.0,搅拌一段时间之后,加入一定质量的二氧化硅,继续搅拌3 h,然后离心分离沉淀物,用去离子水反复冲洗,将所得的固体材料在60 ℃烘箱中烘干,过夜,最后放在马弗炉中400 ℃焙烧2 h,待温度降至室温,取出材料干燥密封保存。 实验在放置于恒温水浴锅的反应器中进行,所有实验均平行3次。首先,取一定量的CoNSi催化剂和AO7标准储备液加入装有200 mL去离子水的反应器中,持续搅拌,调节反应液的pH值。然后,加入一定量的亚硫酸钠标准储备液,开启反应,在0、1、3、5、10、15、20 min时分别取样,并立即加入至硫氰酸钾溶液中混合均匀。最后,使用分光光度计测定其吸光度。 将制备的CoNSi催化剂研磨粉碎,然后加入到一定量的乙醇溶液中超声,使之分散均匀,最后沉积在碳支持膜上,再使用场发射透射电子显微镜(FETEM)观察其微观结构,并用能量色散X射线谱(EDS)能谱仪分析CoNSi催化剂的化学成分。 利用EDS能谱仪对硅基钴氧化物催化剂的化学成分的定性、定量分析结果如图1所示,催化剂主要由Si、O、Co组成,钴与硅的原子比约为3.99∶100,表明钴成功负载到硅胶上;利用FETEM对CoNSi催化剂的微观结构进行了表征,结果如图2所示,可以看到许多直径约为3.2±0.7 nm的深色纳米颗粒均匀分散在硅胶支架上,不产生局部聚集。表明通过氨水改性吸附焙烧法能够使钴氧化物负载到硅胶上的。 图1 CoNSi催化剂的EDS谱Fig.1 The EDS spectrum of CoNSi catalyst 图2 CoNSi催化剂的TEM图Fig.2 The TEM image of CoNSi catalyst 控制反应初始的pH值为9.0,CoNSi的浓度为0.25 g/L,Na2SO3的浓度为1.0 mM,AO7的浓度为7 mg/L,温度恒定为30 ℃,转速恒定为300 r/min,考察不同体系对底物的降解效能的影响,结果见图3。当反应液中CoNSi或Na2SO3单独存在时,AO7几乎没有被降解,同时,也排除了CoNSi催化剂在该条件下吸附AO7的可能性;当反应液中Co3O4和Na2SO3同时存在时,开启反应20 min后,AO7的降解率仅为32.4%,而当反应液中CoNSi和Na2SO3同时存在时,AO7的降解率可以达到79.4%。这表明,CoNSi和Na2SO3的共同作用导致了AO7的降解,并且相比Co3O4材料,CoNSi催化剂和Na2SO3的共同作用明显提高。 图3 对照实验对AO7的降解影响Fig.3 The effect of control experiment on the 反应pH值是催化反应中的重要影响因素。研究pH值分别为4.0、6.0、8.0、9.0、10.0时CoNSi-S(IV)体系的降解效能,结果见图4。当pH值为4.0和6.0时,AO7的降解率分别为24.7%和29.8%,pH值由8.0升至9.0时,AO7的降解率由60.8%升至79.4%,然而,当pH值升至10.0时,AO7的降解率下降至54.7%。 图4 初始pH值对AO7的降解影响Fig.4 The effect of initial pH on the degradation of 此外,pH值还会影响硫氧根自由基的链式反应(反应式R5~R12)[4,13,15]。在碱性条件下,SO5•-和S(IV)的SO3-形态反应生成SO4•-的反应速率常数高达(5.5~9.0)×106M-1s-1,生成的SO4•-自由基一方面直接降解AO7,另一方面与SO3-反应生成SO3•-,完成硫氧根自由基的链式反应;在酸性条件下, SO5•-和S(IV)的HSO3-形态反应生成SO4•-的反应速率常数较碱性条件下的反应速率常数相差了2个数量级,生成SO4•-自由基显著减慢。因此,在碱性条件下快速生成的SO4•-自由基能够迅速降解AO7。并且,对初始pH值为9.0时反应过程中pH值的变化进行的记录如图4所示,发现pH值在5 min内由9.0迅速下降至8.4左右,最后达到了平衡状态时的pH值约为8.1,这个现象与AO7降解初始反应速率较快,之后速率逐渐减慢达到平衡的变化一致,说明pH值在CoNSi-S(IV)体系中存在相关影响。 表1 CoNSi-S(IV)体系中的反应式Table 1 The reaction formulas in CoNSi-S(IV) system 为了考察CoNSi催化剂的的催化活性,控制其他条件不变,改变CoNSi的投加量,分别为0.05、0.10、0.15、0.25、0.50、1.00 g/L,结果如图5所示。CoNSi的投加量由0.05 g/L升至1.00 g/L时,AO7的降解率由65.6%上升至91.2%。这可能是因为催化剂投加量的增加可以提供更多的活性位点[16],从而激活SO32-生成更多的SO4•-自由基,加速降解AO7。但是,考虑到经济成本和实际应用情况,选择CoNSi催化剂的投加量为0.25 g/L进行AO7降解的后续研究。 图5 CoNSi浓度对AO7的降解影响Fig.5 The effect ofCoNSi concentration on the degradation of AO7 固定CoNSi投加量为0.25 g/L,改变Na2SO3的投加量为0.1、0.2、0.5、1.0、2.0、5.0 mM,结果见图6。Na2SO3的投加量由0.1 mM升至5.0 mM时,AO7降解率由47.5%上升至95.8%。虽然亚硫酸盐投加量加大会升高AO7的降解效率,并且亚硫酸盐对于这种非均质CoNSi-S(IV)体系中SOx•-和HO•的生成是必要的[16],但过量的亚硫酸盐会与AO7竞争SO4•-或HO•自由基(反应式R8、R13),降低SO4•-或HO•自由基的利用率,反而造成AO7的降解效率下降。而且亚硫酸盐投加量过高,体系中溶解氧会被大量消耗(反应式R2、R3),导致SO5•-自由基的不足(反应式R5),这也是低投加量(0.5 mM)比高投加量(2.0 mM、5.0 mM)初始反应速率快的原因。综合考虑降解效率和经济成本,选择Na2SO3投加量为1.0 mM进行AO7降解的后续研究。 图6 Na2SO3浓度对AO7的降解影响Fig.6 The effect of Na2SO3 concentration on the degradation of AO7 改变底物AO7的浓度分别为8.6、14.3、20.0、28.6、42.3、57.1 μM,考察CoNSi-S(IV)体系对AO7的降解影响,见图7。当AO7的浓度从8.6 μM升高至57.1 μM时,初始反应速率从1.9 μmol/min升高到9.7 μmol/min。随着AO7浓度的增加,体系中生成活性自由基相比AO7分子的相对数量减少,AO7分子与活性自由基的接触概率降低;同时,降解反应生成的中间体也可能与AO7竞争活性自由基,造成活性自由基的相对不足[10]。 图7 AO7浓度的影响Fig.7 The effect of AO7 concentration 此外,由于经济成本和活化的高效性,控制CoNSi的投加量为0.25 g/L,反应在单纯搅拌的条件下,故产生的自由基的量主要由亚硫酸盐的投加量控制。CoNSi-S(IV)体系中AO7的降解反应式如表2所示,AO7的降解过程可表示为反应式R14,AO7降解的初始反应速率方程可表达为反应式R15[12],其中,a和b分别是亚硫酸盐和AO7的表观反应级数,r0和kr分别是初始反应速率和表观速率常数。图6中的插图显示了lnr0和ln [sulfite]的线性关系,拟合得到反应式R16,图7中的插图显示了lnr0和ln [AO7]的线性关系,拟合得到反应式R17。最后计算得到a为0.028,b为0.856,kr为4.985×10-2M-1/min,因此,反应式R15可以表示为反应式R18。 表2 AO7降解反应式Table 2 The reaction formula of AO7 degradation 曝氮气实验中,反应开始前,先通入30 min氮气以除尽反应液中的溶解氧,反应进行中,持续通入氮气以防止空气复氧;曝氧气实验中,反应开始前和反应进行中持续曝气。实验结果如图8所示,曝氮气实验中,AO7几乎没有被降解,而单纯搅拌实验中,AO7的降解率为79.4%,这说明氧气是该体系降解污染物的重要因素;曝氧气实验中,虽然初始反应速率由单纯搅拌时的3.9 μmol/min升高到5.0 μmol/min,但最后AO7的降解率相比单纯搅拌下降了3.2%。这是因为Co(II)-SO3首先需要被氧气氧化为Co(III)-SO3配合物(反应式R3),进而生成SO3•-自由基,然后需要氧气将SO3•-自由基氧化为SO5•-自由基(反应式R5),进而影响SO4•-自由基的产率,不同于单纯搅拌反应初始阶段溶解氧急剧消耗至无,曝氧气条件下,上述反应仍旧持续进行,生成更多的活性物种更快地降解AO7,但当生成SO4•-自由基的浓度过高时,会同时消耗SO32-和SO4•-自由基(反应式R8),导致最终降解率的下降。 图8 氧气对AO7的降解影响Fig.8 The effect of oxygen on the degradation of AO7 催化剂的稳定性是其实际应用中最重要的性能。因此,使用序批实验对CoNSi催化剂的稳定性进行评价十分必要。序批实验每批次向反应器中加入因对反应液取样消耗的等量去离子水、1 mL AO7标准储备液和1 mL亚硫酸钠标准储备液,并调节初始pH值为9.0;使用过的CoNSi催化剂用去离子水清洗数次,离心后易被收集,然后放在烤箱中干燥,室温下保存。实验结果如图9所示,在反应进行5次后,AO7降解率仍然达到了71.5%,这说明CoNSi催化剂具有较高的活化亚硫酸盐降解污染物的稳定性,而降解效率的下降可能是由于反应过程中二氧化碳的抑制作用,或者是生成的中间产物吸附在催化剂的表面难以清洗,导致催化剂表面的活性位点不能充分利用[17-18]。 图9 序批实验对AO7的降解影响Fig.9 The effect of sequencing batch experiment on the degradation of AO7 为了阐明CoNSi-S(IV)体系中所涉及的自由基机制,使用甲醇(MeOH)和叔丁醇(TBA)作为抑制剂来探究不同自由基在该体系中的作用。这种竞争动力学方法是基于MeOH和TBA与SO4•-自由基、HO•自由基反应的不同二阶速率常数(k(MeOH,SO4•-))=1.23×107M-1s-1,k(MeOH, HO•)=9.7×108M-1s-1,k(TBA,SO4•-)=8.5×105M-1s-1,k(TBA, HO•)=6.0×108M-1s-1)[19-21]。实验加入不同浓度的MeOH和TBA,结果见图10。当TBA的浓度(20 mM)为AO7(0.02 mM)的1 000倍时,AO7的降解率相比不添加TBA时的降解率下降了4.2%。该现象说明HO•自由基在CoNSi-S(IV)体系中对AO7的降解可能存在一定贡献,但并不是起主要作用的活性物种。然而,当MeOH作为自由基抑制剂在溶液中使用时,AO7的降解效率明显降低。当加入的MeOH浓度为400 mM时,约有34.0% AO7仍被降解,这可能与降解过程中SO5•-的参与有关,因为MeOH和SO5•-的二阶速率常数(k(MeOH,SO5•-)<103M-1s-1)较低[21],MeOH不能完全淬灭SO5•-终止反应。因此,可以得出SO4•-是该体系中主要的活性物种,SO5•-可能也会对AO7降解存在一定的贡献。 图10 不同自由基捕获剂对AO7的降解影响Fig.10 The effect of different radical scavengers on the degradation of AO7 在碱性、有氧的条件下,硅基高分散钴氧化物催化剂能够活化亚硫酸盐降解AO7,其中,pH=9.0是反应的最佳pH值,且较高的催化剂浓度和亚硫酸盐浓度可以提高AO7的降解效率。同时,序批实验证明了CoNSi催化剂材料具有良好的稳定性;不同自由基抑制实验表明了SO4•-自由基为该体系的主要活性物种,HO•自由基和SO5•-自由基对AO7的降解可能存在一定的贡献。因此,非均相CoNSi-S(IV)体系在碱性废水处理中具有潜在的工业应用前景。1 实验部分
1.1 实验材料和仪器
1.2 实验方法
1.3 CoNSi催化剂的表征
2 结果和讨论
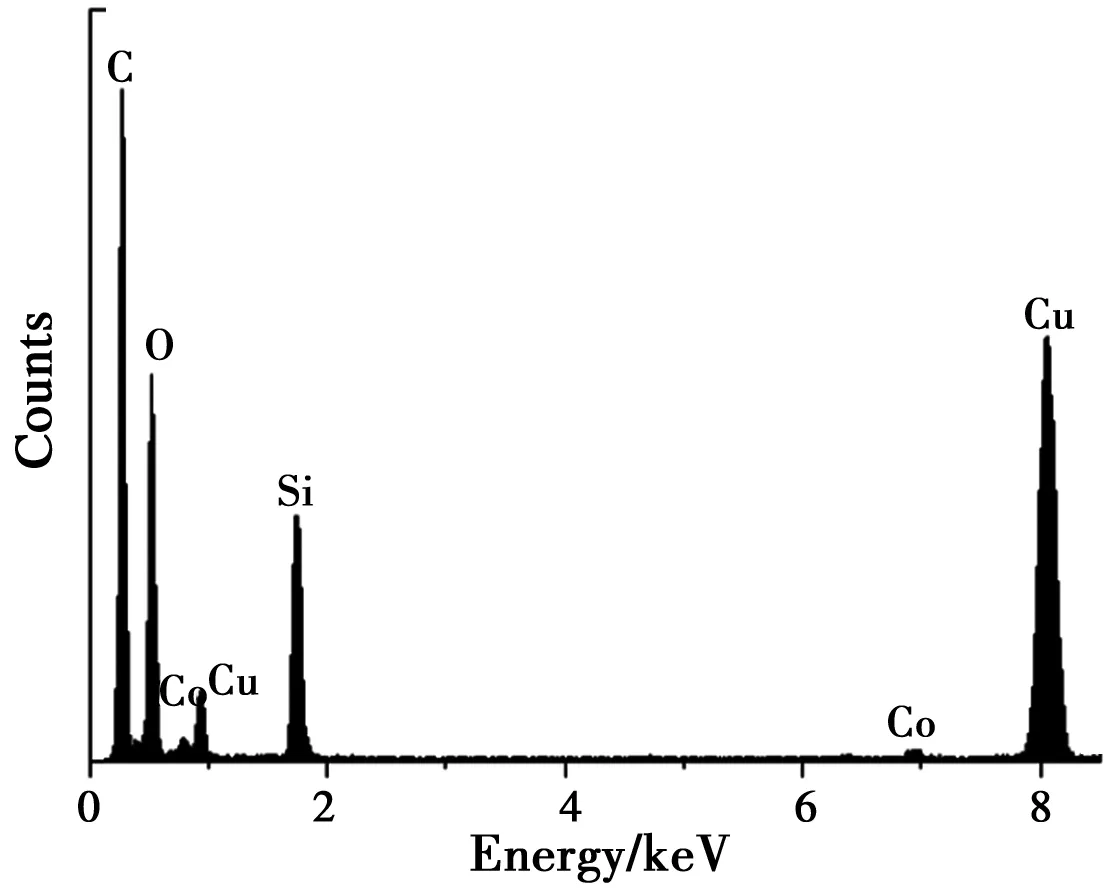
2.1 CoNSi催化剂的形貌和组成

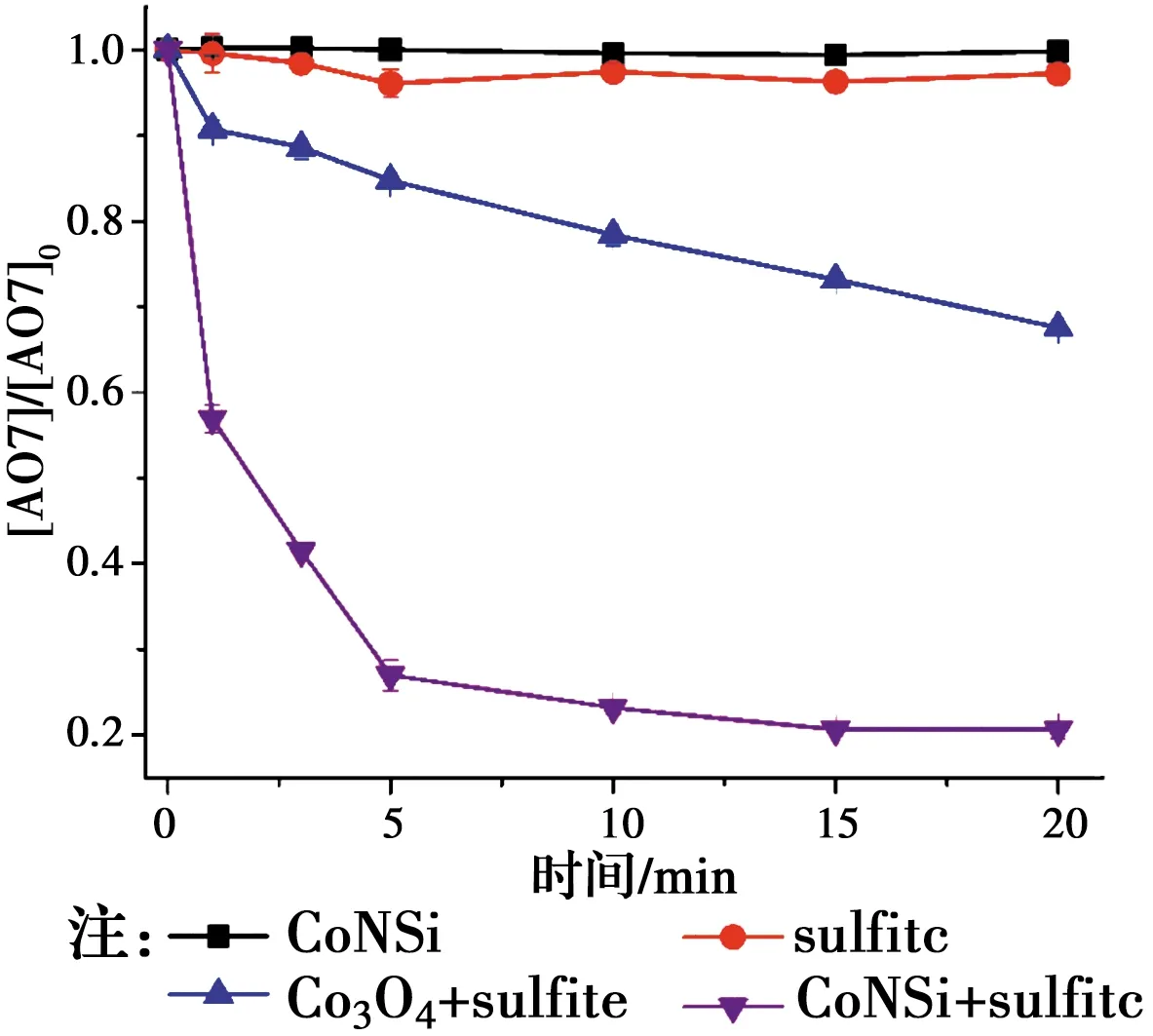
2.2 对照实验的影响
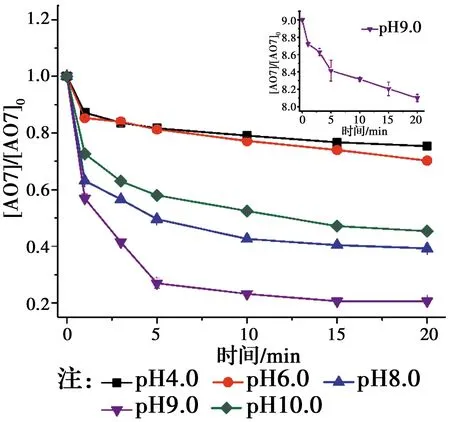
2.3 pH值的影响
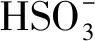
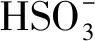

2.4 CoNSi和Na2SO3投加量的影响
2.5 AO7浓度的影响
2.6 氧气的影响
2.7 序批实验
2.8 不同自由基捕获剂实验
3 结论
