原发性干燥综合征差异基因及潜在治疗药物的生物信息分析
2020-05-21徐华,陈佳
徐 华, 陈 佳
(盘锦辽油宝石花医院 a.检验科; b.全科医学科, 辽宁 盘锦 124010)
原发性干燥综合征(pSS)是一种常见的系统性自身免疫性疾病,影响着全世界约3 500万人[1]。在我国的发病率约为0.77%,男女比约为1∶9[2]。除引起外分泌腺、肾、关节和血液等器官、系统损害外,还增加了淋巴瘤的患病风险[3-5]。但pSS初期症状轻微,加之缺乏敏感、特异的检测指标,常被人们忽视,目前亦无特效治疗药物。因此,寻找能够早期特异诊断pSS的标志物具有重要意义。近年来,随着分子生物学的发展,对pSS进行了许多研究,并发现了许多有益于诊断和治疗生物标志物,但各研究间尚存较大差异,其具体发病机制仍未阐明。本研究为避免单一研究所引起的假阳性问题,通过对基因表达综合系统(GEO)3个基因芯片数据进行分析,获得pSS组织与对照组织之间的差异基因,分析与pSS相关基因和信号通路,探讨pSS可能的发生机制,并利用pSS相关基因筛选潜在治疗药物,为pSS的的进一步研究提供线索。
1 材料与方法
1.1GEO数据集获取 基因表达综合系统(GEO)下载GSE7451[6]、GSE40611[7]、GSE127952 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE127952) 3个原发性干燥综合征基因表达数据作为分析数据集,同时下载GSE84844[8]做为hub基因验证训练数据集(见表1)。所有的数据都可以在网上免费获取,这项研究不涉及任何作者对人类或动物进行的实验。
1.2差异基因筛选 利用GEO2R在线分析工具(https://www.ncbi.nlm.nih.gov/geo/GEO2R/)分析pSS与非pSS样本间的差异基因。移除没有对应基因的探针,当有多个探针对应同一个基因时,取最大表达值探针来作为基因的表达量。并以P<0.05且差异倍数|logFC|≥1.0作为差异基因的筛选条件。最后,使用韦恩图web工具(bioinformatics.psb.ugent.be/webtools/Venn/)取3个数据集差异基因的交集作为pSS的差异基因。
1.3差异基因分析与hub基因筛选 使用Metascape[9]数据库对所得差异基因进行GO和KEGG功能富集分析。利用STRING数据库分析差异基因编码的蛋白互作网络,选取交互作用评分大于0.4,并将数据导入Cytoscape[10]软件进行可视化。通过CytoHubba[11]插件筛选hub基因。本研究选择MCC得分前25个且度值>20的基因作为pSS的hub基因。同时,以GSE84844作为训练数据集,应用受试者工作特征曲线(ROC)分析hub基因表达水平与pSS发病风险的关系。用“pROC”包计算曲线下面积(AUC)值和相应的95%置信区间(CI)。
1.4pSS潜在药物筛选与药物通路、靶点网络的构建 将上调和下调的差异基因映射到连接性图谱(CMAP)数据库[12]中,以富集分数≤-0.75和P<0.05为筛选标准,获得针对所选差异基因的小分子药物,作为pSS治疗的候选药物。为了进一步探讨前10项药物的潜在作用机制以及药物与通路之间的关系,使用STITCH数据库[13]来识别这些药物的靶点,然后分析药物靶点网络,显示前10名药物与其对应靶点之间的相互作用。利用DRUG-Path数据库[14]获得前10名候选药物的路径,以P<0.05为差异有统计学意义。
2 结 果
2.1差异基因筛选 以P<0.05且|logFC|≥1.0为筛选条件,在GSE7451中筛选出2 778个差异基因,其中上调基因1 407个,下调基因1 371个;在GSE40611中筛选出2 423个差异基因,1 071个基因上调,1 352个基因下调;在GSE127952中筛选出1 973个差异基因,1 017个上调基因和956个下调基因。随后,通过对3组差异基因取交集,得到90个最终差异基因,其中79个显著上调基因(图1a)和11个下调基因(图1b)。
2.2差异基因的功能富集分析 90个差异基因导入 MetaScape进行GO与KEGG富集分析。在生物学过程中,这些基因主要参与病毒防御应答、多生物过程的调控、先天免疫应答调控、对β干扰素的反应和细胞对干扰素γ的反应等。在细胞组分方面主要与细胞质核周区、富含ficolin-1颗粒的内腔、膜筏、初级内体、三级颗粒等有关。在分子功能方面主要与半胱氨酸型内肽酶调节因子参与凋亡过程、细胞因子结合、GTP结合、酶激活剂活性、肌动蛋白结合和泛素样蛋白连接酶结合有关。KEGG通路富集分析显示,这些基因参与NOD样受体信号通路、甲型流感、NF-kappa B信号通路、弓形虫病和凋亡通路等。富集分析结果前10项(分子功能共6项)见图2、表2。

表1 pSS患者与正常人组织芯片资料
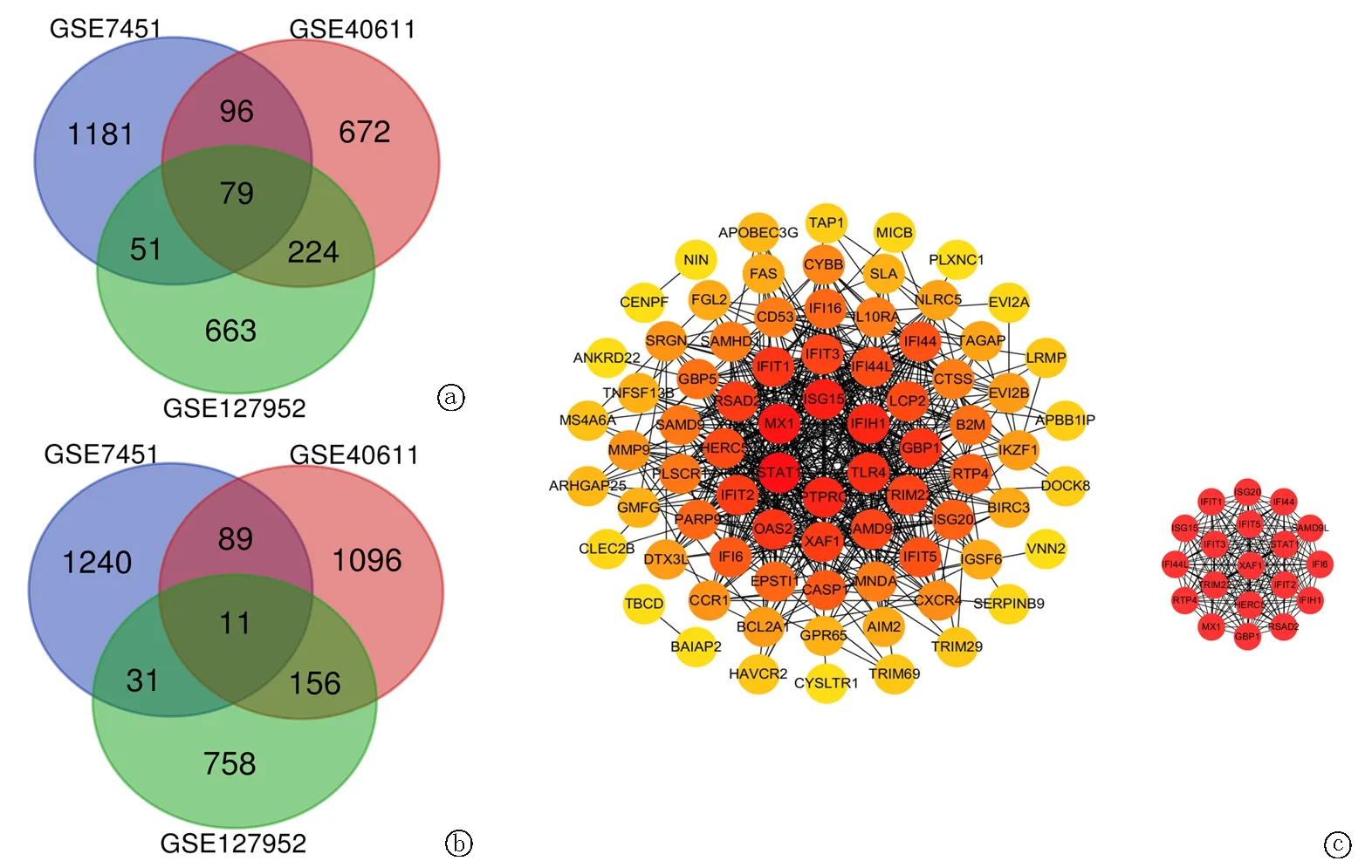
图1 差异基因韦恩图与PPI网络图 a.上调差异基因;b.下调差异基因;c.差异基因与hub基因PPI网络图

图2 GO和KEGG分析气泡图 a.生物过程; b.细胞成分; c.分子功能; d.KEGG途径
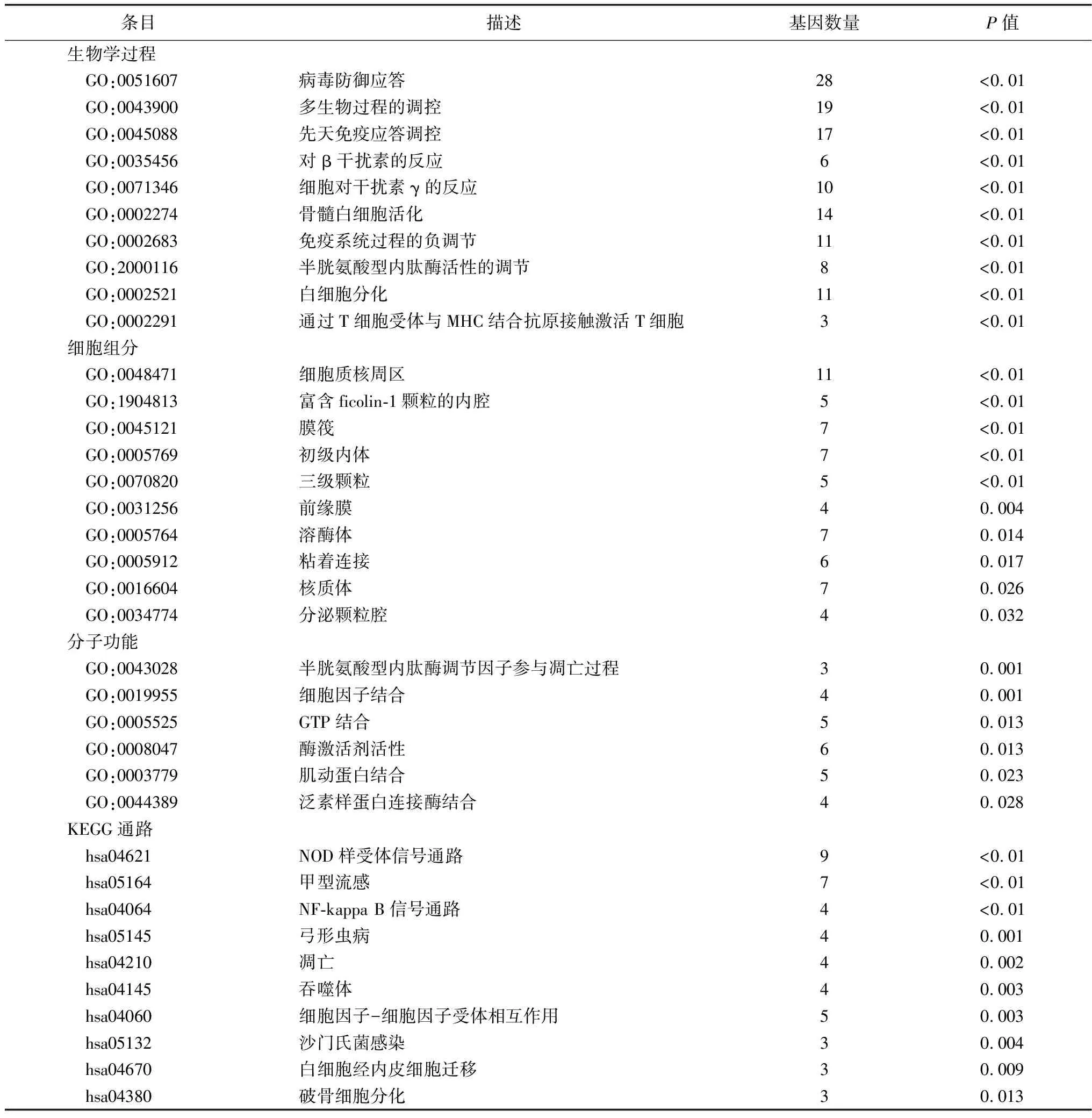
表2 GO与KEGG分析结果
2.3PPI网络构建与hub基因鉴定 将差异基因导入STRING数据库,得到90个节点和535个边组成的PPI网络,将PPI网络导入Cytoscape软件进行可视化分析.应用cytohubba插件计算MCC评分和度值,最终确定19个基因为pSS预选hub基因,这些基因在pSS中均为上调基因(图1c)。
用ROC曲线分析了19个基因在训练集GSE84844中对pSS的诊断价值。这些基因对pSS诊断具有较高的敏感性和特异性,对pSS的诊断具有一定的诊断价值,尤其是IFIH1与IFIT5的AUC>0.90,可作为pSS诊断的生物标记物,见表3,图3。
2.4pSS潜在治疗药物筛选与分析 根据CMAP数据集的预测,15种得分≤-0.75的候选药物被认为是治疗pSS的潜在药物。对得分最高的前10种药物进行药物途径和药物靶点分析,共有81条路径显著相关(图4)。其中氟替卡松和氯唑西林分别对应于嗅觉传导、亨廷顿病、基础转录因子、系统性红斑狼疮、格兰特对宿主病、造血细胞系、哮喘、移植排斥反应、I型糖尿病、MAPK信号通路、抗原处理和呈现途径。应用STITCH数据库预测前10名药物的靶点,然而,数据库中未能得到Prestwick-691的靶点。因此,仅提出了9个药物靶点网络。见表4,图5。
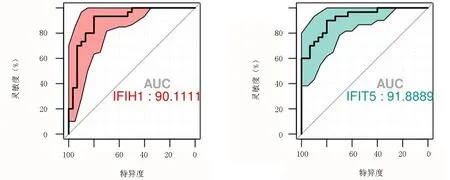
图3 IFIHI与IFIT5 ROC曲线图(阴影部分表示置信水平)
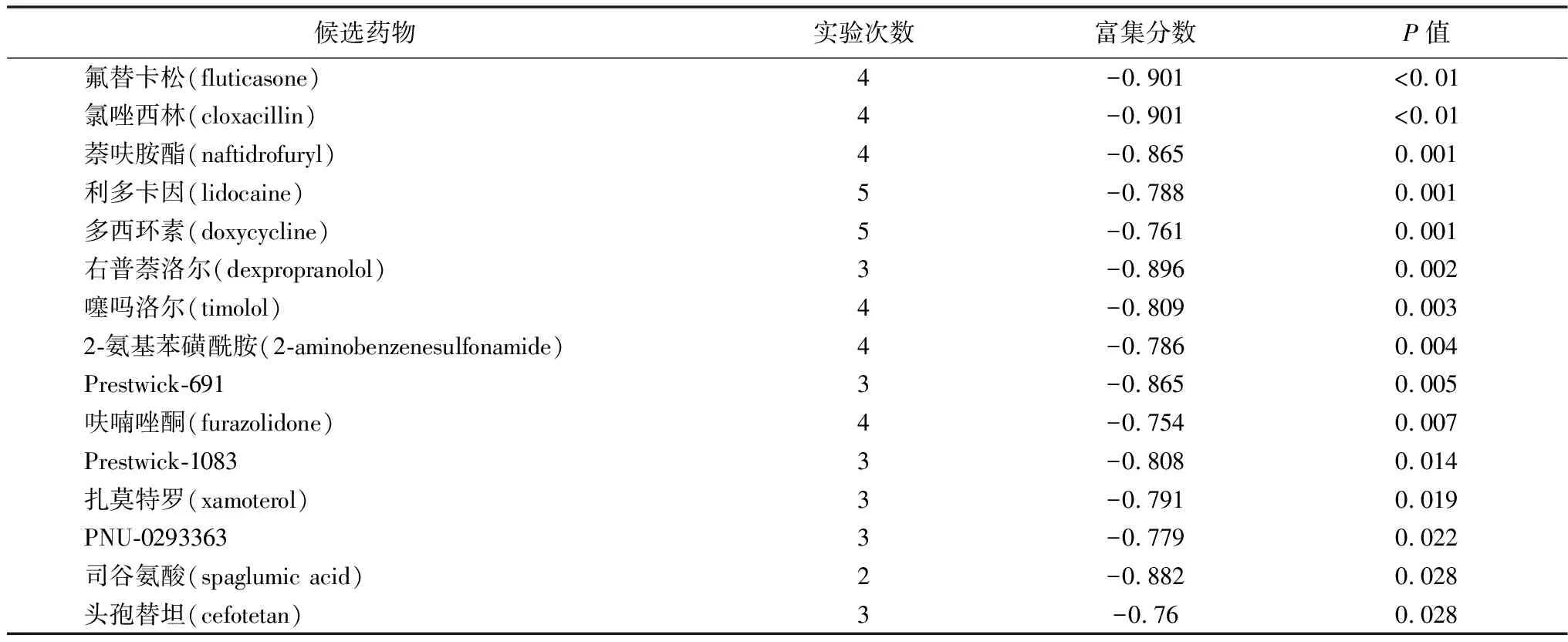
表4 CMAP数据库筛选的pSS治疗药物
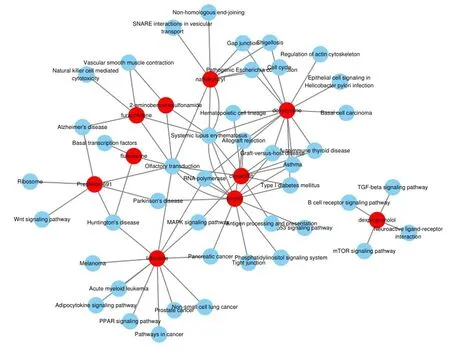
图4 药物作用通路网络图:红色节点代表药物,蓝色节点代表受药物影响的通路
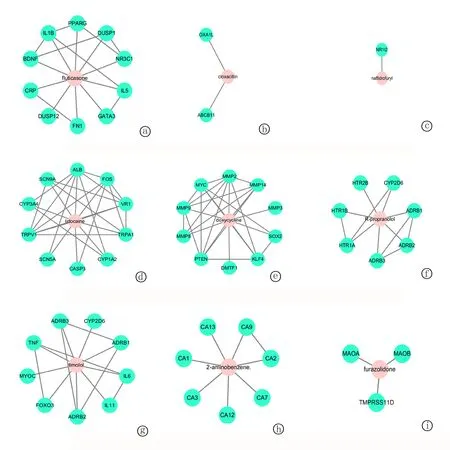
图5 药物的靶向网络图 a.氟替卡松;b.氯唑西林;c.萘呋胺酯;d.利多卡因;e.多西环素;f.右普萘洛尔(R-普萘洛尔);g.噻吗洛尔;h.2-氨基苯磺酰胺;i. 呋喃唑酮
3 讨 论
pSS已成为世界三大自身免疫性疾病之一[15],在世界不同地区的患病率为0.5%~1.5%[16-18]。尽管在揭示pSS发生发展的分子机制方面已经取得了很多进展,但具体的机制还不清楚。已发表研究之间的不一致也很明显[19]。因此,进一步研究对于验证和更新所获得的信息具有重要意义。本研究通过对3个基因表达数据分析得到了90个(79个上调,11个下调)差异基因。之后,我们进行了GO/KEGG途径富集分析。DEGs主要富集在NOD样受体信号通路、甲型流感和细胞因子-细胞因子受体相互作用的信号通路中。免疫调节异常和细胞凋亡异常是pSS损伤腺体的重要机制之一[20]。核苷酸结合寡聚结构域(NOD)样受体(NLRs)是一类参与调节自然免疫应答和细胞死亡途径的胞浆蛋白,细胞因子-细胞因子受体相互作用途径是一种免疫相关的信号途径,在炎症宿主防御、细胞生长和分化中起着重要作用[21-22]。此外,病毒感染可以诱导宿主的自然免疫反应,从而激活宿主模式识别受体介导的抗病毒信号通路,如Toll样受体(TLRs)和RIG-I样受体(RLRs),可在多种机制的调控下诱导干扰素等细胞因子的表达[23]。这些信号通路可能有助于为pSS制定有效的治疗策略。
本研究采用差异构建了PPI网络,并筛选了19 个hub基因:STAT1、MX1、ISG15、IFIH1、GBP1、IFIT1、XAF1、RSAD2、IFIT2、SAMD9L、TRIM22、IFIT3、IFI44L、HERC5、IFIT5、IFI44、IFI6、RTP4和ISG20。与非pSS组织相比,pSS中所选hub基因的表达均上调。在验证hub基因时,我们使用独立的数据集通过ROC曲线进行分析。这些基因对pSS诊断具有较高的诊断价值,尤其IFIH1与IFIT5的AUC>0.90,它们可能是pSS的良好预测指标。这19个基因中有多个是干扰素诱导基因,它们与抗病毒感染、天然免疫和诱导细胞凋亡等功能相关。IFN途径的激活提示pSS与病毒感染有关[24]。在SLE、皮肌炎、银屑病等不同疾病中,已有I型IFN途径紊乱的报道,pSS患者的唇腺和外周血中IFN-α的表达也明显增高[25-27]。IFN途径的激活可能是pSS潜在的治疗靶点。
基于pSS相关的差异基因进行潜在治疗药物预测,得到15种候选药物,以期为pSS治疗提供更多思路。本研究选取前10种药物进行靶基因和药物作用途径分析。其中,氟替卡松(合成糖皮质激素)和氯唑西林(苯唑西林氯化衍生物)的连接性得分相对较低。氟替卡松直接作用于NR3C1、IL5、DUSP1、CRP、PPARG、DUSP12、BDNF、GATA3、FN1和IL1B,调节嗅觉传导、亨廷顿病和基础转录因子的信号通路;氯唑西林直接作用于ABCB11和OXA1L,除调节嗅觉转化外,还参与调节系统性红斑狼疮、移植物抗宿主病、造血细胞系、自身免疫性甲状腺疾病、哮喘、移植物排斥反应、Ⅰ型糖尿病、MAPK信号通路、抗原处理和递呈信号通路。在本研究中它们是最佳的潜在治疗pSS药物。
本研究尚存一些局限性有待解决。首先,我们需要在体外进一步验证分析所得的hub基因,并观察其在pSS中的特异性作用。其次,通过Cmap数据库预测的潜在治疗药物对pSS治疗的影响有待进一步的实验研究。综上所述,本研究不考虑上述局限性,基于GEO数据库的3个基因表达谱数据,在pSS中鉴定出90个DEGs,并通过GO和KEGG通路分析进一步探讨pSS的潜在机制。此外,我们的研究预测了15种pSS候选药物,为pSS诊断、治疗的进一步研究提供了新的线索。
