微流控SERS及其在生物医学应用的研究进展
2020-05-20徐迪黄青
徐迪,黄青*
(1. 中国科学院合肥物质科学研究院,中国科学院强磁场与离子束物理生物学重点实验室,合肥 230031;2. 中国科学技术大学,合肥 230026)
1 引言
微流控芯片又称芯片实验室(Lab on a chip),是一种在微米级尺度上实现操作微观物体及分析微量样品的技术。微流控芯片作为微全分析系统(micro total analysis systems,TAS)中最活跃的领域和发展前沿,其概念最早是于1990年由Manz提出[1],他们以微机电加工技术(Microelectromechanical system, MEMS)作为建立TAS的技术基础,设计了一款微型化硅基开放式液相色谱仪器,将样品预处理、分离及检测功能集成于一张芯片上。微流控芯片的设计理念及最终目的就是将分析实验室的功能转移到便携的微型化、集成化的芯片上,实现分析实验室的个人化、家用化。自微流控芯片发展的二十年来,芯片的制作材料、加工技术、操控及检测方法日渐成熟,在化学分析和化学合成等许多领域逐渐得到应用[2]。微流控芯片系统最突出的优势在于样品消耗少、反应时间短,而对于稀少且易失活的生物样品来说无疑是一种极好的分析工具。因此,近年来微流控芯片在生物医药领域的应用受到格外重视[3],如核酸测定[4]、蛋白质检测[5]、临床诊断[6]、细胞分析[7]、药物发现[8]等,另外在环境卫生监测、食品健康与安全检测[9]等方面也显示了良好的应用前景。
微流控芯片与检测器结合构成微流控芯片分析系统,使得微流控芯片的研发及应用不断获得发展。检测器是整个分析系统中尤为关键的部分,其好坏直接关系到整个微流控芯片分析系统的性能,如检测速度、样品体积、检出限及检测范围等。相对于传统分析系统,微流控芯片由于具有特殊的微观性状如样品体积小、检测区域小、样品流速快等,因此对检测器的要求更加严格,如更高的灵敏度、更好的信噪比及更快的响应速度;同时,检测器的微型化和可集成性始终作为微流控分析的一个重点研究方向;此外,具有高通量的微流控芯片要求检测器具备多重平行检测功能[10]。现已用于微流控芯片上的检测技术有电化学检测[11]、质谱分析[12]、光学检测等。光学检测器具有检测速度快、灵敏度高等优势,其中与微流控芯片系统联用的光学检测器以荧光检测器[13]、化学发光检测器[14]、吸收光度检测器[15]及拉曼散射检测器[16]等为主。其中拉曼光谱检测具有很多其他检测技术难以达到的优势,首先它具有优异的指纹识别能力,谱线锐利,可反映物质分子的细微结构变化;其次在样品处理上也十分的简便,所需样品量少,对样品的性质和状态无过多限制,有机、无机化学成分和生物材料均可检测;另外拉曼光谱可对样品进行无接触、无损伤检测,光谱成像简便、分辨率高、分析快速;而且拉曼光谱仪器体积适中、操作简单,以上优势与微流控芯片的特征相容性程度很高。拉曼光谱与微流控芯片技术结合,可以准确地且快速地监测、检测并分析微流控环境中的各种微小体积的生化样品,特别是对于稀少且昂贵的生物样品以及需要连续监测的环境样品等。目前拉曼微流控系统在单细胞分析尤其是在细胞分选上表现出优异的性能,与流式细胞术相比无需进行标记,芯片上流体操控更加精确,可实现在高速流动状态下单细胞的捕获、拉曼光谱采集及自动分离[17-18]。最近刚发表的关于自动化拉曼光谱仪用于活细胞功能分选的工作[19]特别介绍了一个微流控光学平台集成了微流体、光镊和拉曼光谱技术,用于对稳定同位素标记的微生物细胞进行自动化分类,适合于后续单细胞基因组学、微型宏基因组学的研究。
但普通拉曼光谱固有的缺点是信号极弱,其散射光强度约为入射光强度的10-6~ 10-9,拉曼光谱的应用受到限制。表面增强拉曼光谱(SERS)的发现使这一状况大为改观[20],即当分子吸附于金或银等贵金属纳米材料表面时,在电磁场增强及电荷转移效应下其拉曼信号可增强6~11个数量级[21],灵敏度得到了质的提升,单分子[22]及单细胞水平[23]检测成为可能。所以,融合SERS检测技术的微流控芯片可将拉曼微流控系统的分析水平和应用范围大大提高。实际上,近年来人们开始发展SERS与微流控系统相结合的技术,并在分析检测方面已有十多年应用和研发的历史。Cooper团队[24]于2002年首次将SERS应用到微流控芯片上,在微流体通道内用硼氢化钠还原硝酸银的方法合成胶体银作为流动的SERS基底,胶体银聚集形成间距小于10 nm的纳米隙,在共振波长激发下,纳米隙能产生一个显著增强的电磁场,即所谓的“热点”,热点处的分子被激发得到增强的拉曼信号。该系统可用于检测低至10 fmol的偶氮染料,与宏观流动状态下相比微流控芯片SERS检测的灵敏度高出了1~2个数量级。随后大量的相关工作被报道,尽管大多报道将SERS微流控平台仅用于具有高散射界面的分子如罗丹明6G[25]、结晶紫[26]等的检测,但人们很快将目标集中在生命科学及医学等相关领域,利用SERS微流控技术,在诸如病原体鉴定[27]以及各种疾病的生物标志物检测[28]等方面开展了大量工作。
本综述针对SERS微流控芯片近年来发展及在生物医学方面的应用研究作了较为系统的介绍和论述。首先介绍SERS微流控芯片系统的核心部件——微流控芯片的制作和加工,以及如何在SERS微流控芯片上进行流体操控,接着介绍了近年来微流控芯片中SERS基底的发展情况,随后重点介绍和讨论近年来SERS微流控芯片系统在生物医学上的应用及代表性或突破性工作,包括生物分子的检测、细胞分析、药物监测和筛选、疾病诊断,以及关于环境卫生和食品健康方面的检测,最后对涉及该技术发展中的问题提出一些看法,对其未来的发展前景予以展望。
2 SERS微流控芯片系统
2.1 微流控芯片的制作
微流控芯片的制作材料从无机材料硅、玻璃及石英发展到现在使用最广泛的有机聚合物如聚二甲基硅氧烷(PDMS),另外低成本的陶瓷材料以及新兴的纸基材料也被用于微流控芯片的制作。硅由于具备良好的化学惰性和热稳定性,且作为微电子行业的基础材料,其加工工艺及相关设备已相当成熟,在TAS发展初期首先被用于制作微流控芯片(图1a)[29],但是由于硅材料自身的缺点如易碎、不透光、电绝缘性欠佳等,后来一度被玻璃和高聚物所取代。玻璃材料价廉易得、透光、耐腐蚀,且易构建微结构如微阀或微泵,由玻璃基底及其他材料复合形成的多路阀如图1b所示[30]。石英芯片的透光性好,且拉曼背景低,适用于制作用于拉曼检测的芯片。低温共烧陶瓷(LTCC)是一种氧化铝基材料,它在层压板中形成图案、完成组装,然后在高温下烧结形成芯片(图1c)[31]。LTCC在制造复杂三维结构、多层结构和低成本的微流控器件上有一定的优势。有机聚合物材料由于具有选择空间大、易加工、价格低廉且可进行大规模生产等优点,非常适合于批量制作一次性微流控芯片,其中热固性聚合物聚二甲基硅氧烷(PDMS)是当前应用最多的微流控芯片材料之一[32]。PDMS透气透光、无毒、成本低廉、化学惰性、制作快捷,具有特殊的弹性易于加工微型控制结构,另外通过叠合多层PDMS可制作复杂结构功能化芯片(图1d)[33]。Whitesides等于20世纪90年代末期采用了软光刻方法制作微流控芯片[34],此后PDMS和软光刻法被推广开来,成为实验室普遍采用的芯片制作材料和方法。凝胶材料具备良好的透过性以及生物相容性,主要应用在细胞培养及组织工程的研究中(图1e)[35]。新提出的纸基芯片处于高速发展的阶段,其来源丰富、成本低廉、便携性好,具有良好的生物相容性,且废弃后易处理,引起了科研人员的广泛关注。第一例纸基微流控芯片是由Whitesides团队于2007年报道[36],该芯片上的液体是在毛细作用下实现被动运输,无需外接驱动装置,如图1f所示。纸基芯片适合于需要成本低且操作简单的快速分析,其推动了便携式分析设备在生物医学上的应用[37]。

图1 不同材料制作的芯片。(a)硅[29];(b)玻璃[30];(c)陶瓷[31];(d)PDMS[33];(e)凝胶[35];(f)纸[36]
Fig 1 Microfluidic chips fabricated by different materials: (a) silicon[29]; (b) glass[30];(c) ceramic[31]; (d) PDMS[33]; (e) gel[35]; (f) paper[36]
硅片、玻璃和石英芯片的制作方法一般采用成熟的微细加工技术,即半导体及集成电路芯片广泛使用的光刻和蚀刻技术。芯片制作过程主要包括薄膜沉积、光刻和蚀刻三个工序。薄膜沉积是通过热氧化、化学气相沉积、气相外延、物理气相沉积、涂敷、溅射等方法在基片表面覆盖一层薄膜,薄膜作为牺牲层,提高了刻蚀时的选择性,起到对基片的保护作用。光刻和蚀刻技术是将掩模上设计的微流控芯片图案通过曝光成像转移到薄膜上并进而在基片上加工成特定微结构的工艺。有机聚合物芯片的制作则与无机材料芯片有很大的区别,可采用的制作技术有传统的模塑法、注塑法、热压法,或激光烧蚀法、LIGA(X射线光刻、微电铸与微复制)、软光刻以及新兴的3D打印法等。激光烧蚀法[38]是一种新型微细加工技术,利用可光解聚合物在紫外激光作用下发生激光溅射,采用掩模或直接根据计算机辅助设计(CAD)精密控制溅射位置,从而得到具有特定结构的芯片。激光烧蚀得到的微流控芯片通道壁垂直、深宽比大,但加工效率低,激光器昂贵且具有一定的危险性。LIGA[39]是一种基于X光深层光刻、微电铸和微复制的MEMS加工技术,近来已用于制作热压法和注塑法所需的模具及高深宽比的聚合物芯片。软光刻是20世纪90年代末提出的一种新的微图形复制技术,它的研发及在PDMS材料的大规模应用是微流控芯片发展史上一个重要的里程碑。该技术用弹性介质代替了传统光刻中使用的硬模,多数条件下用PDMS,利用这种弹性介质进行简便而又精确的复制,从而提高了微制作的效率。另外,软光刻技术能在曲面上操作,可制造复杂的三维立体结构,相对于传统光刻应用更加灵活。软光刻技术没有光散射引起的精度限制,可以达到30 nm~1m的微结构尺寸。近年来,3D打印法在分辨率和速度方面的提升使微流控器件的制作过程直接简化为一步,是最有可能将芯片推向商业化的一项制作技术[40]。与传统方法相比,除了高速和高分辨率,3D打印在制造微流控器件方面还有其他显著的优点,包括适用材料广、可制造特殊的孔结构,甚至可将将多孔的组织支架嵌入到芯片。另外,生物材料如活细胞和生长因子,可以直接用3D打印机打印[41]。
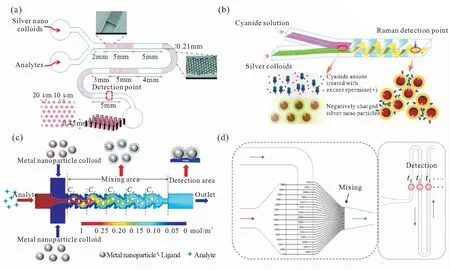
图2 微通道构型被动混合器。(a)微柱阵列[46];(b)鳄鱼齿状[47];(c)级联分裂重组[44];(d)多通道交替混合[43]
Fig 2 Passive micromixers based on designed microfluidic channels such as (a) a pillar array microfluidic channel[46]; (b)an alligator teeth-shaped microfluidic channel[47]; (c)the cascaded splitting and recombination (C-SAR) microfluidic mixer[44]; (d)multiple channels for fast and alternating mixing[43]
2.2 SERS微流控芯片上的流体操控
微流控芯片在SERS测量之前主要用于特定样品的预处理[42],控制目标分析物与金属纳米材料之间的混合[43],另外控制纳米粒子间距以增强SERS信号[44],通过流体操控捕获样品制造小体积、高浓度样品,以便从目标物中获得详细的拉曼光谱信息[45]。如何实现微流控芯片上对流体的精密操控,为完成后续光谱分析提供保障,以充分利用SERS系统的高灵敏度和高选择性,这就需要芯片上各种微结构的配合使用如微泵、微阀、微混合器等,对微流体环境进行精准有效的控制。以微结构为基础建立的各个功能化的模块,可以对复杂样品进行预处理,如分离、富集、捕获等,从而提高SERS微流控系统的分析能力。
SERS检测要求目标分析物与SERS基底即纳米材料的充分混合,所以微流控通道的设计或微混合器的使用十分重要。在微流控通道中,微米尺度下的流体均以低雷诺数的层流形式流动,分子只能通过扩散进行混合。为了混合充分,目前使用较多的是根据微流体力学原理设计复杂的通道构型以提高混合效率,减小混合所需的时间和空间,如微柱阵列[46]、鳄鱼齿状[47]、 级联分裂重组[44]及多交替通道微混合器[43]等(图2)。另外,SERS微流控系统中已经报道的主动混合器有电动[48]及磁力搅拌[28]混合器,另外气泡诱导[49]、声波驱动[50]等混合器具有应用潜力。主动混合器可以实现良好的混合,但相对于被动微混合器来说成本高、集成难,通常需要复杂的控制单元和外部驱动等。
另外,生物样品的复杂性对目标分子SERS光谱分析带来一定的干扰,所以样品预处理技术在SERS微流控系统研发和应用中也十分关键。SERS微流控系统常采用芯片毛细管电泳对复杂样品中的多种组分进行高速分离,Schultz等[51]设计的毛细管电泳SERS芯片中毛细管附着在鞘流界面上,用于分离后的流体分析物的连续流动和聚焦,并将其准确引入SERS基底上,该装置已用于氨基酸[52]及多肽[53]等的高效分离。Perozziello等[54]将微渗析膜安装在微流控芯片中,可以在样品到达SERS基底之前从较大的蛋白质中分离出较小的蛋白质或其他小分子。Kong等[55]采用由高度多孔的硅藻土作为微流体通道的材料,将色谱分离集成在芯片通道内,利用该装置从混合物或复杂生物流体中分离小分子。Durucan等[56]结合了离心力和毛细作用力在SERS衬底上进行样品的分离纯化,即快速、简便地提取牛奶中的三聚氰胺。Au NP阵列阻碍了大分子的扩散,离心下的惯性力加速了过滤过程,小分子扩散到相对纯净的环境中。Morelli,等[42]介绍了一种集过滤、液液萃取和检测SERS传感器于一体的离心式微流控自动化平台,用于检测大肠杆菌的次生代谢物---对香豆酸,并可能适用于其他次级代谢物如抗生素、维生素和药物的提取和检测。集成在芯片内的醋酸纤维素膜用于过滤细胞,萃取室与装载二氯甲烷的腔室及导入过滤后样品的蛇形虹吸管相连,蛇形虹吸管分裂成四个通道连接在萃取室底部,以产生气泡提高混合和萃取效率,萃取后的样品直接通入检测室获取SERS图谱。
2.3 微流控芯片中的SERS材料或基底
SERS通常采用由Ag、Au、Cu等金属纳米材料作为SERS活性基底,增强原理目前可以分为电磁场增强(EM)及化学增强(CE)[21]。SERS光谱强度可通过以下公式近似表示[57]:
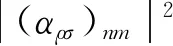
(1)

(2)
式中GEM为EM增强因子,A(νL)和A(νs)分别为激光和拉曼散射场的增强因子,ε0为周围介质的介电常数,ε(ν)为金属纳米材料的介电函数,d为分析物和金属纳米材料的距离,和项(αρσ)nm为CE增强因子。同时将EM和CM结合是SERS实现超痕量检测的关键,其灵敏度可与荧光光谱相媲美[58]。尽管作用机制不同,二者均受到SERS活性基底即纳米材料的性质及结构影响。
关于SERS热点构建,主要基于EM机制设计各种纳米尺度形状的材料和平台,从单个粒子发展到复杂的三维结构,也将设计理念从最初的创造具有独特结构特征以提高单个粒子的热点密度,发展到利用多维等离子体耦合来显著提高热点强度。在单个粒子形状的设计上,主要利用大曲率结构表现出的“避雷针效应”以获得较高的电磁场增强,例如Au和Ag纳米球[59]、纳米棒[60]、纳米锥[61]、纳米星[62]、花状[63]等结构的纳米粒子,他们因具有纳米尺度的尖角、脊、沟槽、尖端或粒子内间隙表现出强烈的SERS活性。除了直接合成复杂的纳米粒子形貌外,还可以通过对合成后的纳米粒子进行形态修饰,如在纳米银八面体的边缘及尖端区域选择性沉积Au纳米粒子[64],或者将原先合成的材料刻蚀掉一部分,如通过化学刻蚀增加Ag纳米颗粒的粗糙度以提高热点EM增强效应[65]。第二种SERS热点产生于耦合纳米结构的可控的粒子间纳米间隙,典型的例子是Au或Ag 纳米粒子二聚体,用于SERS 单分子检测,以及核壳结构的纳米粒子二聚体、纳米粒子聚集体或寡聚体及纳米粒子阵列等。通常,耦合等离子体纳米结构的平均SERS强度比单个纳米结构的平均SERS强度高出四个数量级[66]。三维结构的纳米材料的引入不仅能使吸附和检测到的目标分子更多,而且有效提高了热点的数量及其在Z方向上的利用率。目前3D SERS平台的制造策略主要分为自上而下和自下而上两种。自下而上是通过纳米颗粒自组装形成各种大面积三维结构和紧密堆积的超晶体[67]。而自上而下是采用传统的微加工方法(如光刻、反应离子刻蚀等)来设计纳米器件[68,69],目前自上而下的制造技术在精度方面受到着如电子束光刻的空间分辨率限制,难以重复制作粒子间间隙小于10 nm的阵列结构。为了克服这一限制,研究者提出将自上向下与纳米颗粒自组装结合起来制造具有纳米级粒子间隙的3D SERS基底的方法,即由模板引导的纳米颗粒化学自组装[70]。
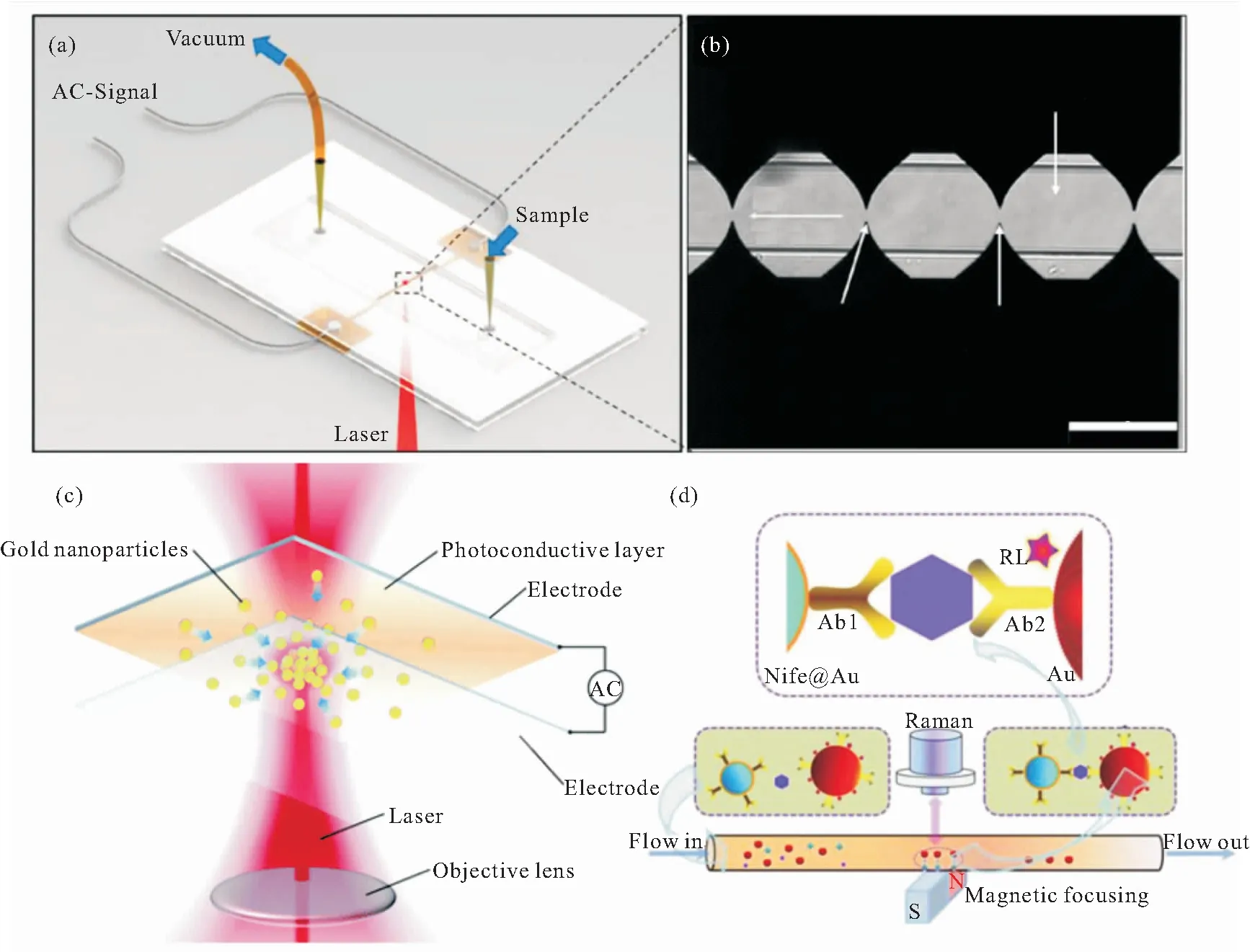
图3 金属胶体在微流控通道中的可控聚集。(a-b)介电泳驱动力按需捕获并释放银纳米颗粒[78];(c)光电镊子聚集金纳米粒子于激光光斑内[79];(d)磁聚焦纳米颗粒[81]:金包覆NiFe磁性纳米粒子NiFe@Au,Ab1捕获抗体,Ab2检测抗体,RL拉曼标记分子,肿瘤生物标志物CEA
Fig 3 The controllable aggregation of SERS-active nanoparticles in the microfluidic channel. (a-b)Dielectrophoretic actuation[78]for on-demand nanoparticle aggregation and release; (c)optoelectronic tweezer for accumulating gold nanoparticles in a laser spot[79]; (d)magnetic focusing realized by functional nanoprobes(NiFe@Au), capture antibody(Ab1), detection antibody(Ab2), and Raman label (RL)[81]
以上金属纳米材料的SERS热点只通过电磁场增强来实现,为了进一步提高热点增强效应,一些功能材料如石墨烯[71]、半导体[72]和压电聚合物[73]等被引入,它们与传统的SERS活性金属纳米材料结合形成复合材料产生新型SERS基底。这些材料可以提供额外的化学或电场增强,与金属纳米粒子产生的电磁增强相互补充,在原有的基础上提升10~102倍。此外,复合的SERS基底结合了这两种材料的固有特性,克服了传统的纯贵金属SERS基底的局限性,如增强了材料表面与分析物的亲和力,提高了稳定性和重现性。除了提高SERS基底的热点强度外,另一种提高SERS信号的方法是增强目标分子的捕获率,该操作可进一步将SERS性能提高10-104倍。分子捕获旨在通过各种途径提高SERS活性位点的局部分析物浓度,特别是对于与材料表面没有亲和力的分子。
一般说来,被测样品的拉曼信号增强可以从三个方面考虑:扩大分子拉曼截面[74]、在材料表面通过化学修饰捕获分子[75]、以及用物理方法将分析物直接限制在SERS-活性表面[76]。如何将以上多种高质量的SERS基底应用到微流控通道中是构建SERS微流控系统的一个重要环节。总体来说微流控通道中的SERS基底可以分为两类:金属胶体和固态基底。基于金属胶体的SERS基底合成及使用方法简单方便,首个SERS微流控系统就是以胶体银作为流动的SERS基底[24],胶体银通过硼氢化钠还原硝酸银的方法在微流体通道内原位合成,或可预先合成金属胶体然后直接注入微流控通道以进行后续的SERS检测[47]。金属胶体的合成依赖于带电表面活性剂作为稳定剂和分散剂,离子环境的变化会导致胶体聚集,这种随机不可控的聚集导致电磁场增强分布不均,引起信号不均、重现性差的问题需得到解决。近年来关于金属胶体的在微流控通道中可控聚集的研究工作取得了一定的进展。介电泳在微流控装置中被广泛应用于粒子和细胞的操纵、分选和捕获,其是指极化粒子在电场梯度中的迁移。Chrimes等利用介电泳控制银纳米粒子在通道中的聚集及间距,有效地提高SERS活性热点的数量,同时避免粒子的不可逆聚集[77]。Salemmilani等[78]采用介电泳技术,高度局部地按需捕获并释放银纳米颗粒,如图3a和3b所示,装置包括夹在电极基板和顶盖之间的聚二甲基硅氧烷(PDMS)微通道,通道出口处的真空泵用于建立负压引起流体流动。在电极接触垫上施加交流电位以激活介电泳纳米粒子捕获陷阱。银纳米粒子与分析物预混合,在陷阱区团聚形成SERS热点,然后利用拉曼显微镜扫描陷阱区获得光谱。研究者利用光电镊子[79]将金纳米粒子聚集在激光光斑内,实现了对SERS信号的原位增强和测量,如图3c所示。通过光诱导电动机理使分散在样品溶液中的金纳米粒子集中到激光光斑中并激发拉曼散射,实现了按需产生SERS活性位点及原位测量SERS信号。除了采用光电,磁场也可用于控制纳米粒子聚集。研究者利用免疫反应将表面修饰有抗原的金纳米颗粒与负载有相应抗体的磁珠结合,通道中固定的螺线管通电后产生的磁场用于捕获上述免疫复合物,SERS检测信号与待测物中抗原的含量成负相关[80]。另外还可以采用磁性物质如镍铁与贵金属形成的核壳型纳米材料作为SERS活性基底,直接通过磁场进行控制[81](图3d)。在生物免疫结合作用下,纳米探针被磁聚焦在微流控通道中的一个特定点上,从而能够富集“热点”,用于对靶向的癌胚抗原进行SERS检测。除了以上外部施加的主动驱动力,通道内部的结构设计可在特定位置提供毛细管力直接用作纳米粒子的聚集点[82]。如在一个缩窄的、台阶式的微通道-纳米通道结处,由于通道面积突然减小,大量纳米粒子团聚在此,电磁增强因子达到108,同时目标分子也集中在此处,SERS信号得以大幅度提升。
基于金属胶体的SERS微流控系统可以提供可控的流动检测条件,使信号差异平均化,减少局部升温,从而提高检测重复性。但存在的问题是分析物与金属纳米颗粒混合的时间较长,且不易混合均匀,甚至堵塞通道。在固态SERS基底中,这些问题是可以避免的,因为SERS基片不会随分析物流动。此外,为了产生均匀的热点阵列,固态SERS衬底需精确控制纳米间隙,这是获得电磁场增强和高重现性所必需的。在微流控芯片中嵌入固态SERS基底主要可以通过两种方式实现,一种是在微流控通道内原位制备SERS活性金属纳米结构,另一种是在固态SERS基底上构建微流控通道。在芯片中原位制备固态SERS基底,如采用多元醇还原法原位制备纳米Ag薄膜,该方法简单方便且成本低[83],制备过程及表征如图4所示。将以硅片为衬底的PDMS通道加热至150℃并注入Ag前驱体。前驱体中的Ag+被还原成核,在一定的Ag+浓度条件下,Ag核生长为Ag纳米粒子并在衬底和PDMS通道的表面形成Ag薄膜。图案化Ag薄膜的SERS增强系数为4.25×1010,用于实时传感检测。电偶置换法可在室温下进行,如将银纳米颗粒原位电沉积在粗糙Cu核/C鞘层纳米壁上,在通道内形成高活性拉曼基底[84]。在该方法中,电极必须集成到微流控通道中,纳米银的沉积形状和位点可通过预先图案化的电极来控制。纳米银沉积的的纳米壁具有很大吸附的面积,以及大量的SERS热点,计算的表观增强因子高达1.1×109。该方法为在微流控通道内集成SERS活性基底开辟了新的途径。另外有研究者提出通过光热效应在芯片中原位生长负载Ag NP的ZnO纳米棒(Ag@ZnO)3D SERS基底[85]。飞秒激光直写技术以其独特的设计性和可控性,被认为是制备光聚合物微纳结构的一种强有力的方法。Xu等利用飞秒激光诱导银离子光还原,在微流控通道内原位合成银纳米花阵列基底[86],该微通道被用作实时监测的催化微反应器。
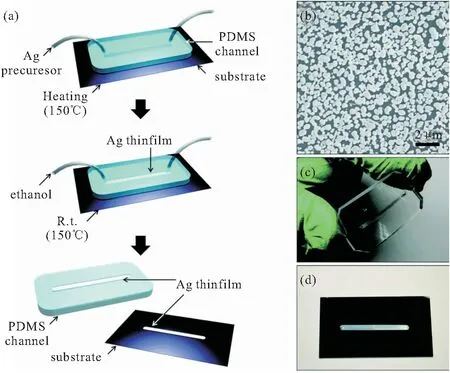
图4 (a)多元醇还原法原位制备纳米Ag薄膜流程图;(b)通道中Ag薄膜的SEM图像;(c)Ag薄膜PDMS通道;(d)Ag薄膜硅片[83]
Fig 4 (a) In-situ fabrication Ag thin films by a polyol method; (b) SEM image of the Ag thin film in a channel; (c) a PDMS channel and (d) a Si wafer patterned with Ag thin films[83]
除了上述的在芯片上原位合成固态SERS基底,还可以预先制备好图案化的固态SERS基底,再在基底上构建微流控通道。最典型方法是采用光刻法制备固态SERS基底,以Choo团队设计的金阵列为例[87],他们选用玻璃片为最底层,依次溅射钛和金膜,再旋凃光刻胶,与传统的掩模曝光不同的是他们采用的是UV定位曝光,显影刻蚀后获得特定图案的金微阵列。用于SERS基底的理想纳米制造技术需能够产生尺寸只有几十纳米、同时间隔只有几纳米的金属结构,该方法获得金微阵列的仍达不到该条件。一个芯片往往需要多种技术的结合才能完整的制备出来,芯片是基于软光刻、金属沉积后选择性图案化及氧等离子体处理制备而成[88]。在带有微流控通道的PDMS板上热蒸发一层薄银膜,用胶带将微流控通道外表面的银膜简单而有选择地去除。氧等离子体处理同时使纳米表面形成高强度SERS活性的纳米尖端或纳米点,并使PDMS与玻璃基板永久结合。Han等[89]采用激光刻划法制备银纳米粒子(AgNPs)氧化石墨烯(GO)的SERS复合基底,通过编程直接形成图案,再将其转移至PDMS上,再与另一片PDMS封合制成芯片(图5)。激光刻划法属于连续激光直写法,采用的是780 nm聚焦近红外激光器(200 mW)对DVD光盘进行划刻。DVD可被编写特定程序,并可用于大面积、快速和无掩模的GO还原(RGO),只需20分钟就可以完成整个DVD光盘的图案制作。作为投入实际应用的要求,这些技术应该具有一些突出的特点,包括低成本的制造、大面积的图案化及良好的重现性等。
Zhou等[90]开发了一种不同于上述两种构建微流控固态SERS基底的方案,他们是将制备好的线状基底直接插入玻璃毛细管中。该线状基底是一条电热康铜丝,其表面覆盖修饰有Ag纳米颗粒(Ag-NP)的垂直排列的ZnO纳米锥(ZnO-NT)。随后,温敏微凝胶、金纳米棒胶体和分析物组成的混合物被填充到毛细管的剩余空间中,通过电路开合控制温度,温敏微凝胶遇热收缩,使得待测物和Au纳米棒相互接近,且更接近Ag-ZnO纳米锥。该3D固态基底产生高密度的SERS“热点”,并被应用于湖水中甲基对硫磷的测定。

图5 激光刻划法制备AgNPs@RGO SERS微流控芯片。(a)AgNPs@RGO芯片制作过程示意图;(b)紫外光照射下石墨烯片上Ag NPs的生长机理;(c)各种AgNPs@RGO SERS衬底的可编程图案(标尺:500m);(d)制备的AgNPs@RGO芯片的照片(标尺:1 cm)[89]
Fig 5 Fabrication of AgNPs@RGO SERS microfluidic chip by direct laser scribing. (a) Fabrication procedures; (b) growth mechanism of AgNPs on graphene sheets under UV irradiation; (c) various programmable patterning of AgNPs@RGO SERS substrates (scale bar: 500m); (d) the as-prepared AgNPs@RGO SERS microfluidic chip (scale bar: 1cm)[89]
3 生物医学应用
伴随着微工艺加工技术的发展以及生物医学研究对生物样品组分分离分析的高精度需求,近十几年来微流控技术在生物医学领域得到了广泛应用[3]。微流控芯片最大的特征是微型化,从而具备样品消耗少,分离分析速度快、通量高、液体流动可控、稳定性好等诸多优势。微流控芯片具有灵活的集成性,多个微腔室可同时实施不同的功能,如在一块芯片上可以完成对细胞的培养、分选、识别和分析等一系列精准操作[91]。SERS在痕量检测上具有超高灵敏度以及快速无损检测的特点,同时固有的拉曼特征峰半峰宽窄,特异性强,易于区分。将SERS与微流控相结合,一方面在极少液态样品的检测上提高了SERS稳定性和重复性,另一方面也拓展了微流控芯片的使用领域,特别是在生物分子的检测、细胞分析、药物筛选和开发、疾病诊断、环境健康及食品卫生检测等均已有相当出色的应用。

图6 电池控制的SERS微流控系统的示意图和表征图。(a)电池控制的SERS微流控系统;(b)康铜线电镀ZnO纳米锥SEM图;除去部分ZnO纳米锥后的康铜线SEM图(c)和近观图(d)[90]
Figure 6 Schematic illustration of the battery-controlled SERS microfluidic system and characterizations. (a)The battery-controlled SERS microfluidic system; (b)a SEM image of the constantan wire electrodeposited with ZnO nanotapers(ZnO-NTs); (c) a SEM image and (d) a close-up view of ZnO-NTs covered constantan wire after partial ZnO-NTs being removed[90]
3.1 生物分子检测
生物分子检测技术的发展,有利于临床及医学诊断技术的进步。SERS微流控系统具备无损、超灵敏检测的优势,已成功地应用于DNA、RNA以及蛋白质等生物分子的检测。
DNA分子需要一种快速、灵敏的检测技术,在DNA微阵列芯片技术中,由于DNA的浓度很低,在检测之前应使用PCR技术对DNA样品进行扩增,再用微阵列测定机将样品固定在滑动玻璃上,最后用荧光或化学发光检测方法对放大信号进行检测。Park等[92]采用共焦表面增强拉曼光谱(SERS)技术,对PDMS微流控通道中染料标记的双链DNA寡核苷酸进行了快速、高灵敏的检测,检测浓度可低至10-11M。与DNA微阵列芯片相比,这种方法既不需要固定的程序,也不需要PCR扩增。此外,相对于荧光或化学发光信号,每个染料标记的DNA的特征拉曼峰很容易分辨。准确、灵敏地识别肿瘤细胞DNA突变对肿瘤的诊断、预后及个体化治疗至关重要,Huh等[93]将电动驱动的微流控装置与SERS结合(图7),采用连接酶检测反应法(LDR)检测人KRAS癌基因的点突变。在LDR中有两个引物,上游引物含有SERS活性染料和识别目标DNA的3’端碱基,而下游引物连接着银纳米颗粒。当这两个引物与模板DNA完全匹配的情况下,即连接在一起时,染料被带到靠近纳米粒子的地方,其特征拉曼峰可以被检测到。电动驱动的微阱装置将反应产物浓缩在一个有限的体积中以增强光学信号,对目标DNA的检测限低至20 pM。连接酶链式反应也被用于SERS微流控系统中KRAS癌基因的点突变检测[94],在40分钟内区分癌细胞多种核酸中突变型和野生型KRAS基因。SERS微流控技术的结合使得DNA无标记检测成为可能。核酸典型碱基的化学修饰在增加遗传多样性和编码生物信息方面起着重要作用,Morla‐Folch等[95]应用SERS结合化学计量学和微流控技术实现了对单链和双链DNA中4种不同修饰的胞嘧啶的鉴别和相对定量。SERS检测和微流控技术的结合消除了预扩增或富集步骤的需要,实现了对pg级DNA样品进行超灵敏分析,这为DNA实时的自动筛选提供了一种简单的低成本设备。为了克服微流控芯片中液体通过层流扩散导致检测效率低、芯片重复利用的交叉污染等问题,Han等[89]介绍的激光刻划方法制备的AgNPs@RGO生物芯片,作为一种可重复使用的SERS微流控传感器进行DNA检测。DNA和石墨烯之间的非共价相互作用介导了DNA序列的可控捕获和释放,从而有效地实现了芯片内SERS检测和生物芯片的再生。

图7 (a)用于LDR反应中目标DNA的SERS微流控电动驱动微阱装置。从下往上依次为修饰有电极的Pyrex玻璃衬底、微阱阵列(直径10m、高度8m)及功能化的PDMS金电极。通过极性来(b)吸引目标分子或(c)排斥非目标分子[93]
Fig 7 (a) A SERS microfluidic platform with an electroactive microwell for single nucleotide polymorphisms detection in LDR. From the bottom to the top: Pyrex glass substrates modified with electrodes, microwell arrays (10m in diameter, 8m in height) and functionalized PDMS gold electrode.. (b-c)Selective attraction and rejection achieved by controlling the polarity[93]
作为疾病标志物的微小RNA(miRNAs)的灵敏检测可以促进疾病的诊断和治疗。许多用于miRNAs定量检测的方法如基于PCR的方法或杂交链式反应[96],需要复杂和耗时的程序,Wang等[97]设计了一种可触发式相互放大信号(TMAS)探针,在微流控芯片中用SERS对miRNA进行一步定量检测。相互放大信号的两个TMAS探针是通过目标miRNA启动的无酶靶链位移循环反应产生的,从而产生增强的SERS信号(图8)。另外采用交流电动流动技术的微流控芯片产生高效混合和快速富集,以提高DNA杂交率,进一步提高SERS信号强度。该方法可在30 min内快速、灵敏地检测人乳腺癌细胞中miRNA-21的含量,检测限为2.33 fM。与传统方法相比,该方法克服了操作复杂的缺点,具有灵敏度高、检测时间短、样品用量少等优点。Prado等[98]将SERS液滴微流控用于无标记检测寡核苷酸RNA。液滴微流控允许内部流体再循环从而进行快速有效的混合,防止纳米粒子堵塞通道,该条件下RNA拉曼信号的极大值在液滴的中心,且在液滴形成并混合后的一段特定的时间后测得,这为提高SERS信号的重复性提供了有效的手段。该初步实验验证了SERS液滴微流控无标记检测纯寡核苷酸RNA的可行性,对于混合物光谱重叠问题,他们将应用原先开发的SERS光谱分解程序估计混合物中每种碱基的百分比。

图8 基于信号相互放大机制的SERS微流控平台测量miRNA-21的装置图[97]
Fig 8 The schematic diagram describing the use of mutual-signal amplification mechanism-based SERS-microfluidics platform for miR-21 detection[97]
SERS微流控系统因具备以下几个优势而常被用于蛋白质检测:首先SERS检测是在与生理条件相似的水环境中进行的,有助于维持蛋白质的固有形态;SERS基底的高增强能力使激发激光功率尽可能低,测量时间尽可能短,大大减少了激光造成的损伤;微通道中的流动流体不仅有效地避免了样品在激光斑点处的局部加热,而且保持了测量条件的稳定性和一致性;贵金属纳米材料周围的配体可以防止蛋白质与银之间的直接化学相互作用,并减少对蛋白质天然构象的影响。Lu等[44]基于以上条件设计了一种特殊的微流控通道(图2c),混合效率高且增强了分析物落入SERS热点的几率,对外周髓鞘蛋白PMP22蛋白的野生型和突变体G150D的第四跨膜(TM4)螺旋构象随环境pH变化差异进行了原位观察和分析。Reza等[48]开发出一种用于同时检测多个免疫检查点标志物的SERS标记微流控芯片,利用表面功能化的氧化石墨烯(GO)即修饰有纳米酵母单链抗体(NY-scFv)来捕获目标蛋白。交流电动力(AC-EHD)驱动流体增强混合效率,从而提高NY-scFv与目标蛋白的结合,同时减少非特异性作用。Choi等[99]报道了一个完全集成化的SERS微液滴芯片,用于鼠疫菌F1抗原的自动免疫分析。该系统包括液滴产生、传输、混合、合并和分裂模块,实现了快速、高效的免疫反应及无需洗涤的免疫分析。基于SERS的微滴平台检测鼠疫菌F1抗原的检测限为59.6 pg mL-1,比常规酶联免疫吸附试验灵敏度高约2个数量级。为了实现特定蛋白质或其他生物分子的分离和捕获,往往需要在芯片上集成复杂的通道或微器件等,Xiong等[28]报道了一种磁性纳米链集成的微流控芯片,该磁性纳米链不仅作为纳米级搅拌棒加速溶液混合,还可用作特定生物分离的捕获剂,磁性纳米链的引入简化了微芯片的平面设计(图9a),芯片仅由平坦的通道组成(图9b)。磁性纳米链上的抗体捕获和分离目标蛋白,再用SERS纳米探针进行信号转导,可同时用于检测多种蛋白(图9d)。另外芯片很容易被改进成多通道阵列(图9c),用于多样本的平行分析,大大改善了分析动力学。该体系已经实现了在8 min内对1L体液中的癌蛋白和细菌进行超灵敏的鉴定和定量。
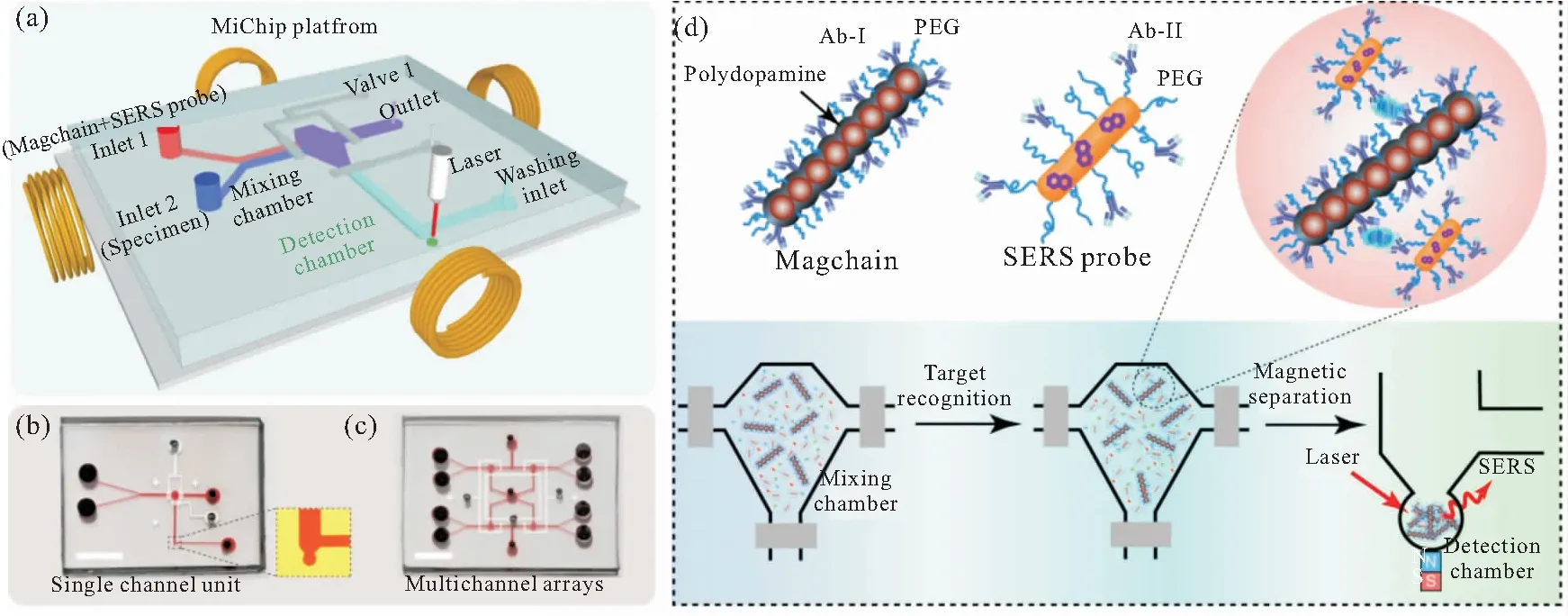
图9 (a)磁性纳米链集成的SERS微流控芯片的设计图;芯片实物图: (b)单通道和(c)多通道阵列,微通道中填充了红色染料(标尺:0.5 cm);(d)芯片用于检测癌蛋白的原理图[28]
Fig 9 (a)Schematic diagram of the magnetic nanochain integrated SERS microfluidic chip; photographs of the chip with (b) single channel and (c) multichannel arrays filled with a red dye(scale bar: 0.5?cm); (d) the mechanism for the detection of cancer proteins[28]
3.2 细胞分析
微流控SERS结合了微流控的微型高效自动化和SERS的高灵敏度等优势,在细胞分析领域有着许多重要的应用,如细胞捕获、分选、鉴定、定量分析、通信监测以及药物与细胞间相互作用检测等。
为了稳定地捕获细胞并保持细胞的活性,我们课题组采用交流介电泳(AC-DEP)微流控芯片装置,可以通过加电捕获细胞(如图10a所示)[45]。利用微流控SERS技术进行活细胞检测,实现了双氢青蒿素(DHA)对HeLa细胞作用和效果的定量分析与评估。实验采用DHA调控细胞表面叶酸受体表达,通过在微流控芯片中测量细胞SERS信号,确定在不同剂量DHA下纳米粒子分别进入正常细胞(293T)和HeLa细胞的数量,同时测量了不同药物剂量下细胞的存活率。另外,我们课题组还设计了一种具有微阱的微流控芯片[100](图10b-d),实现了单个细胞的分离与捕获,再进行SERS检测以得到进入HeLa细胞内的银纳米粒子数量,用MTT比色法测定细胞存活率,从而得到细胞毒性与进入细胞内的银纳米粒子数量的定量关系,同时也建立了一种基于微流控SERS技术分析银纳米颗粒对细胞毒性作用的方法。

图10 (a)交流介电泳微流控SERS系统装置图[45];(b)SERS微流控装置用于单细胞分析的装置图;(c) 通道中细胞流动及微阱捕获的微观图;(d) 微阱捕获单个细胞的过程[100]
Fig 10 (a)Schematic diagram of the microfluidic SERS platform based on AC-DEP for cell manipulation[45]; (b) the SERS microfluidic device for single-cell analysis; (c) microscopic image showing both the cells moving inside the microfluidic channel and the single cell trapped in the microfluidic well; (d) steps of trapping single cells in the micro-wells[100]
通过SERS微流控获得细胞信号并对细胞进行区分和鉴别,往往需要结合一种或多种化学计量法。Pallaoro等[101]将流动聚焦微流控通道与拉曼光谱相结合,实现了一定程度上癌细胞与正常细胞比例的测定。他们合成了连有亚甲基蓝或硫堇两种拉曼活性分子的银纳米二聚体,用PVP包裹后进行多肽修饰,作为两种生物拉曼探针(SBT)。NRP-SBT探针可靶向前列腺癌细胞上过度表达的神经毡蛋白-1(NRP),而作为对照的PC-SBT即可与正常细胞又与癌细胞作用。通过用SBT标记哺乳动物细胞并使其在流动聚焦的微流体通道中流动,可以通过激光拉曼快速地逐一检测细胞,经过简单的数据处理即可得到NRP/PC。在所得数据中偶尔会出现偏差较大的不可信的值,这可能是由于某个癌细胞的大部分都和NRP-SBT相连了。他们组在另一篇文章[102]中基于同样的方法,且结合了主成分分析和最小二乘法,用着两种分析方法对所得大量的SERS信号进行数据处理,提高了检测方法的可信度和可重复性,实现了在低浓度下对癌细胞和正常细胞的区分鉴别。Zhang Y等[103]将基于尺寸差分离细胞的微流控芯片与SERS光谱相结合,采得的多维谱图再根据数据分析方法进行简化,以实现细胞膜蛋白的原位分析以及循环肿瘤细胞(CTC)亚群的鉴定(图11)。在微流控芯片中,基于CTC和血细胞之间的大小差异,微流体过滤器将CTC从血液中分离出来。而采用的SERS探针是连接有不同的DNA适配体的Au@Ag纳米颗粒,以同时靶向细胞膜上不同的蛋白。为了简化复杂的SERS指纹谱,采用修正的经典最小二乘法以获得单个细胞的表型信息。最后,使用偏最小二乘法判别分析来精确分类不同亚型的细胞。基于微流控SERS系统,Cho等[104]为了实现更精准的鉴定,采用了五种拉曼活性分子对五种表面标记物进行编码,增加了谱图的维度和难度。对循环肿瘤干细胞(CCSC,一种稀有的CTC亚型细胞)和其他三种不同的CTC细胞进行了鉴定。Xu等[105]提出了一种将无标记SERS技术与软管状微流控技术相结合的动态SERS微流控检测细胞的平台。微流控芯片是由一个商业微软管嵌入到3D打印的模板中形成的,以一小段石英毛细管作为SERS检测区,银纳米星作为无标记的SERS基底。在样品流动状态下,对1株正常乳腺细胞系和2株乳腺癌细胞系的SERS光谱进行连续采集,最后采用K-最近邻(K-NN)算法对三种类型的细胞进行精确分类。

图11 基于尺寸差分离细胞的SERS微流控芯片用于CTCs的捕获、细胞表型分析和分类的流程图[103]
Fig 11 The flow diagram of operating on the platform for CTCs capture, profiling of cell phenotype, and classification based on the integrated system of size-based microfluidic cell isolation and multiple spectrally orthogonal SERS analysis[103]
微流控SERS分析细胞表达上具有重要应用,Dey等[106]提出了一种微流控SERS平台用于抗原特异性T细胞的分离和免疫表型分析。他们基于T细胞受体(TCR)和肽主要组织相容性复合物(pMHC)相互作用从复杂生物样品中分离抗原特异性T细胞,使用交流电EHD增强pMHC和TCR相互作用的频率,降低非特异性作用,再使用单点直流脉冲释放T细胞以便后续的检测。用SERS标记的pMHCs编码T细胞,以分析T细胞TCR表达的异质性,可以反映T细胞的活化状态或患者对免疫治疗的反应。这种方法在监测免疫状态、理解治疗应答和有效的疫苗开发等方面具有潜在的应用潜力。Willner等[107]使用微流控装置将单个前列腺癌细胞和小麦胚芽凝集素功能化的SERS纳米探针包裹在油包水液滴中,随后将其锁定在储存液滴的阵列中,用于光谱检测。通过快速检测获得粗糙谱图,随后针对有价值的癌细胞热点区域进行分析,以研究细胞间和胞内变异对细胞膜上聚糖表达的影响。
SERS微流控还被应用于细胞分泌物的检测,Sun等[108]提出将SERS微液滴芯片用于同时检测单个细胞分泌的两种细胞因子。他们利用抗原抗体特异性识别捕获目标物,免疫夹心法使Ag NPs靠近磁性纳米颗粒上的拉曼染料,触发SERS信号。磁场作用诱导了Ag NPs的自发聚集,增强SERS信号。除此之外,单个液滴包裹的细胞因子随着时间的推移积聚起来,进一步增强SERS信号。在单个液滴中检测单个细胞的血管内皮生长因子(VEGF)和白细胞介素-8(IL-8),检出限低至1.0 fg mL-1。另外,他们应用这种超灵敏的SERS微液滴芯片对单个液滴中多个细胞分泌的VEGF和IL-8进行了研究,结果表明,细胞与细胞间的相互作用可能通过VEGF和IL-8的上调促进癌细胞血管的生成。
3.3 疾病诊断
进一步,利用微流控SERS技术检测与疾病相关的生物标志物,可显著提高检测的灵敏度和选择性,减少了样品体积,降低检测时间,简化诊断过程,为疾病的早期诊断提供了新的方法。例如,Su等[109]设计并制作了一种集血液分离和原位检测为一体的SERS微流控芯片,用于临床血样血肌酐的快速检测。该SERS微流控芯片所需血样量少、可重复使用、操作方便且可回收利用,同时,在芯片上集成了多个微流控SERS单元,实现了对同一血液样本的平行检测或对不同血液样本的多路检测,为临床肾病的快速诊断提供一种新的方法。Cheng等[27]设计了一种电驱动SERS微流控平台(图12),用于长距离浓缩人血中的稀有病原体并进行快速检测。利用交流电场诱导介电泳和电流体力学的混合电动机制,使细菌可以集中在SERS活性粗糙电极上的停滞区,而血细胞则被排除在同心圆电极中心区域之外。该方法在3分钟内实现了细菌的分离和浓缩,密度因子增加了约1000倍。此外,在分离的细菌血症感染中发现的三种细菌,分别是金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌,在不到一分钟的时间内就被成功地鉴定出来,无需任何抗体或化学固定和反应过程。该方法的检出限为50L样品中的数百个细菌,约为103CFU mL-1。Lu等[110]制作的微液滴芯片可在3.5 h内采集58株金黄色葡萄球菌的17400 个SERS谱图,具备快速、高通量检测性能,并且基于SERS的偏最小二乘回归模型准确地测定耐甲氧西林金黄色葡萄球菌在含有甲氧西林敏感金黄色葡萄球菌的混合物中的浓度。该研究体现了SERS微流控系统在细菌感染检测和流行病学监测的优势。

图12 (a)实验装置图:SEM图像显示了中心电极表面粗糙的Au,采用交流电场诱导介电泳和电流体力学方法快速浓缩人血中的细菌,通过浓缩后细菌的SERS指纹图谱鉴定细菌;(b)在大范围不对称电极阵列上选择性浓缩目标细菌的原理图[27]
Fig 12 (a) Experimental setup of electrokinetic SERS microfluidic chip: the SEM image showing the roughened Au surface on the central electrode, AC electric field induced dielectrophoresis and electrohydrodynamics for rapid bacteria concentration from human blood, and SERS Raman spectroscopy of the concentrated bacteria for bacteria identification; (b) the mechanism of selective bacteria concentration over a wide range asymmetric electrode array[27]
SERS微流控芯片有望成为人体体液中生物标志物检测的有力工具,对临床诊断和人体健康评价具有指导意义。Wu等[111]采用SERS微液滴芯片对人血清和唾液中硫氰酸盐(SCN-)进行了定量分析,SCN-是人体健康评价系统中的重要生物标志物之一。他们选用具有较大SERS增强因子的金银核壳纳米棒(Au@Ag NRs)捕获体液中的SCN-,根据-C≡N伸缩振动产生的2100 cm-1拉曼峰强度进行定量。整个检测过程只需几分钟,实际样本只需几微升,人血清中SCN-的检测限为1M。此外,还可快速检测人唾液中的SCN-,该结果与是否吸烟以及烟龄相关。当检测的标志物为蛋白质一类如癌胚抗原,可采用抗体修饰的SERS基底捕获目标物,Li等[81]在此基础上又引入了抗体修饰的磁性纳米材料(图3d),通过磁场对捕获的目标物进行聚焦,进一步增强信号,癌胚抗原的检测限低至0.1 pM。癌症标志物的快速、有效检测有利于早期癌症筛查,而同时检测多种生物标志物对于提高癌症诊断的准确性具有重要意义。Gao等[112]设计了一种全自动SERS液滴微流控平台,用于同时检测两种前列腺癌标志物。以他们团队之前设计的用于检测鼠疫菌F1抗原的微液滴芯片为基础,增加了一个并行微流控通道,是为了在同一块芯片上同时进行两路检测。结果表明,在0.05 ~ 100 ng mL-1的范围内,两种PSA标志物均有良好的线性响应,检出限均在0.1 ng mL-1以下。Gao等[113]近期还报道了一个无泵SERS液滴微流控平台用于检测人血清中PSA标志物,通过芯片底部的毛细通道驱动液体流动,检测可在5 min内完成,无需人工孵育和沉重的注射器泵。结果表明,该芯片在0.01 ~ 100 ng mL-1范围内具有良好的线性响应,检出限在0.01 ng mL-1以下。
3.4 药物检测和筛选
SERS微流控芯片也为药物检测和筛选提供了一种快速、灵敏且高通量检测分析的手段。SERS微流控芯片可用于治疗药物监测,即分析治疗性药物在体液中的浓度以指导临床药物治疗的方法。血液中的游离药物是进行药物作用的有效部分,更容易与受体结合或被代谢。Zhang等[114]采用SERS微液滴芯片方法检测人血清中的一种抗癌药物6-硫鸟嘌呤,该装置在提高测定重复性方面具有优势,变异系数不超过5%(n=25),检测速度快,每次检测仅需10s。Wu等[33]设计的多功能微流控芯片可监测Hela细胞分泌物的动态变化以及Hela细胞对药物的免疫响应,从而用于药物筛选。SERS微流控芯片也被尝试用于体液中兴奋剂的检测,Gjergjizi等[115]设计了一种被动阀的微流控芯片,结合SERS以检测人血清中的黄体生成素(LH),极大地改善了传统LH检测方法耗时长、基质效应干扰等问题,不需要预制备、预富集和免疫催化反应等步骤。抗体修饰磁性金纳米粒子捕获LH,与4-氨基噻吩(4-ATP)标记的金纳米颗粒形成夹心免疫结构,通过记录4-ATP的SERS信号,可以探测血清中微量LH。Salemmilani等[78]报道了一种基于微流控介电泳诱导的SERS装置,它能在2分钟内检测唾液中冰毒的生理浓度,用主成分分析法(PCA)区分冰毒阳性样品和阴性对照样品。对唾液等体液中非法药物的快速检测,其在医疗保健和执法方面具有很大的实用价值。Kong等[55]采用由多孔光子晶体生物二氧化硅作为微流体通道的材料,构建了硅藻土微流控分析装置。该芯片可用作色谱,从复杂的生物流体样品中分离小分子,并对获得的目标化学品进行SERS检测。在与拉曼染料分子的混合样品中芘的检测限达到1 ppb,且该系统检测人血浆中的可卡因的检测限达到10 ppb。
3.5 环境健康与食品卫生
此外,与人类健康相关,环境和食品中的污染物如重金属、非法添加剂、滥用药物及细菌病毒等对人类的健康和社会秩序带来了严重威胁,SERS微流控系统也可用于检测环境和食品痕量污染物,可实现实时、现场的快速检测。近年来,人们也把SERS与微流控相结合应用于环境和食品检测方面[24]。例如,Wilson等[116]设计了具有被动混合阶段的微流体管道,在微流体反应器中原位合成胶体银,随后在管道中和分析物充分混合,进而检测待测物。他们将该装置用于检测伪枝藻素(蓝藻细菌的一种天然色素),检测限约10 pM。Bai等[117]在3D玻璃微流体通道中构建2D Cu-Au金属纳米点阵,实现超高灵敏度的SERS检测,可以实时检测水样中浓度低至10 ppb的Cd2+。Wang[118]利用SERS分子探针通过一步反应实现目标细菌的检测,采用两种SERS分子免疫探针同时识别病原体不同的表位。为了降低方法的检测限并实现现场检测,他们设计了一种纳米DEP微流体装置,用来富集水样中低浓度病原体,使得该方法的检测限达到了100CFU mL-1,远远低于DEP常用细菌浓度(>106CFU mL-1),因此可用于检测饮用水中的病原体。Galarreta等[119]在玻璃盖玻片表面通过电子束光刻金属纳米结构,并将其嵌入PDMS的微流体通道中,作为SERS平台,并用该系统对赭曲霉素A进行了定性检测。Kim等[120]在微流控芯片内通过纳米压印光刻法构建纳米柱阵列,将其作为SERS基底,结合便携式拉曼光谱仪可现场检测牛奶中的三聚氰胺。Dou等[121]用裸露的金纳米颗粒负载于微流控纸芯片上,选择性地增强猪毛发提取物中的β-受体激动剂的SERS信号,检测限可达ng mL-1级别。整个装置材料十分简易且便宜,也无需化学标记、纯化和分离,操作简单,有利于现场的及时检测和分析。Gao等[122]在微液滴芯片上实时生长银纳米颗粒,同时与另一个含有敌草快二溴化物(DQ)的液滴相混合,再进行SERS检测。使用这种可生成间断且流动的液滴的装置,其目的是避免因银纳米颗粒聚集在管壁上造成的记忆效应,该系统对水样中DQ的检测限达到了5 nM。
4 总结与展望
近年来,SERS与微流控技术相结合在生物医学、环境卫生、食品健康等领域得到了大量的实验应用和深入研究。但是,为了实现SERS微流控系统实用化和商业化的目标,微流控SERS技术还需要克服一些困难。目前,多数微流控SERS仍存在信号重复性低和被分析物污染的问题。尽管对微流控通道中连续流过的样品进行快速检测和平均化可提高SERS信号的重现性,但是金属胶体的布朗运动可引起的样品的随机聚集,仍然会引起SERS信号的不稳定。另外为了使金属胶体和分析物充分混合,需要设计复杂的微通道,这又可能会交叉污染和通道堵塞,也会带来记忆效应。这些缺陷阻碍了SERS微流控系统的实际应用。当前,研究者分别从微流控芯片和SERS两部分的设计上入手,寻找解决以上问题的方案。首先,要获得可靠的且重复性好的SERS信号,其关键还在于提高SERS活性基底的质量。另一方面,微流控系统可通过对胶体的可逆操控实现其在微流控通道中的可控聚集,从而提高SERS信号的的重现性。其次,关于芯片易被污染堵塞等问题,随着芯片制作材料、制作技术及加工手段等的进步,可以设计出成本极低的纸基芯片作为一次性芯片使用,或在通道中固定固体金属纳米阵列材料,从而避免因混合造成的交叉污染和通道堵塞,以及利用非连续流微液滴芯片来降低通道中的记忆效应。除此以外,为了提高SERS微流控芯片的检测性能如检测通量、灵敏度等,还可以设计可同时检测多个样品的微阵列芯片,以提高芯片的分析效率和通量。另外,利用SERS芯片的流体操控可以增强对分析样品的操纵和捕获能力,或应继续研发新型的SERS活性基底以提高样品的检测灵敏度。对于复杂样品,目标分析物与其它混合物的拉曼光谱可能有严重重叠,这时就需对目标物进行分离、富集等预处理,也可以通过改进芯片结构或功能来实现,例如,可通过各种微器件如微泵、微阀、微通道等相互配合达到样品预处理的功能。最后,对于多样品多参数问题、数据量大的情况,后期需要采用化学计量学方法、结合大数据和智能计算等方式,以此对数据结果进行准确分析。总之,我们相信,随着现代科学技术发展,SERS与微流控技术两者可以更好地结合在一起,将在生物医学应用领域中发挥重要作用。
