急性运动对人体唾液和尿液分泌型免疫球蛋白A的影响
2020-05-20刘志刚张朝会向家俊
刘志刚 ,张朝会 ,向家俊
(1.重庆三峡学院 体育与健康学院,重庆 404130;2.玉溪师范学院 体育学院,云南 玉溪 653100)
粘膜免疫系统(Mucosal immune system,MIS)是指广泛分布于呼吸道、消化道、泌尿生殖道粘膜下及一些外分泌腺如泪腺、唾液腺导管等粘膜部位的淋巴组织,是执行局部特异性免疫功能的主要场所,是机体整个免疫网络的重要组成部分。粘膜表面与外界抗原直接接触,是机体抵抗感染的第一道防线,在抗感染方面起着极为重要的作用。粘膜免疫系统同样包括体液免疫和细胞免疫两大类,并以体液免疫过程为主,即分泌抗体是粘膜免疫抵御外界抗原的主要方式。
分泌型免疫球蛋白A(Secretory Immunoglobulin A,SIgA)是由机体黏膜表面的B细胞分泌的抗体,大量存在于黏膜表面和黏膜分泌液中(如唾液、乳汁、泪液、痰液、消化液),是机体黏膜免疫的主要免疫球蛋白,对各种内源共生菌及外源入侵的病原体都有抵抗作用。且经抗原刺激后粘膜抗体 (以SIgA为主)比血清抗体出现的早,效价维持时间长,是机体非特异性免疫的第一道防线,在抵抗感染过程中具有极重要的作用[1-2]。SIgA由浆细胞产生,由J-链连接成二聚体的形式分泌至粘膜表面。当IgA通过粘膜或浆膜上皮细胞向外分泌时,与上皮细胞产生的分泌片(secretory component,SC)连接成完整的 SIgA,释放到分泌液中,与上皮细胞紧密连接在一起,分布在粘膜或浆膜表面发挥免疫作用。因此一个完整的SIgA分子通常有2个IgA单体,1条J链和1个分泌片构成。(图1)J链是一种酸性蛋白,含二硫键(-s-s-)连接的2个半胱氨酸残基以及IgA特定的分子残基。而SC则是多聚IgA的受体,能与IgA的亚甲基(-CH2-)之间以二硫键结合[3]。破坏该二硫键可以把SC从SIgA上分离下来。由于IgA单体有2个抗原结合位点,因此每个SIgA分子有4个抗原结合位点,即四价抗体。并介导吞噬细胞对病原或其他抗原的吞噬过程,从而起到对病原的免疫杀伤作用。(图2)通过SIgA介导的免疫过程可能是运动增强机体免疫力的机制之一。而国内有关的研究报道很少,本文以24名青年大学生为实验对象,研究不同强度单次急性运动干预下对人体唾液和尿液中SIgA的变化。
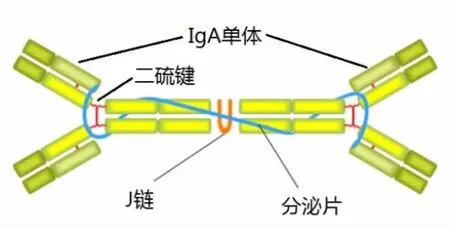
图1 SIgA(二聚体)结构示意图
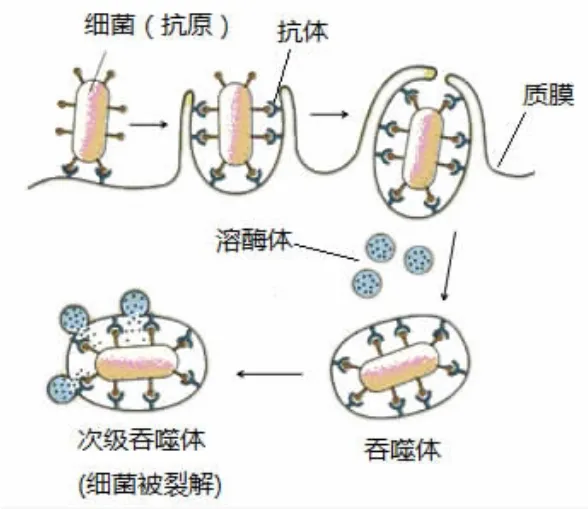
图2 抗体介导的吞噬细胞吞噬抗原过程
1 实验方案
1.1 实验对象及分组
24名男性在校二年级大学生,年龄19±0.5岁,身高170±3cm,体重60±5kg,随机分为低强度运动组(low intensity exercise group,LIE)、中等强度运动组(moderate intensity exercise group,MIE)、 高 强 度运动组 (high intensity exercise group,HIE),并以这3组受试者运动前安静状态下的唾液和尿液SigA含量作为基准值对照。
1.2 运动方案
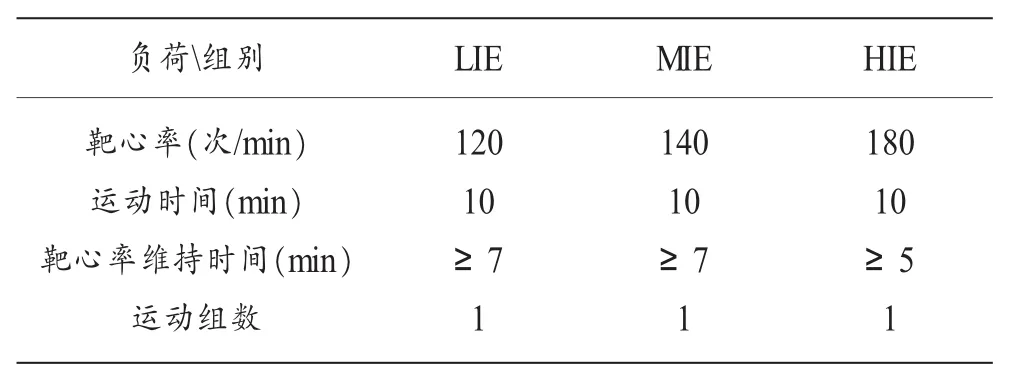
表1 各组受试者运动方案
如表1所示,低强度运动:靶心率设定为120次/min,受试者运动持续10min,靶心率维持时间≥7min;中等强度运动:靶心率设定为140次/min,受试者运动持续10min,靶心率维持时间≥7min;高强度运动:靶心率设定为≥180次/min,受试者运动持续10min,靶心率维持时间≥5min。运动在标准塑胶田径场以跑步的形式进行,每组8人。测试在上午10:00~11:00,早餐后2h进行。以减少消化系统对运动的影响。测试点海拔1 700m,环境温度25℃,湿度60%,天气晴朗,微风。对受试者进行基础培训,以蓝牙心率带和心率表监测运动中心率变化,并嘱咐其尽可能地把运动心率维持在靶心率附近。
1.3 标本采集和测试
在运动前5min采集每组受试者自然分泌的唾液和前段尿各1mL,标记后立即置于-20℃冰盒中保存。待完成运动方案后,即刻再次采集受试者自然分泌的唾液和前段尿各1mL(MIE、HIE组运动完毕唾液分泌减少,采集有困难者,允许其闭口主动用力吮吸促进唾液分泌,以达到唾液采集量要求)。标记后于-20℃冰盒中保存待测。
1.4 主要测试仪器
酶标分析仪(Rayto RT-6100,美国产);
高速冷冻离心机(赛特湘仪GL-2050MS,中国产);
移 液 器 (Eppendorf 0.5-10uL、2-20uL、20-200uL、200-1000uL,德国产);
-20℃冰箱(美的BCD-231WTM,中国产);
37℃恒温箱(北京福意FYL-YS-150L,中国产);
蓝牙心率表(POLAR RC3 GP,芬兰产);
运动秒表(CASIO HS-80TW,日本产)。
2 测试过程
2.1 测试方法和原理
采用上海江莱生物提供的人分泌型免疫球蛋白A(SIgA)酶联免疫吸附测定试剂盒,在Rayto RT-6100酶标分析仪上进行。实验原理:采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。往预先包被人分泌型免疫球蛋白A(SIgA)捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的人分泌型免疫球蛋白A(SIgA)呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
2.2 试剂盒性能
检测范围:1.5μg/mL~48μg/mL。
灵敏度:最低检测浓度小于0.1μg/mL。
特异性:不与其它可溶性结构类似物交叉反应。
重复性:板内变异系数小于10%,板间变异系数小于15%。
2.3 测试步骤
1)提前20min从冰箱中取出试剂盒,平衡至室温。
2)从室温平衡20min后的铝箔袋中取出微孔酶标板条,剩余板条用自封袋密封放回4℃。
3)设置标准品孔和样本孔,标准品孔各加不同浓度的标准品 50μL。
4)样本从冰箱取出后平衡至室温 20℃,1 000g离心20min取上清待测。
5)样本孔中加入待测样本50μL;空白孔不加。
6)除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100μL,用封板膜封住反应孔,37℃恒温箱温育60min。
7)弃去液体,吸水纸上拍干,每孔加满洗涤液(350μL),静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。
8)每孔加入底物 A、B 各 50μL,37℃避光孵育 15min。
9)每孔加入终止液 50μL,15min内,在 450nm波长处测定各孔的OD值。
2.4 利用标准曲线和回归方程计算结果
在Excel工作表中,以标准品浓度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本SIgA含量。
3 测试结果
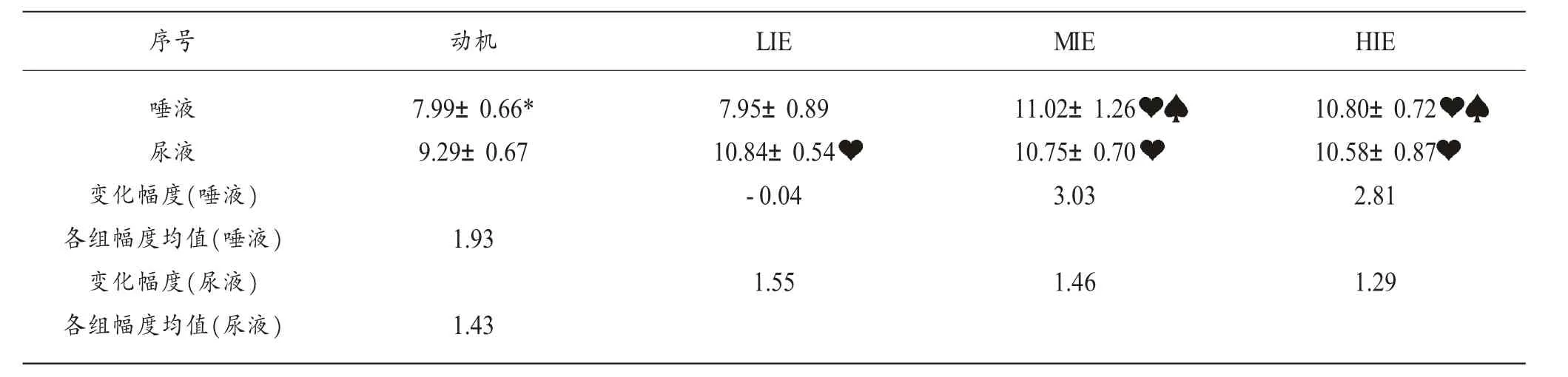
表2 各组唾液和尿液SIgA运动后变化情况
唾液各组数据进行正态性检验 (Normality Test,p=0.847>0.05)和方差齐性检验(Equal Variance Test,p=0.287>0.05),具备方差分析条件,进行单因素方差分析。唾液SIgA含量与基准 值 (95%CI,7.57-8.41) 比 较 ,MIE 组 极 显 著 升 高 (p<0.001,95%CI,9.02-13.02),HIE 组极显著升高 (p<0.001,95%CI,9.66-11.95),LIE 组无显著性差异 (p=0.918>0.05,95%CI,6.53-9.36);与 LIE 组比较,MIE 组极显著升高(p<0.001),HIE组极显著升高(p<0.001);与 MIE组比较,HIE组无显著性差异(p=0.711>0.05)
尿液各组数据进行正态性检验 (Normality Test,p=0.270>0.05)和方差齐性检验(Equal Variance Test,p=0.877>0.05),具备方差分析条件,进行单因素方差分析。尿液SIgA含量与基准值 (95%CI,8.86-9.72)比较,LIE 组(p=0.001<0.01,95%CI,9.98-11.69)、MIE 组 (p=0.002<0.01,95%CI,9.63-11.86)、HIE组 (p=0.004<0.01,95%CI,9.20-11.95) 全部具有极显著性差异,LIE 组与 MIE 组 (p=0.852>0.05)、LIE 组与 HIE 组 (p=0.598>0.05)、MIE 组与 HIE 组(p=0.732>0.05)之间无差异显著性。
唾液基准值与尿液基准值2组数据进行T检验比较,尿液SIgA基准值显著高于唾液SIgA基准值(p=0.002<0.01)
4 讨论
多数学者的研究显示,急性或长期的中低强度运动对细胞免疫和体液免疫有促进作用,而大强度运动则可能会通过氧化应激[4-5]、免疫细胞凋亡[6]、激素分泌(糖皮质激素、儿茶酚胺、促肾上腺皮质激素、促肾上腺皮质激素释放激素、生长抑素)、T细胞亚群 Th/Ts改变和细胞因子 TGF-β、IL-10、IL-35表达增加倾向于抑制机体的免疫能力[7-10]。
而运动同样会显著影响机体的粘膜免疫能力。粘膜免疫作为人体免疫的第一道屏障,对预防外源性感染起着十分重要的作用。其中比较常见的是急性上呼吸道感染 (upper respiratory tract infection,URTI)。研究发现大强度运动使运动员患URTI几率上升,不仅与大强度运动抑制体液免疫和细胞免疫有关,与运动导致的粘膜免疫变化同样关系密切,而体液免疫又是粘膜免疫的主要形式。表2结果显示,单次急性低强度运动对唾液SIgA无显著影响,而急性中等强度和急性大强度运动均显著提高受试者唾液SIgA含量。与MIE组相比,HIE组受试者唾液SIgA有降低的趋势,虽不具有显著性差异,但根据运动免疫的已有理论,推测运动强度与唾液SIgA水平仍可能存在一个类似“倒U型”的关系,这也意味着单次大强度运动可能会增加粘膜免疫抑制的风险。
单次急性低、中、高强度运动均显著提高尿液SIgA含量。但与唾液不同的是,尿液SIgA升高的幅度,随运动强度增大而减少,但LIE、MIE和HIE之间同样无统计学差异。与各自的基准值来看,尿液SIgA基准水平高于唾液,但运动后各组的变化幅度小于唾液,这可能是由于尿从肾脏生成经过输尿管、膀胱、尿道排出体外的路径较长,而膀胱的内表面也比较大,尿液与粘膜的接触面积和接触时间大于唾液,所以尿液SIgA基准值高于唾液。但尿的生成量远大于唾液的分泌量,导致尿液中对SIgA水平变化敏感度低于唾液,致使运动干预后尿SIgA变化幅度小于唾液SIgA,因而急性运动导致唾液SIgA变化的灵敏度高于尿液。
大强度运动会造成机体炎性因子IL-1、TNF-α上调,同时使抗炎性因子IFN-γ下调从而导致炎症反应[9,11]和唾液皮质醇水平增加[12],这可能是造成尿液SIgA增加的幅度随运动强度增加下降和唾液SIgA水平与在HIE组回落的原因之一。表2显示,单次低强度运动仍然对尿液SIgA变化产生了显著影响,但低强度运动对唾液SIgA却影响甚微。低强度运动对唾液和尿液SIgA造成不同影响的原因还不是很清楚。推测口腔接触的抗原数量和种类远大于输尿管、膀胱和尿道,可能会导致输尿管、膀胱和尿道的免疫敏感性高于口腔,使尿路粘膜免疫在运动导致的炎症反应中应答比较敏感而明显。运动加剧了物质和能量代谢,尿液中含有机体绝大部分的可溶性代谢废物,而某些代谢物可能具有致炎作用,以及支配3大唾液腺的交感和副交感神经在运动中的兴奋变化也会导致唾液SIgA和唾液皮质醇水平的波动[13],可能是造成唾液和尿液SIgA对低强度运动有不同反应的原因之一。口腔与大气环境相通,受高原低氧刺激也远比输尿管、膀胱和尿道更直接。本测试是在海拔1 700m左右亚高原地区进行,受试大学生均在当地居住时间大于1年,可以认为受试者对测试区高原环境产生了习服。即便这样,低氧刺激仍可能对粘膜SIgA分泌产生影响[14]。低氧训练可致使大鼠肠道SIgA分泌减少[15],说明高原低氧环境对粘膜免疫可能具有负性调节作用,也可能是唾液SIgA在低强度运动干预下变化显著低于尿液的原因。
测试结果显示,无论低强度、中强度还是高强度急性运动,都没有表现出明显的粘膜免疫抑制作用。由于普通人群难以维持长时间的高强度运动,HIE组靶心率持续时间仅为5min,这可能是导致单次大强度运动下未出现明显的粘膜免疫抑制现象的原因之一[16]。本研究未对其他免疫指标进行测试,因此评估粘膜免疫功能仍缺乏足够证据。但可以肯定的是,单次急性运动可以显著提高人体唾液和尿液SIgA水平,而低水平的唾液SIgA和URTI发生有密切关系[17]。
5 结论
单次中、高强度急性运动显著增加受试者唾液SIgA水平;单次低、中、高强度急性运动显著增加受试者尿液SIgA水平;急性运动可以对人体粘膜免疫机能造成显著影响,且短时间低、中、高强度急性运动未发现显著的粘膜免疫抑制现象。
