硫化氢通过JAK2/STAT3通路抑制脂多糖诱导的小胶质细胞M1型极化
2020-05-20刘剑锋陈杉杉冯伟周寿红
刘剑锋 陈杉杉 冯伟 周寿红
神经炎症是参与儿童缺氧性脑病发病机制的重要环节[1]。小胶质细胞是介导神经炎症的主要功能细胞。研究结果显示在儿童缺氧性脑病中存在小胶质细胞异常激活[2]。激活的小胶质细胞有两种极化类型,M1型极化有促炎和神经毒性作用,而M2型极化则有抗炎和促进组织修复作用[3]。脂多糖(lipopolysaccharide,LPS)是导致小胶质细胞激活的经典刺激物[4]。蛋白酪氨酸激酶(protein tyrosine kinase 2,JAK2)/信号转导和转录激活因子(signal transducer and activator of transcription 3,STAT3)是调控小胶质细胞极化重要的信号转导通路[5-6]。硫化氢(hydrogen sulfide,H2S)被称为第三种气体信号分子[7],在全身各器官系统均有广泛的分布。H2S生理作用广泛,参与了许多疾病的发生发展[8]。研究发现H2S可通过抑制神经炎症而发挥神经保护作用[9],但其对LPS诱导的小胶质细胞极化介导的神经炎症是否具有调控作用尚不清楚。本研究采用硫氢化钠(sodium hydrogen sulfide,NaHS)作为H2S的供体,观察H2S对LPS诱导的小胶质细胞极化的影响,并从JAK2/STAT3信号通路的角度探讨H2S抗神经炎症的机制。
1 材料和方法
1.1 主要药品与试剂小鼠源性小胶质细胞系N9小胶质细胞购自上海斯信生物科技有限公司;MEM(minimum eagle’s medium)培养基购自美国Invitrogen技术有限公司;胎牛血清购自中国杭州四季青生物科技公司;胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(DMSO)、LPS、 NaHS、JAK2/STAT3信号通路特异性拮抗剂α-氰基-(3,4-羟基)N-苄苯乙烯胺〔α- cyano-(3,4-hydroxy)n-benzylstyramine,AG-490〕为美国Sigma公司产品;BCA法蛋白定量试剂盒购自美国Pierce公司;兔抗小鼠诱导型一氧化氮合酶(inducible nitric oxide synthetase,iNOS),精氨酸 酶1(arginase 1,Arg1),JAK2、STAT3、p-JAK2、 p-STAT3单克隆抗体,β-actin一抗以及相应二抗均为美国Santa Cruz公司产品。
1.2 细胞培养和分组采用MEM培养基〔含5%(体积分数)胎牛血清〕培养N9小胶质细胞,置37℃、5%(体积分数)CO2及饱和湿度的细胞培养箱中培养。细胞呈贴壁生长,隔天换液,细胞生长融合度达70%左右时用0.5%胰酶(质量浓度)消化后进行传代,以对数生长期的细胞用于实验。将培养的细胞分为6组:(1)LPS组:以2 mg/L LPS处理细胞6 h;(2)NaHS组:以500 μmol/L NaHS处理细胞6.5 h;(3)LPS+NaHS组:先用500 μmol/L NaHS处理N9小胶质细胞0.5 h,再加入2 mg/L LPS处理6 h;(4)AG-490组:以100 μmol/L AG-490处理细胞7 h;(5)LPS+NaHS+AG-490组:先用100 μmol/L AG-490处理N9小胶质细胞0.5 h,加入500 μmol/L NaHS处理0.5 h,再加入2 mg/L LPS处理6 h;(6)对照组。每组设3个复孔。
1.3 方法
1.3.1MMT法检测细胞活力:各组细胞经培养和相关干预因素处理后,吸除培养液,以PBS清洗3次,每个培养孔加入20 μL MTT工作液继续孵育4 h,然后再加入150 mL DMSO溶液。将细胞培养板放置于摇床上,振动摇晃10 min。采用酶标仪测量570 nm处吸光度值。
1.3.2ELISA法检测炎症因子水平:各组细胞经培养和相关干预因素处理后,经胰酶消化,离心收集细胞,采用超声裂解细胞,制备细胞匀浆。采用ELISA法检测细胞匀浆上清中白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-4、IL-10水平,以μg/g蛋白表示。
1.3.3Western-blot检测总蛋白水平:提取各组细胞总蛋白,采用BCA法定量总蛋白浓度。将总蛋白样品添加至加样缓冲液中,用电炉烧开煮沸,使蛋白质完全充分变性。通过聚丙烯酰胺凝胶电泳方法将已完全变性的蛋白质分离,再通过电转移方法将蛋白质转移至聚偏氟乙烯(polyvinyl fluoride,PVDF)膜上。为阻断非特异性抗原,将PVDF膜与5%(质量浓度)脱脂牛奶在室温下孵育2 h。加入兔抗小鼠JAK2(1∶400)、STAT3(1∶200)、p-JAK2(1∶300)、p-STAT3(1∶300)和β-actin(1∶300)一抗,4 ℃过夜。采用TBST液清洗PVDF膜3次,然后加入二抗,继续在4 ℃条件下孵育4 h,以TBST液清洗PVDF膜3次。经曝光、显影、定影后,采用图像分析软件对胶片进行扫描,核蛋白的检测以组蛋白为内参照,其他以β-actin作为内参照,对目的蛋白表达水平进行半定量分析。
1.4 统计学处理采用SPSS 20.0统计软件进行分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差表示,多组均数间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 NaHS抑制LPS诱导的小胶质细胞M1型极化对照组、LPS组、NaHS组和LPS+NaHS组细胞Arg1和iNOS蛋白表达水平比较差异均有统计学意义(F=12.11,P<0.05;F=10.37,P<0.05)。与对照组比较,LPS组细胞Arg1蛋白表达下调(P<0.05),而iNOS蛋白表达上调(P<0.05);与LPS组比较,LPS+NaHS组细胞Arg1蛋白表达上调(P<0.05),而iNOS蛋白表达下调(P<0.05)。结果见图1~2。
对照组、LPS组、NaHS组和LPS+NaHS组细胞及培养上清液中IL-4、IL-10、IL-1β和IL-6水平比较差异有统计学意义(均P<0.05)。与对照组比较,LPS组细胞及培养上清液中IL-4和IL-10水平降低(均P<0.05),而IL-1β和IL-6水平增加(均P<0.05);与LPS组比较,LPS+NaHS组细胞及培养上清液中IL-4和IL-10水平增加,而IL-1β和IL-6水平降低(均P<0.05)。结果见表1。

注:Arg1:精氨酸酶1,iNOS:诱导型一氧化氮合酶;图2、5~6同。LPS:脂多糖,NaHS:硫化氢;图2~6、表1~2同 图1 不同处理条件下N9小鼠小胶质细胞Arg1和iNOS蛋白表达电泳图(Western-blot法) 注:与对照组比较,aP<0.05;与LPS组比较,bP<0.05 图2 不同处理条件下N9小鼠小胶质细胞Arg1和iNOS蛋白表达比较(Western-blot法)
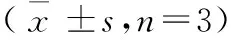
表1 各组N9小鼠小胶质细胞及培养上清液中炎性因子水平表达比较

组别小胶质细胞(μg/g蛋白)IL-1βIL-6 IL-4IL-10对照组18.37±1.5423.16±3.2924.36±3.2364.34±4.93LPS组43.52±6.37a51.33±4.81a10.22±2.42a22.81±3.54aNaHS组17.05±2.7121.04±3.0625.73±3.1668.11±7.06LPS+NaHS组27.79±3.62b30.23±3.87b21.82±2.43b53.96±5.17bF值12.139.6313.7612.33P值<0.05<0.05<0.05<0.05组别培养上清液(pg/mL)IL-1βIL-6IL-4IL-10对照组9.12±0.6514.13±1.5817.89±2.0437.69±3.22LPS组34.76±1.24a43.76±1.94a5.31±0.69a15.94±1.02aNaHS组10.24±1.1112.96±0.8719.84±2.7439.07±3.57LPS+NaHS组15.37±0.86b19.86±2.23b13.88±1.56b30.94±2.91bF值15.8816.7212.3917.03P值<0.05<0.05<0.05<0.05
注:IL:白细胞介素,表2同;与对照组比较,aP<0.05;与LPS组比较,bP<0.05
2.2 LPS和NaHS对小胶质细胞JAK2和STAT3表达的影响对照组、LPS组、NaHS组和LPS+NaHS组细胞p-JAK2(F=9.67,P<0.05)和p-STAT3(F=10.83,P<0.05)表达及p-JAK2/t-JAK2(F=11.37,P<0.05)和p-STAT3/t-STAT3比值(F=8.49,P<0.05)比较差异均有统计学意义,而t-STAT3蛋白表达水平差异无统计学意义(F=0.71,P>0.05)。与对照组比较,LPS组细胞p-JAK2和p-STAT3蛋白表达以及p-JAK2/t-JAK2和p-STAT3/t-STAT3比值均明显升高(均P<0.05);与LPS组比较,LPS+NaHS组细胞p-JAK2和p-STAT3蛋白表达以及p-JAK2/t-JAK2和p-STAT3/t-STAT3比值均降低(均P<0.05)。结果见图3~4。
2.3 JAK2/STAT3通路抑制剂AG-490对NaHS作用的影响对照组、AG-490组、LPS+NaHS组、LPS+NaHS+AG-490组细胞Arg1(F=8.33,P<0.05)和iNOS(F=10.21,P<0.05)蛋白表达及IL-4、IL-10、IL-1β、IL-6水平比较差异均有统计学意义(均P<0.05)。与LPS+NaHS比较,LPS+NaHS+AG-490组细胞Arg1蛋白表达及IL-4和IL-10水平下调,而iNOS蛋白表达及IL-1β和IL-6水平上调(均P<0.05)。结果见图5~6、表2。
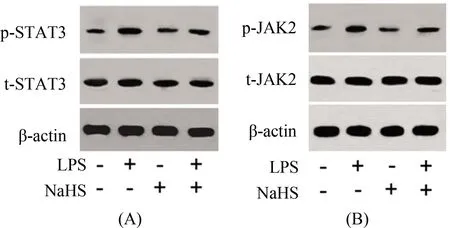
注:STAT3:信号转导和转录激活因子,p-STAT3:磷酸化STAT3,t-STAT3:总的STAT3,JAK2:蛋白酪氨酸激酶,p- JAK2:磷酸化JAK2,t-JAK2:总的JAK2;图4同 图3 不同处理条件下N9小鼠小胶质细胞STAT3和JAK2蛋白表达电泳图(Western-blot法)
2.4 细胞活力和细胞形态观察对照组、LPS组、NaHS组、AG-490组细胞活力分别为0.87±0.04、0.85±0.07、0.90±0.12和0.89±0.11,各组间细胞活力比较差异无统计学意义(F=0.43,P>0.05)。对照组小胶质细胞呈分支状,经LPS处理后小胶质细胞突起变短,呈现阿米巴样,而NaHS和AG-490处理均未影响细胞形态(结果未显示)。

注:AG-490:α-氰基-(3,4-羟基)N-苄苯乙烯胺,图6、表2同 图5 不同处理条件下N9小鼠小胶质细胞Arg1和iNOS蛋白表达电泳图(Western-blot法) 注:与LPS+NaHS组比较,aP<0.05 图6 不同处理条件下N9小鼠小胶质细胞Arg1(A)和iNOS(B)蛋白表达比较(Western-blot法)


组别小胶质细胞(μg/g蛋白)IL-1βIL-6 IL-4IL-10对照组17.82±2.4124.97±2.525.06±3.4461.38±5.93AG-490组16.16±1.1925.32±4.0723.06±1.8157.32±6.45LPS+NaHS组26.57±3.6233.12±3.8719.08±2.4348.22±5.17LPS+NaHS+AG-490组38.68±5.16a50.16±5.37a13.77±2.55a31.93±2.49aF值15.3916.7414.2812.47P值<0.05<0.05<0.05<0.05组别培养上清液(pg/mL)IL-1βIL-6IL-4IL-10对照组10.92±0.8615.07±1.3318.94±1.5836.11±4.07AG-490组9.34±1.1514.85±1.7719.63±2.3137.71±2.97LPS+NaHS组16.82±2.0618.93±1.6714.55±1.3929.51±3.18LPS+NaHS+AG-490组30.55±2.83a39.57±3.61a6.17±0.78a17.94±1.68aF值13.7115.0315.7613.29P值<0.05<0.05<0.05<0.05
注:与LPS+NaHS组比较,aP<0.05
3 讨论
H2S在机体内有两种形式,即NaHS和H2S。在液体环境中H2S和NaHS可以保持一种动态平衡[10]。由于NaHS比H2S更容易维持溶液中稳定的H2S浓度,因此被用作H2S的供体[11]。H2S在神经系统、心血管、肾脏和肝脏等组织器官中均有大量分布。近年来有关H2S的神经保护作用备受人们的关注[12],特别是对神经炎症的抑制作用方面。Cao等研究发现H2S通过抑制STAT3和组织蛋白酶S的激活而抑制ATP诱导的神经炎症和Aβ1-42的合成[13]。Ghanbari等研究也表明H2S可通过抑制神经炎症抑制甲基苯丙胺对海马神经元的神经毒性[14]。
介导神经炎症的重要功能细胞是小胶质细胞,由于小胶质细胞具有异质性,因而具有不同的极化功能表型[3]。M1型极化小胶质细胞具有促炎反应,分泌肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、IL-1β、IL-6、IL-12和趋化因子-2等促炎细胞因子。在M1反应表型下,小胶质细胞也表达iNOS,将Arg转化为一氧化氮,因此iNOS也成为小胶质细胞M1型极化的标志物。而M2型极化小胶质细胞具有抗炎作用,可分泌IL-4、IL-10和转化生长因子-β(transforming growth factor-beta,TGF-β)等抗炎细胞因子,同时可诱导Arg1表达,促进精氨酸转化成多巴胺,Arg1也成为小胶质细胞M2型极化的标志物[15]。两种小胶质细胞极化表型之间的平衡在神经炎症的发展进程中发挥关键作用。H2S对小胶质细胞极化具有调控作用。Du等研究发现,鱼藤酮可能通过触发ROS的形成、抑制CBS-H2S途径从而促进小胶质细胞向M1炎症表型分化[16]。Zhang等研究结果亦表明胱硫醚β-合酶/H2S途径参与脑缺血后小胶质细胞介导的神经炎症[17]。本研究结果显示,H2S可明显降低LPS诱导的小胶质细胞中Arg1蛋白及IL-4和IL-10表达水平,而增加iNOS蛋白及IL-1β和IL-6表达水平,提示H2S可抑制LPS诱导小胶质细胞的M1型极化,进而可能抑制神经炎症。
小胶质细胞极化的调控涉及到多条信号通路。近年来研究显示JAK2/STAT3信号通路在小胶质细胞极化的调控中发挥重要作用[18]。JAK/STAT信号通路由JAK和STAT两大家族组成,JAK家族是一组蛋白酶,由JAK1-3和TYK2组成;STAT家族是位于染色体内的一组转录因子,由STAT1-4,STAT5a、b和STAT6组成,是JAK的下游底物,每个成员由750~850个氨基酸组成[19]。JAK2/STAT3信号通路是JAK/STAT信号通路的重要成员,参与细胞的增殖与分化、细胞凋亡以及免疫反应等生理过程。当胞外的信号分子与其膜上的受体识别并结合后,可诱导产生JAK2结合位点。JAK2与之结合后,诱导其发生磷酸化,从而暴露STAT3的结合位点。当STAT3与JAK2结合后可导致STAT3磷酸化并发生核转移,入核后对靶基因的表达进行调控。因此JAK2和STAT3磷酸化水平可反映JAK2/STAT3信号通路的激活状况。研究发现,炎症可导致JAK2/STAT3信号通路的激活[20-21],而H2S对JAK2/STAT3信号通路具有调控作用[22-23]。本研究结果显示,LPS可明显增加小胶质细胞中p-JAK2和p-STAT3蛋白表达,提高p-JAK2/t-JAK2和p-STAT3/t-STAT3比值,而NaHS可逆转这种变化,进一步采用AG-490抑制JAK2/STAT3通路发现H2S抑制神经炎症的作用被减弱,提示H2S可抑制LPS诱导的JAK2/STAT3信号通路的激活,这可能是H2S发挥抑制神经炎症作用的机制。
综上所述,本研究结果显示,H2S可抑制LPS诱导的小胶质细胞M1型极化,其机制可能是通过抑制JAK2/STAT3信号通路激活实现。
