淹水胁迫对不同基因型东方杉幼苗生理生化的影响
2020-05-20潘雅楠沈永宝尹中明
潘雅楠, 沈永宝, 尹中明, 宋 明, 金 政
(1.南京林业大学南方现代林业协同创新中心, 江苏 南京 210037;2.上海市林业总站, 上海 200072; 3.上海市崇明区林业站, 上海 202150)
水分作为植物的主要核心成分,在植物的整个生命过程中起着重要作用。植物对水分的需求因树种或品种的不同存在较大差异。水分过多(涝害)或过少(干旱)都会对植物的生长造成影响甚至伤害[1-2]。我国地域辽阔,大多为季风性气候,夏季台风频发,导致我国涝灾的经常性发生,给农业生产造成了极大的损失[3-4]。
淹水胁迫下,植物一方面承受着胁迫伤害带来的外部形态上的变化,如叶片枯黄、萎蔫脱落甚至死亡、生物量减少、苗高地径的相对增长量减小、根系活力降低等[5],内部生理上如细胞膜遭到破坏及光合作用减弱等[6];而另一方面植物又通过调整其生化因子以维持植物的生长与发育,如植物内部可通过调节保护酶系统[7]和渗透调节物质增强植物的适应能力[8]。研究淹水胁迫对植物的影响,了解植物的抗涝性,选育耐淹能力强的树种或品种用于沿海沿江及涝渍灾害频发地区的防护建设,对改善当地生态环境,促进农林业的健康可持续发展具有重要意义[9]。
东方杉(Taxodiummucronatum×Cryptomerafortunei)是我国在20世纪70年代以墨西哥落羽杉为母本、日本柳杉为父本培育而成的杉科落羽杉属新树种,是中国特有的树种[10],在南京、上海、武汉等地都有栽培种植。东方杉具有生长快、休眠期短、抗病虫害能力强、耐盐碱及耐水湿等优点[11]。目前,对东方杉的众多研究主要集中于东方杉的形态特性及育苗栽培方面,对东方杉淹水抗逆性方面的研究较少。本试验以东方杉2种基因型DFS 01和DFS 02的一年生容器苗为材料,研究东方杉2种基因型在淹水条件下生理生化特性,为抗涝无性系选育提供参考。
1 材料与方法
1.1 试验材料与设计
试验材料为上海林业总站宝山基地2017年夏季扦插,2018年春季切根移植的一年生容器苗(20 cm×20 cm的无纺布袋)。2018年9月中旬移至南京林业大学温室,环境温度控制在25 ℃。对苗木进行正常的水肥管理。10月初,挑选DFS 01和DFS 02基因型中长势一致的苗木各20株,设置对照(ck)与淹水处理(F),每个处理重复3次,试验采用“双套盆法”,将苗木连同无纺布袋一起放入注水(清水)容器中,淹水深度超过土壤表面5 cm。在试验开始的0 d、15 d、30 d、45 d、60 d、75 d及90 d进行叶片采样,采回样品一部分用于叶绿素及质膜透性的测定,其余样品放入-80 ℃冰箱中备用。
1.2 测定方法
叶绿素采用乙醇丙酮1∶1混合法;丙二醛(MDA)使用硫代巴比妥酸法;POD活性采用愈创木酚比色法;SOD活性采用氮蓝四唑法;脯氨酸采用酸性茚三酮法;可溶性蛋白采用考马斯亮蓝溶液法;可溶性糖含量的测定采用蒽酮比色法[12]。
1.3 数据处理
实验数据采用SPSS 24.0软件进行方差分析和Excel软件进行数据的计算、统计和图表的绘制。
2 结果与分析
2.1 淹水胁迫对叶绿素含量的影响
淹水胁迫条件下DFS 01和DFS 02基因型叶绿素含量的变化趋势如图1所示。DFS 01和DFS 02基因型的叶绿素总体上均呈下降趋势,但是2种基因型之间的叶绿素含量的变化趋势存在着差异性。淹水0~30 d时对照与淹水之间的差异较小,表明短期淹水对东方杉2种基因型的影响较小,叶绿素并没受到较大的影响,但30 d后2种基因型的叶绿素含量均大幅下降,而DFS 02基因型在60 d时叶绿素含量有小幅的上升,淹水90 d时,2种东方杉基因型的叶绿素含量分别为对照的33.54%和30.31%。 DFS 01基因型的叶绿素含量下降幅度最低,说明DFS 01基因型对淹水具有较强的适应性。
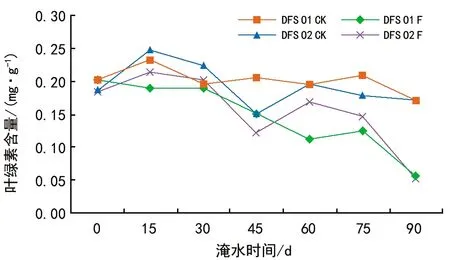
图1 淹水胁迫对DFS 01和DFS 02基因型叶绿素含量的影响
方差分析表明,东方杉2种基因型叶绿素含量之间的差异并不显著,不同处理、不同胁迫时间之间的差异达极显著水平(p<0.01),时间与处理之间的交互作用对叶绿素含量的影响达极显著水平。
2.2 淹水胁迫对质膜透性和MDA含量的影响
逆境条件下,相对电导率、丙二醛(MDA)含量的大小通常被用来反映质膜透性的大小,反映植物受胁迫伤害的程度。由图2可知,DFS 01和DFS 02基因型的质膜透性总体上呈增长趋势,但具体变化存在差异,淹水0~30 d时,DFS 01和DFS 02基因型的相对电导率与对照之间差异不显著,淹水45~75 d时,DFS 01和DFS 02基因型的相对电导率均表现为上升趋势,在75 d相对电导率达最大值,与对照相比增幅分别为42.35%和53.90%。淹水90 d时相对电导率均下降,但仍高于对照。表明在淹水前期DFS 01、DFS 02基因型细胞膜受到胁迫的影响较小,质膜的完整性并未遭到较大的破坏,淹水90 d时DFS 01和DFS 02基因型的质膜透性分别是对照的32.46%、32.89%。
方差分析表明,DFS 01和DSF 02基因型之间质膜透性的差异并不显著,不同处理、不同胁迫时间之间均达极显著差异水平。基因型与处理之间的交互作用对质膜透性的影响达显著水平,基因型与时间、处理与时间之间的交互作用对质膜透性的影响达极显著水平。
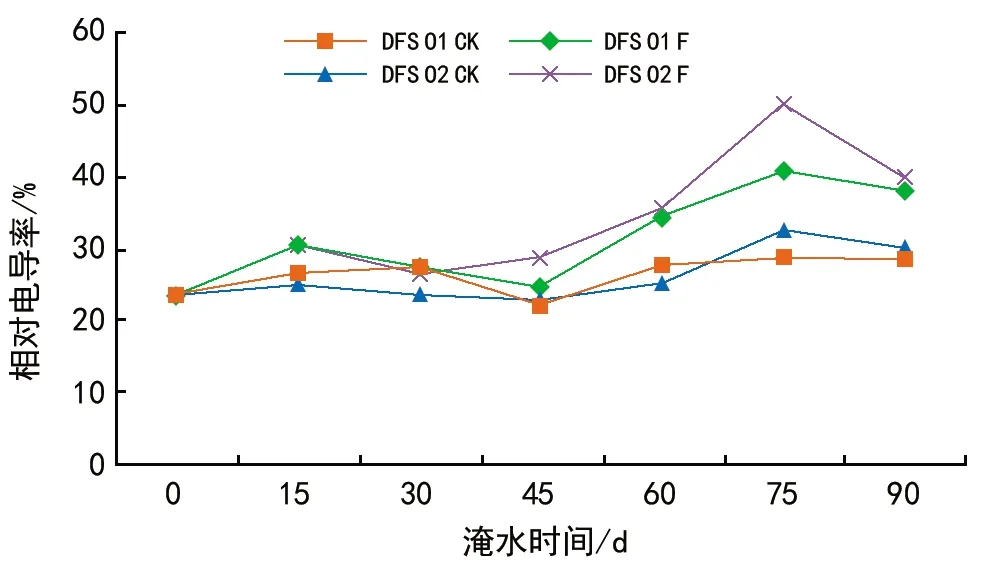
图2 淹水胁迫对DFS 01和DFS 02基因型相对电导率的影响
图3中,DFS 01、DFS 02基因型的MDA含量总体呈上升趋势。DFS 01和DFS 02基因型在0~30 d时上升缓慢,与对照差异较小;在45~75 d时上升幅度均明显增大,75 d时达最大值与对照相比增幅分别为65.01%和48.03%。淹水90 d时,MDA含量均下降,但仍显著高于对照,与对照相比上升幅度分别为54.9%、26.09%。说明DFS 01和DFS 02基因型在淹水胁迫下受到了伤害。方差分析表明,不同基因型、不同处理以及不同胁迫时间的MDA含量之间的主效应均为极显著差异水平(p<0.01),基因型、处理以及胁迫时间两两之间的交互作用对质膜透性的影响均达显著性水平(p<0.05)。
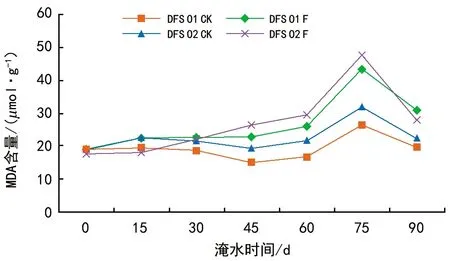
图3 淹水胁迫对DFS 01和DFS 02基因型MDA含量的影响
2.3 淹水胁迫对保护酶系统的影响
由图4可知,淹水条件下,DFS 01和DFS 02基因型各处理POD活性均呈下降趋势,但对照仍高于淹水处理下苗木的POD活性。DFS 01基因型在15 d时与对照相比含量大幅下降,DFS 02基因型在15 d时POD活性显著上升,在淹水30 d时POD活性急剧下降,淹水30~90 d时DFS 01和DFS 02基因型的POD活性均保持在较低水平,淹水结束时DFS 01和DFS 02基因型的POD活性分别为对照的31.28%、16.63%。
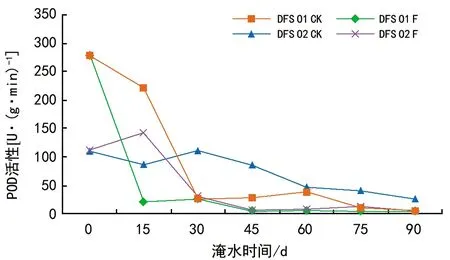
图4 淹水胁迫对DFS 01和DFS 02基因型POD活性的影响
方差分析表明,除基因型与处理之间的交互作用差异不显著外,不同基因型、不同处理及不同胁迫时间之间的主效应及三者的交互效应之间对POD活性均有极显著影响(p<0.01)。
DFS 01和DFS 02基因型对照的SOD活性基本保持不变,各淹水处理总体表现为上升趋势,DFS 01基因型在15 d时与对照之间差异较小,在淹水30 d时含量急剧上升,而DFS 02基因型在15~30 d时与对照差异较小,在45 d时SOD活性开始上升,后期DFS 01和DFS 02基因型SOD活性虽有所波动,但均高于对照。DFS 01和DFS 02基因型均在淹水90 d时SOD活性达到最大值,DFS 01和 DFS 02基因型SOD活性与对照相比增长幅度分别为87.63%、63.73%。
方差分析表明,DFS 01和DFS 02基因型之间的差异并不显著,不同处理、不同胁迫时间之间差异极显著。处理与时间之间的交互作用对SOD活性有极显著的影响(p<0.01)。
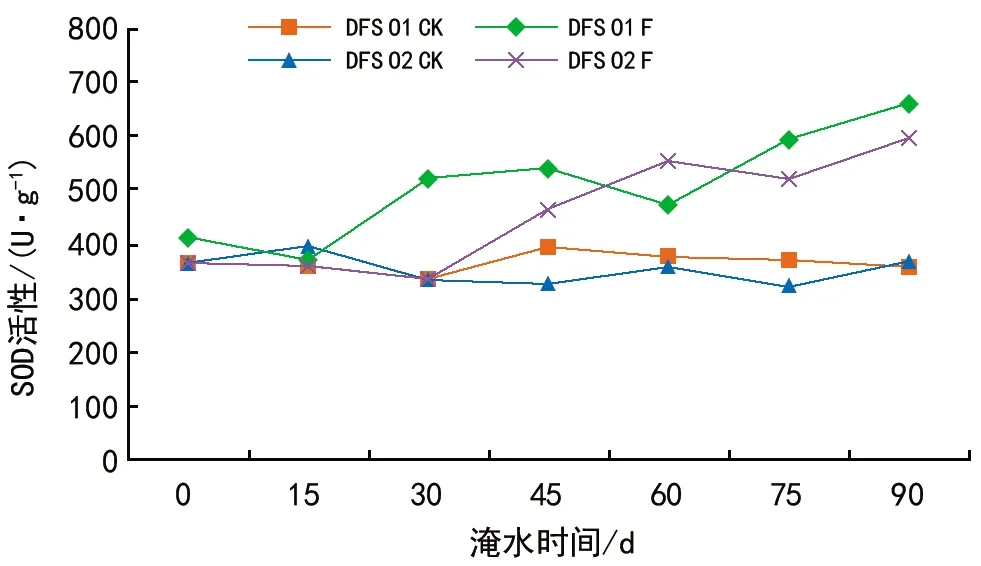
图5 淹水胁迫对DFS 01和DFS 02基因型SOD活性的影响
2.4 淹水胁迫对渗透调节的影响
从图6可以看出,DFS 01、DFS 02基因型脯氨酸含量呈双峰曲线。DFS 01和DFS 02基因型在15~30 d时含量急剧增加,淹水30 d时达到高峰值,与对照相比增幅分别为29.12%、126.65%,在45~60 d时含量又迅速下降,显著低于对照。而在淹水75 d脯氨酸含量均大幅增加,与对照相比增幅为74.69%、139.30%。淹水90 d时含量均下降,与对照差异不明显。
方差分析表明,DFS 01和DFS 02基因型的主效应作用对脯氨酸含量的影响达显著水平(p<0.05),不同处理、不同胁迫时间的主效应以及基因型、处理、胁迫时间之间的交互作用对脯氨酸含量的影响达极显著差异水平(p<0.01)。
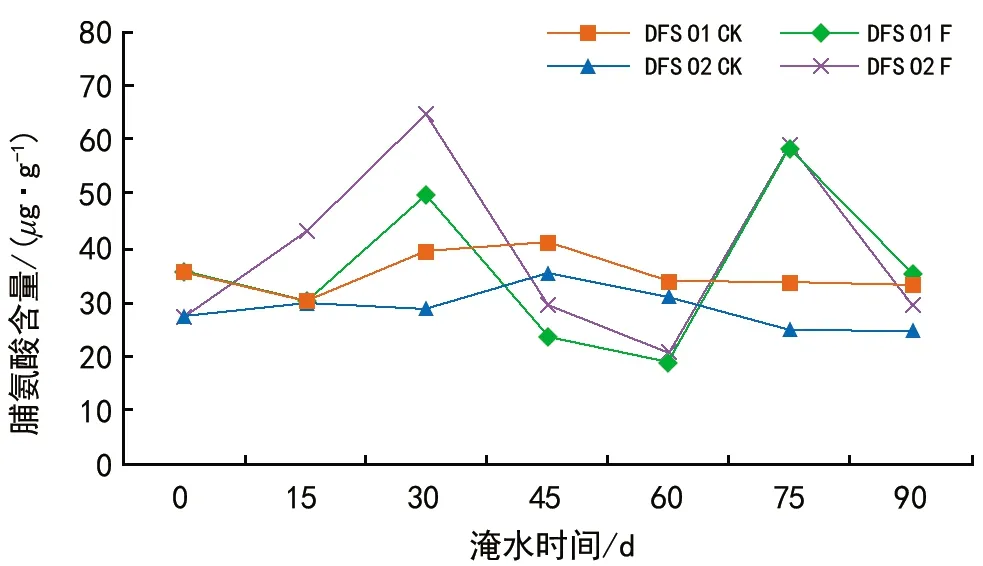
图6 淹水胁迫对DFS 01和DFS 02基因型脯氨酸含量的影响
由图7可知,DFS 01和DFS 02基因型的可溶性蛋白含量在淹水0~60 d时呈上升趋势,在75 d时DFS 01和DFS 02基因型含量均大幅下降,但DFS 01和DFS 02基因型的可溶性蛋白含量仍要高于对照,与淹水60 d时相比降幅分别为35.84%、43.90%。淹水90 d时2种东方杉基因型的可溶性蛋白含量均增加,与对照相比2种东方杉基因型增幅分别为68.55%、128.8%。方差分析表明,DFS 01和DFS 02基因型、不同处理以及不同胁迫时间之间的主效应作用对可溶性蛋白有极显著的影响(p<0.01)。基因型与处理、时间之间两两的交互作用对可溶性蛋白有显著影响(p<0.05),处理与时间之间的交互效应对可溶性蛋白有极显著影响。
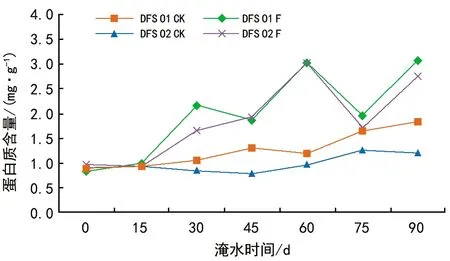
图7 淹水胁迫对DFS 01和DFS 02基因型可溶性蛋白含量的影响
由图8可知,DFS 01和DFS 02的可溶性糖含量总体呈先升后降的趋势,可溶性糖含量在0~30 d时持续上升,在淹水30 d可溶性糖含量达到最大值,DFS 01和DFS 02基因型与对照相比增幅分别为92.79%和95.1%,而淹水45 d时DFS 01和DFS 02基因型的可溶性糖含量均大幅下降,与淹水30 d相比降幅为48.11%、45.69%。淹水60~75 d时DFS 01和DFS 02基因型的可溶性糖含量有小幅上升,淹水90 d时含量下降,与对照之间差异不显著。
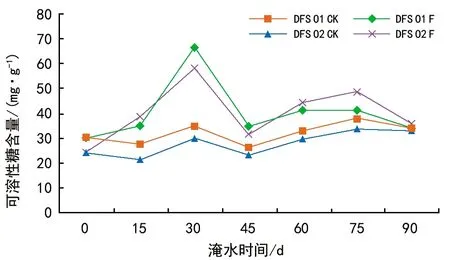
图8 淹水胁迫对DFS 01和DFS 02基因型可溶性糖含量的影响
方差分析表明,DFS 01和DFS 02基因型、不同处理、不同胁迫时间之间的主效应作用对叶片可溶性糖均有极显著影响。基因型与处理、时间之间两两的交互作用对可溶性糖有显著影响(p<0.05),处理与时间之间的交互作用对可溶性糖有极显著影响。
3 讨论与结论
叶绿素在光合作用的过程中对光能的转化以及植物内部营养物质的供应上有重要作用。淹水胁迫环境下,伴随着胁迫的加剧,叶绿素含量随之逐渐下降[13]。本试验中,DFS 01和DFS 02基因型的叶绿素含量总体呈下降趋势,这与李娟娟等[14]、廖德志等[15]的研究结论一致。
淹水条件下,随着胁迫时间的延长和胁迫程度的加剧,细胞膜受胁迫影响质膜透性增大,造成细胞内部各项功能的紊乱,膜质过氧化作用加剧,抑制植物的生长与发育[16]。本试验中,DFS 01和DFS 02两种基因型的质膜透性和MDA含量总体呈增长趋向。这与张慧琴等[17]、邓辉茗等[18]的研究结果一致。淹水75 d时DFS 01和DFS 02基因型的质膜透性和MDA含量均大幅增加,这可能是由于当时降温所造成的低温胁迫对2种东方杉基因型质膜造成的伤害。
逆境下细胞膜受到伤害,体内的活性氧和自由基大量增加,使得植物细胞发生膜质过氧化作用加剧,植物通过保护酶体系减少活性氧和自由基的生成,抵御胁迫的影响,减少植物受到的伤害。在本试验中,2种基因型的POD活性对照与淹水处理均随时间的延长呈下降趋势,这可能是因为试验时气温降低,光照时间减少,光合作用减弱,无法满足植物自身所需的营养物质,使得植物生长减缓,植物体内POD的活性也随之降低。DFS 01和DFS 02基因型的SOD活性则总体上呈增长趋势。说明SOD活性在苗木抵抗淹水胁迫的过程中对清除植株体内过多的活性氧与自由基、减轻膜质过氧化作用上有重要意义。本研究中POD与SOD活性表现出相反的变化趋势。大多数研究认为:在逆境条件下POD和SOD活性同步一致性,与陈敏琪等[19]、王哲宇等[20]的研究结论相似。
脯氨酸在胁迫下具有双重作用,其含量的增加可能是胁迫时蛋白质合成受阻,游离脯氨酸在体内累积的结果,是植物受害的表现;也有可能是植物为清除体内多余的活性氧适应胁迫环境而产生的[21]。在本试验中,DFS 01和DFS 02基因型的脯氨酸含量表现为双峰曲线,这与王美荣[22]、王华等[23]的研究结论一致。淹水前期脯氨酸含量上升可能是苗木发挥渗透调节作用以适应淹水环境,淹水中期时含量下降则可能是随着胁迫的加剧,脯氨酸的渗透调节作用已达到极限值,抑制了苗木体内脯氨酸含量的增加。淹水75 d时含量上升,结合蛋白质含量的变化则可能是蛋白质合成速率下降,导致植株体内游离脯氨酸含量增多,说明这是苗木受到胁迫伤害的表现。
可溶性蛋白具有很强的亲水性,对于维持细胞渗透势,增强细胞的保水能力,保持细胞内水分含量有着重要作用[24]。DFS 01和DFS 02基因型的可溶性蛋白含量总体为上升趋势,这与吴海英等[25]、张琛[26]的研究结论一致。为淹水诱导了植株体内保护酶蛋白和抗逆蛋白含量的增加,增强苗木对淹水环境的适应性,淹水75 d时含量下降则可能是低温胁迫造成了苗木体内蛋白质合成速率下降。
植物在遭受胁迫时通过调节可溶性糖含量的大小,有利于调节植物细胞的渗透压,保持植物细胞内膨压的稳定,维持细胞内各功能的运行[27]。本试验中,DFS 01和DFS 02基因型的可溶性糖呈先升后降的趋势,这与徐陆婷婷等[28]、连洪燕等[29]的研究结论一致。这可能是由于在淹水前期植株体内通过增加可溶性糖含量,来调节植物内部生理活动,为植物生长代谢提供所需营养物质,增强苗木的适应能力。而在中后期随着胁迫的加剧,可溶性糖的代谢和分解速率加快,植株无氧呼吸对可溶性糖的消耗加大,使得可溶性糖含量下降。
在对东方杉2种基因型各生理指标的分析研究中发现,淹水下东方杉2种基因型的细胞膜和叶绿素均遭受了胁迫的伤害,但2种东方杉基因型细胞内抗氧化物酶和渗透调节物质在植株体内进行调整,DFS 01和DFS 02的POD活性为下降趋势,并未对苗木起到保护作用。DFS 02的可溶性糖、可溶性蛋白、SOD活性及脯氨酸含量的增长幅度都要大于DFS 01,说明DFS 02的保护酶系统和渗透调节物质在淹水环境下对苗木的保护调节作用要强于DFS 01基因型,这也表明DFS 02基因型的耐涝性要更强。
