正畸骨改建中Hedgehog通路下游信号的表达变化
2020-05-20荣崧汐周梦琪
荣崧汐,周梦琪,孙 瑶
骨骼发育和骨改建过程中需要信号通路参与调控,其中Hedgehog(Hh)信号通路在胚胎时期骨发育及出生后骨改建中发挥重要作用[1]。Hh信号通路主要包括3种Hh信号蛋白Shh、Dhh、Ihh,2种蛋白受体Ptch1、Smo,核转录因子Gli1、Gli2、Gli3及下游靶基因[2-3]。有报道Hh信号通路参与皮质骨的改建,通过调节血管生成参与成骨机制[4]。Hh信号通路的异常增强或减弱,会引起各种骨骼系统疾病[2]。初级纤毛是突出于细胞表面的细胞器,有感知传导信号功能,作为细胞的“天线”[5],几乎所有细胞都有初级纤毛存在[6]。在脊椎动物里,Hh-Gli信号传导需要初级纤毛的存在和参与[7-8]。而存在于纤毛转运系统中的纤毛转运蛋白(IFT)变化影响Hh信号通路的信号传导。本研究通过建立正畸加力小鼠模型,分别在特定时间点观察牙槽骨改建情况和破骨细胞在牙槽骨中的分布,以及Hh信号通路和纤毛相关转运蛋白在正畸过程中的表达变化,探讨Hh信号通路和纤毛相关转运蛋白参与正畸牙槽骨改建的表达变化特征及相关性,为牙槽骨改建中破骨细胞的调节机制提供新的视角。
1 材料和方法
1.1 实验动物
8周龄野生型小鼠(C57/6J)18只,体质量(28±1.5)g,由同济大学实验动物中心提供。动物饲养于SPF级实验室,喂养固体饲料,饮消毒清水,室温约20℃,定期消毒。所有动物实验经同济大学伦理委员会认可批准(TJLAC-017-027)。
1.2 实验仪器和试剂
直径0.2 mm,长度4 mm的螺旋镍钛拉伸弹簧(圣马特,中国);正畸专用直径0.1 mm结扎丝(晨阳,中国);酸蚀剂(登莱克,中国),树脂粘结剂(3M,美国);组织处理脱水仪(Microm,德国),石蜡切片机(Thermo Fisher,美国);HE染色试剂盒(威奥,中国);TRAP染色试剂盒(Sigma,美国);山羊血清(迈新,中国);Gli1抗体(Abcam,英国);荧光二抗(Abcam,英国);DAPI(Thermo Fisher,美国);抗淬灭剂(Thermo Fisher,美国);直立荧光显微镜和图像分析系统(Nikon,日本);Trizol(Ambion,美国);Transcriptor First Strand cDNA Synthesis Kit(Roche,瑞士);Light Cycler 96实时荧光定量PCR仪(Roche,美国)。
1.3 小鼠正畸加力模型
1%戊巴比妥钠麻醉小鼠(80 mg/kg),建立上颌右侧第一磨牙正畸加力模型,4 mm拉簧用结扎丝一端固定在第一磨牙处,另一端固定在切牙处,力值为30~35 g,建模步骤参照先前实验[9]。
1.4 Micro CT测量
取加力0、7、14 d的小鼠,6只/组,4%多聚甲醛(PFA)固定上颌骨24 h,进行上颌骨扫描,选择中等分辨率8 μm切片增量获得上颌骨右侧近远中磨牙三维图像。选取第一磨牙远中最凸接触点和第二磨牙近中最凸接触点作为标记点,使用Micro CT自带系统软件SCANCO Medical AG测量牙移动距离。
1.5 石蜡切片及HE、TRAP染色
4%多聚甲醛(PFA)固定小鼠上颌骨24 h,用10%乙二胺四乙酸溶液(EDTA)脱钙20 d,进行组织脱水石蜡包埋。石蜡组织连续切片,每片厚度4 μm,55 ℃恒温烤片2 h,60 ℃烘箱30 min,脱蜡入水,HE、TRAP染色。
1.6 免疫荧光染色
切片脱蜡入水,第1天透明质酸37 ℃抗原修复1 h,PBS洗5 min,分3次,山羊血清封闭37 ℃ 1 h,PBS洗5 min,分3次,Gli1抗体(1∶400)4 ℃下孵育过夜,第2天全程避光,复温至室温后PBS洗5 min,分3次,Alexa Flour 586IgG(1∶500)室温孵育45 min,PBS洗5min,分3次,DAPI(1∶1 500)复染5 min,抗淬灭剂封片,荧光显微镜拍照。
1.7 实时荧光定量PCR检测
提取0、7、14 d小鼠右侧上颌骨组织,加入1 mL Trizol试剂,机械研磨粉碎,提取组织总RNA。使用Transcriptor First Strand cDNA Synthesis Kit,用Oligo DT引物,终体积为20 μL,从1 μg总RNA合成1个cDNA。实时荧光定量PCR反应体系:以GAPDH为内参基因,上下游引物(10 μmol/L)各0.5 μL, DyeⅡ 0.5 μL,cDNA 2 μL,SYBR Premix ExTaq12.5 μL,双蒸水定容20 μL,测定Ct值(Roche PCR仪),进行相对定量分析。引物列于表1中。

表1 引物序列
1.8 统计方法

2 结 果
2.1 建立正畸加力模型,加力后显示第一磨牙向近中移动
如示意图所示建立正畸加力模型(图1A)。CT三维成像显示相对于未正畸小鼠,加力7、14 d小鼠上颌骨右侧第一磨牙向近中移动(图1B、1C、1D)。统计牙移动距离显示加力7 d移动距离为(0.251±0.0194)mm,14 d牙移动距离为(0.359±0.064)mm,移动距离具有统计学差异(P<0.001)。
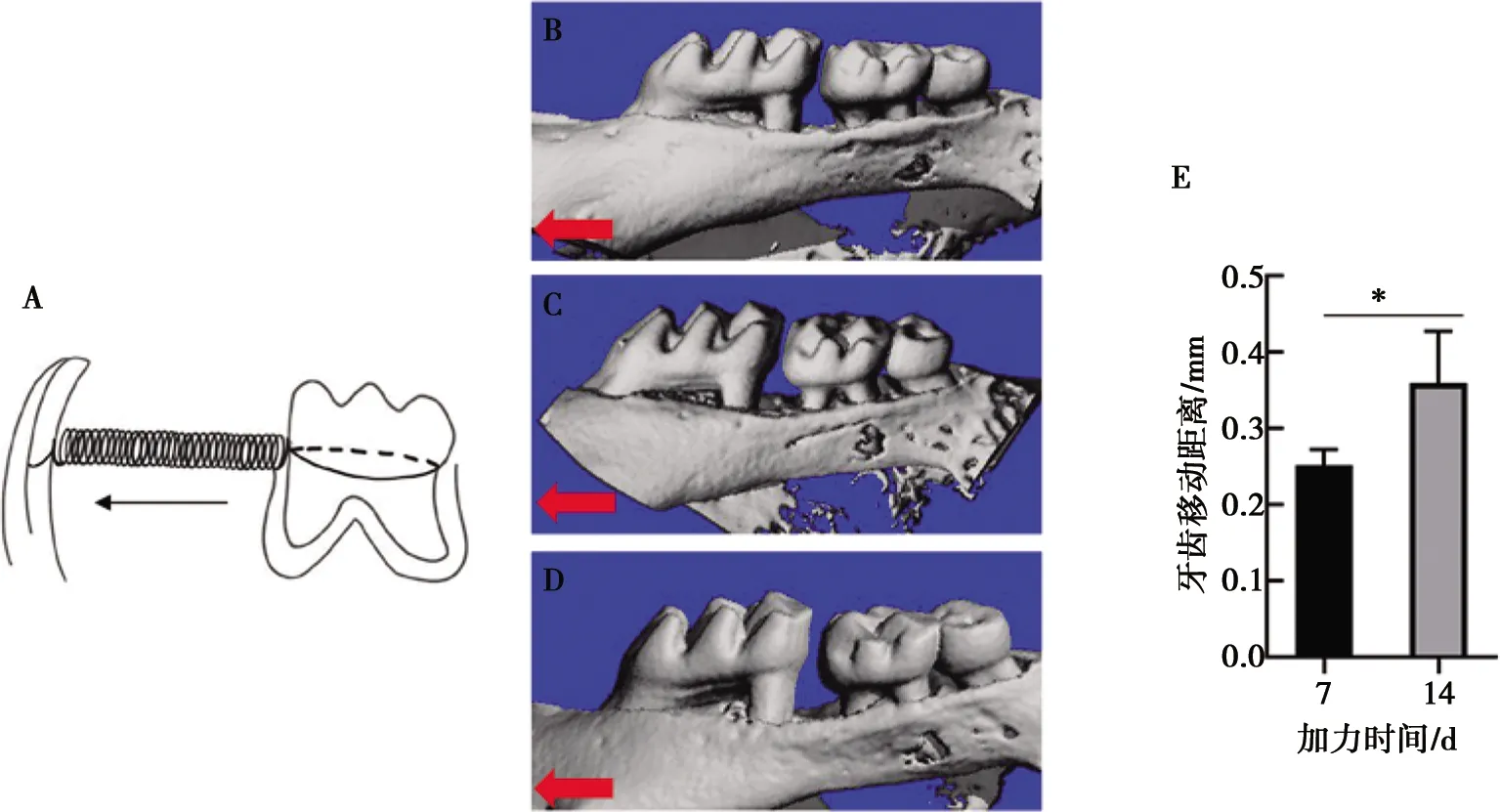
A:正畸加力示意图;B~D:右侧上颌第一磨牙加力0、7、14 d牙移动变化;E:右侧上颌第一磨牙加力7、14 d移动距离;箭头示移动方向;*:P<0.05
图1建立正畸牙移动模型
Fig.1Establishment of orthodontic tooth movement model
2.2 正畸加力牙槽骨改建情况及破骨细胞数量变化
HE染色显示未正畸小鼠牙周膜连续致密,牙槽骨结构完整,可见疏松骨髓腔;TRAP染色未见牙槽骨中有破骨细胞生成。正畸7 d小鼠牙槽骨压力侧牙周膜受压萎缩,牙槽骨受压后骨质疏松多孔,14 d可见压力侧牙槽骨吸收明显(图2A);TRAP染色可见破骨细胞生成,主要集中在压力侧(图2B),差异具有统计学意义(P<0.05)(图2C)。破骨细胞特异酶抗酒石酸酸性磷酸酶(TRAP)和组织蛋白酶K(CTSK)加力前表达水平较低,7 d和14 d连续上调,差异具有统计学意义(P<0.05,图2D)。
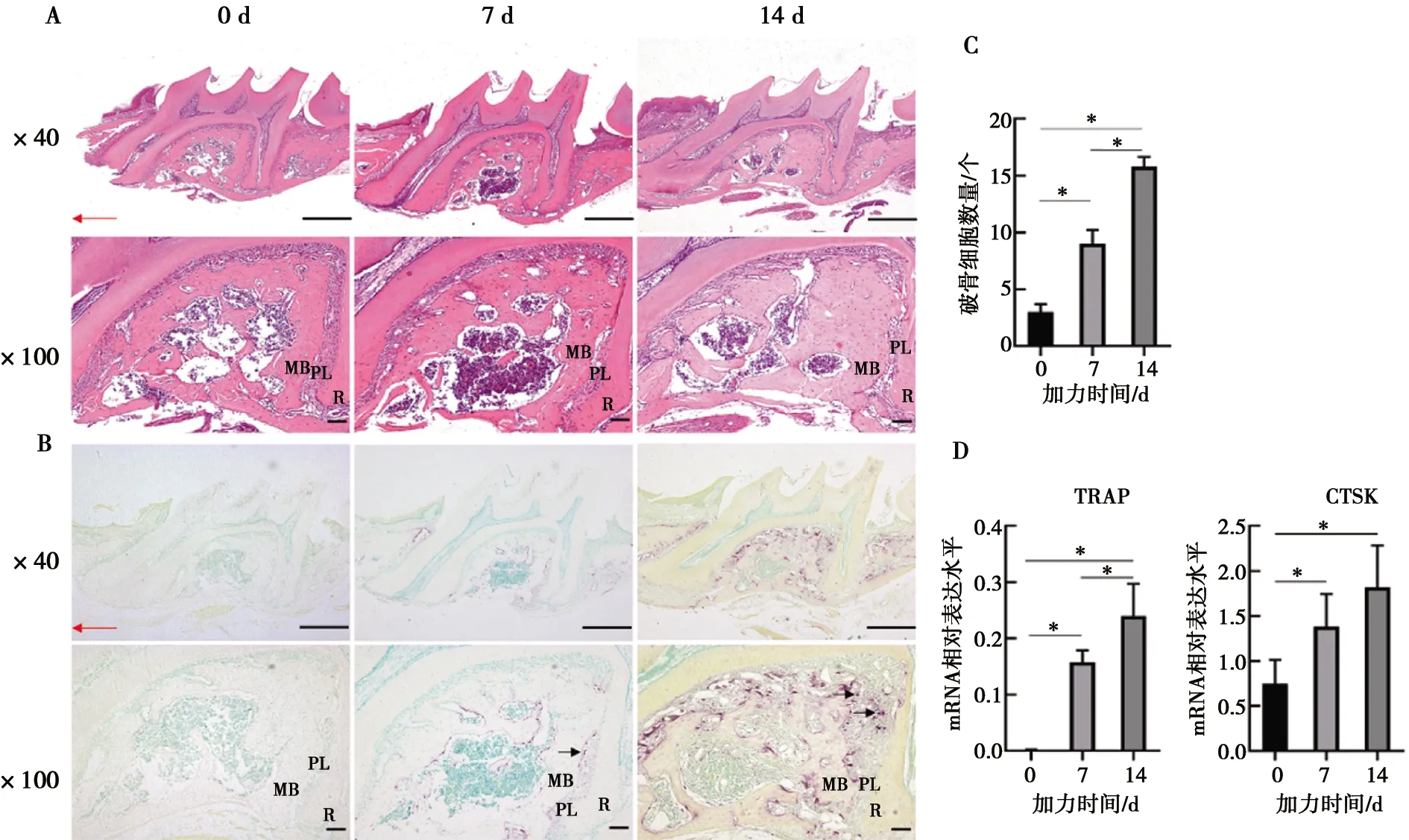
A:加力0、7、14 d HE染色示牙槽骨压力侧牙周膜紊乱,牙槽骨改建明显; B:加力0、7、14 d TRAP染色示破骨细胞生成逐渐增加,压力侧骨吸收明显; C:牙槽骨压力侧TRAP阳性细胞计数; D:破骨细胞相关基因TRAP 、CTSK mRNA表达水平;R:牙根;PL:牙周膜;MB:近中牙槽骨。红色箭头示牙齿移动方向,黑色箭头示TRAP阳性破骨细胞;*:P<0.05
图2加力后右侧上颌第一磨牙牙槽骨改建情况
Fig.2Alveolar bone remodeling of the right maxillary first molar of mice after force
2.3 荧光染色示Gli1阳性细胞在牙槽骨中的表达分布及Hh信号通路分子Shh、Smo、Gli1表达水平变化
免疫荧光染色显示未加力小鼠牙槽骨中Gli1阳性细胞较少((3.333±0.471)个),加力7 d可见牙槽骨中有大量Gli1阳性细胞出现,并且主要分布在牙槽骨压力侧(图3A),计数Gli1阳性细胞在7 d时表达最高((28.000±0.816)个),14 d下降((22.667±1.247)个)(P<0.05,图3B)。Hh信号通路分子Shh、Smo、Gli1在加力7 d时表达水平达到峰值,14 d表达水平下降,但整体表达水平在加力后上升,0、7、14 d表达水平具有统计学差异(P<0.05,图3C)。
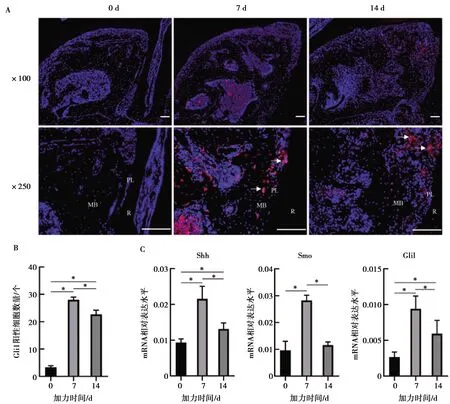
A:加力0 d牙槽骨中无明显Gli1阳性细胞,7 d Gli1阳性细胞在牙槽骨中表达明显,14 d在牙槽骨压力侧聚集表达; R:牙根;PL:牙周膜;MB:近中牙槽骨;图中白色箭头示Gli1阳性细胞;B:加力0、7、14 d Gli1阳性细胞表达水平定量;C: 加力0、7、14 d Hedgehog信号通路分子Shh、Smo、Gli1 mRNA表达水平,*:P<0.05
图3免疫荧光染色示Gli1阳性细胞在正畸骨改建中表达分布及Hedgehog通路下游分子表达变化
Fig.3Immunofluorescence showed Gli1positive cell expression in orthodontic bone remodeling and the expressionlevels of Hedgehog pathway downstream signals
2.4 纤毛相关转运蛋白Ift144、Ift88、Ift74和纤毛动力蛋白Kif3a表达水平
实验结果显示转运复合体A(IFTA)中的Ift88随加力时间在7 d时轻微下降,在14 d时表达水平上升,差异具有统计学意义(P<0.05)。IFTA中的Ift74在牙槽骨加力后14 d表达水平上调,有统计学差异(P<0.05)。转运复合体B(IFTB)中的Ift144表达水平在7 d时下降明显,14 d略微上升(P<0.05)。纤毛动力蛋白Kif3a表达水平在加力7、14 d中明显上升(P<0.05,图4)。

加力0、7、14 d Ift88、Ift74、Ift144、Kif3a mRNA表达水平,*:P<0.05
图4不同时间点纤毛相关转运蛋白和纤毛动力蛋白mRNA表达水平
Fig.4Expression level of intraflagellar transport protein and ciliary dynein protein at different time points
3 讨 论
正畸下的牙槽骨改建包括压力侧的骨吸收和张力侧的新骨形成。发现小鼠正畸早期牙槽骨中生成大量破骨细胞,压力侧骨吸收区域明显,牙移动距离随着正畸天数增加而不断加大(P<0.05),破骨细胞相关特异酶TRAP和CTSK在正畸加力后表达水平上调,14 d时具有明显差异(P<0.05)。说明正畸早期牙槽骨改建以骨吸收为主。
Hedgehog信号通路在胚胎和成体组织的发育和维持中具有重要作用[10-12],参与骨髓间充质干细胞向软骨分化[13-14],在Shh诱导的小鼠胚胎成骨细胞前体细胞MC3T3-E1中成骨细胞特异性转录因子Osterix表达上调促进间充质干细胞(MSCs)向成骨细胞分化[15]。 Heller等[16]发现在体外抑制Hh效应器Smo表达后减少破骨细胞生成。Shimo等[17]在CD11b阳性细胞破骨向培养中加入Shh发现促进破骨细胞分化的活化T细胞核因子1(Nfatc1)表达上调,证实Hh信号通路影响破骨细胞活性。此研究聚焦于体内,发现Shh在正畸7 d时表达较高(P<0.05),提示正畸骨改建激活Hh信号通路。Shh的升高抑制了膜受体Ptch1的表达,解除了对Smo的结合抑制,Smo表达在7 d时达到高峰而随后下降(P<0.05)。Hh信号通路中具有激活效应的转录因子Gli1在Hh通路激活后表达上调[18],免疫荧光染色示Gli1阳性细胞在牙槽骨压力侧表达集中,其mRNA表达水平在7 d较高(P<0.05)。这些结果提示Hh信号通路参与正畸牙槽骨改建,正向调控破骨细胞的分化[19-20]。未来可进一步研究牙槽骨改建过程中Shh信号和破骨细胞生成的相关性。
初级纤毛是介导Hedgehog信号的重要细胞器。纤毛转运蛋白复合体系统(IFT)维持纤毛结构和信号传导,分为逆向纤毛转运蛋白系统A(IFTA)和正向纤毛转运蛋白系统B(IFTB)。作为信号传导器,推测物理刺激导致纤毛相关转运蛋白表达改变影响Hh信号通路。Ift144是IFTA中的核心蛋白,构建ift144等位基因突变小鼠显示转运膜蛋白缺损使得Shh活性丧失[21],实验结果显示ift144在加力后下降明显,第14天表达略有上升,可能源于激活早期以正向运输纤毛蛋白积聚在纤毛顶部,逆向转运系统暂时抑制所造成,仍需进一步实验探究。IFTB的缺失会损害Hh信号通路,其中Ift88影响Hh信号通路激活[22]。选取IFTB上的核心蛋白Ift88和Ift74,发现Ift88呈先下降后上升趋势,Ift74在早期变化不明显,14 d时表达升高。推测Hh信号通路与IFTB核心蛋白之间多向性调控。Kif3a是纤毛正向运输系统中动力蛋白亚基,相关研究显示Kif3a的缺损会导致Shh敏感性下降[23],减弱细胞内钙离子对流体剪切力的响应,降低Hh信号通路的活性[24],Kif3a在正畸骨改建中表达激活,判断Kif3a在正畸牙槽骨改建中参与Hh信号通路正向调控。
有研究证实Hh信号通路在体外促进破骨细胞生成,增强骨吸收能力。但是在体内则缺乏相关研究。上述结果说明在正畸力的作用下,以破骨细胞为主导的正畸骨改建阶段,牙槽骨中Hh信号通路的基因表达水平上调,同时纤毛相关转运蛋白的表达水平有明显变化,提示我们牙槽骨中破骨细胞的生成可能会受到纤毛转运系统激活Hh信号通路的影响,本研究为理解正畸牙移动过程中破骨细胞的激活和生成提供新的视角和理论依据。骨改建过程中初级纤毛对Hh信号通路的调控机制,有待于进一步研究。
