La掺杂对Cu2O制备及其锂电光催化性能研究
2020-05-19孙君龙
孙君龙
(中国海洋大学,山东 青岛 266100)
随着环境污染的加剧和化石燃料的枯竭,迫切需要探索新的可持续能源并控制不可再生能源的使用,研发高效的光电催化剂是同时解决环境和能源问题的有效方法[1-3]。氧化亚铜(Cu2O)是一种带隙为2.17eV的p型半导体,具有良好的光学和电化学性能,引起了人们的极大关注[4-5]。此外,无毒和丰富的性质使Cu2O成为非常有前途的材料[6]。然而,由于其相对较窄的带隙,由可见光激发产生的Cu2O的光致电子容易重组,并且Cu2O可能会因光致载流子与水之间的反应而产生的强氧化剂被氧化,因此这些负特性会降低量子效率和光催化稳定性[7]。提高量子效率的一种有效措施是将Cu2O与其他材料结合形成复合材料,例如p-n结或金属基复合材料[8-9]。光生电子可以及时转移到n型半导体的导带上,或者金属衬底和金属氧化物半导体之间的肖特基势垒可以抑制载流子复合,从而可以有效地延长光生载流子的寿命[10-11]。
在这项研究中,利用一种简单有效的方法将La掺杂Cu2O,通过XRD,SEM对制备的复合材料的组成和形貌进行了表征。并研究理化性质和电化学性能之间的关系,La掺杂以及CuO和Cu2O之间的协同作用,因此作为锂离子电池负极材料中较纯Cu2O有一定提高。评价了其光催化性能和载流子分离效率,制备的La-Cu2O在光催化分解和光诱导电子-空穴对的分离效率方面显示出较好的性能。
1 实验部分
1.1 主要试剂
氢氧化钠(分析纯,国药集团化学试剂有限公司),Cu(NO3)3(分析纯,国药集团化学试剂有限公司),La(NO3)3(分析纯,国药集团化学试剂有限公司),甲基橙(MO) (分析纯,天津市博迪化工有限公司)。
1.2 仪器表征
X射线衍射仪(RigakuD,日本理学公司);扫描电子显微镜(S-4800N,日本国立公司);land电池测试系统(蓝电电子公司);电化学工作站(Zennium,德国ZAHNER公司);氙灯(PLS-SXE 300,北京泊菲莱公司)。
1.3 La、Ce掺杂Cu2O材料的制备
1.3.1 Cu2O的制备
第一步,用量筒量取20mL配制好的NaOH溶液于烧杯1中,再用量筒量取20mL配制好的Cu(NO3)2溶液于烧杯中,用移液枪取 60μL 的水合肼稀释在装有40mL的去离子水中的烧杯3中。第二步,在集热式磁力加热搅拌器中内放入烧杯2,控制反应体系的温度在25℃,将烧杯1中的NaOH溶液逐滴加入烧杯2中,磁力搅拌10min。第三步,将稀释后的60μL的水合肼逐滴加入烧杯2中,磁力搅拌反应1.5h。第四步,用去离子水反复离心洗涤所得到的砖红色沉淀,在真空干燥箱内,设定为60℃,干燥2h。
1.3.2 Cu2O的改性
空白组如上述步骤制备,在第一步时,分别在烧杯 2 中加入 5mg、10mg、15mg的 La(NO3)3制备质量分数为1%,2%,3%的La改性的Cu2O,记为1%La-Cu2O,2%La-Cu2O,3%La-Cu2O。
1.4 Cu2O的性能测试
1.4.1 光催化性能测试
取10mg/L,5mg/L(稀释2倍),2mg/L(稀释5倍),1mg/L(稀释10倍) 的甲基橙放入比色皿中,用分光光度计测其分光度,标定标准曲线。称取0.05 g的Cu2O粉末,倒入装有80 ml的10 mg/L甲基橙溶液,超声5min后,在暗箱中充分搅拌1h,然后取5mL的溶液进行离心处理,取其上清液测其分光度。打开500 W的氙灯,每隔30min从溶液中取5mL的溶液进行离心处理,取其上清液测其分光度,直到2h。称取0.05 g的Cu2O粉末,倒入装有80mL的10mg/L甲基橙溶液,超声5min后,在暗箱中充分搅拌1h,然后取5mL的溶液进行离心处理,取其上清液测其分光度。在自然光照射下反应4h后,测其分光度。
1.4.2 电化学性能测试
称取3mg Cu2O作为活性物质,0.6mg乙炔黑作为导电剂,40mL PVDF作为黏结剂,以m(活性物质)∶m(导电剂)∶m(黏结剂)=75∶15∶10,分散到10mL的N-甲基-吡咯烷酮溶液中,超声3h充分分散后,将其对半滴在两个钢片上,干燥一晚上。按所制电极片,隔膜,锂片的顺序组装半电池,静置一天后测试其充放电性能和倍率性能。
2 结果与分析
2.1 XRD分析
3%La-cu2O的XRD图见图1。
水合肼法制备的Cu2O晶体结构较为完善,且所有衍射峰的跨度都不超过2°,说明水合肼法制备的Cu2O的结晶度高。位于29.7°,36.7°,42.5°,61.6°, 77.6°的 衍射 峰 属 于 (110),(111), (200), (220), (222),对应于立方晶Cu2O相(JCPSD NO.65-3288),在所有样品中均出现了强烈而尖锐的衍射峰,表明了良好的结晶度。3%La-Cu2O的5强峰出现的角度和空白组相比,有略微的左移,峰强也随之降低,是因为La的添加使Cu2O的晶粒尺寸减小导致的。
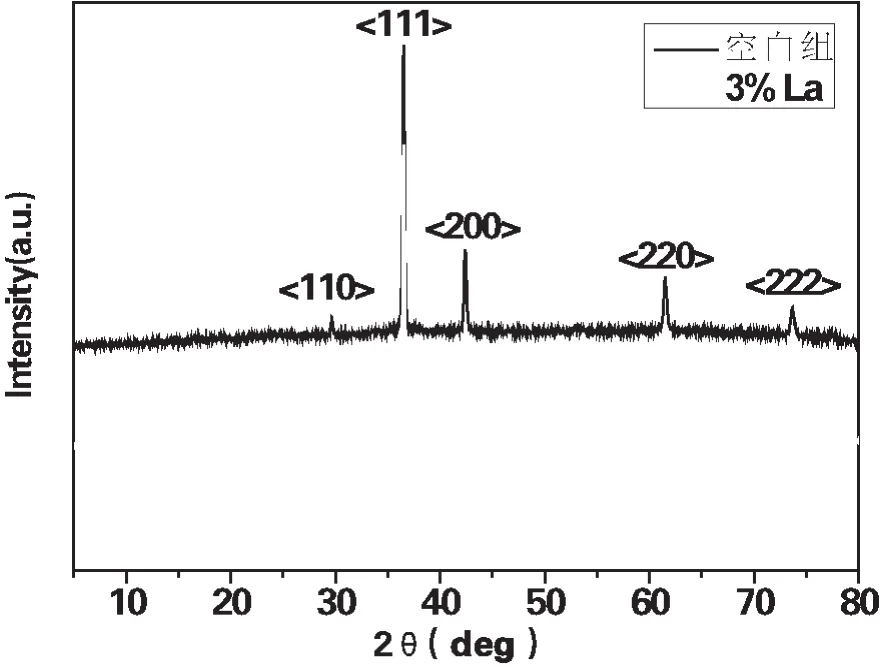
图1 空白组,3%La的XRD图
图2为3%La-Cu2O的XRD图及局部放大图。La的添加在Cu2O中引入了少量的CuO相。在添加La的情况下,其峰位置观察到细微的位移,这表明La的存在对Cu2O的晶体结构有一定影响,氧化了Cu2O的亚铜离子,从而增加了CuO相。

图2 3%La的XRD图及局部放大图
2.2 形貌分析
空白组、3%La-Cu2O和4%La-Cu2O的SEM图像如图3所示。空白(图4) 呈现出八面体形态,平均晶粒直径约为1400 nm。掺杂La后,如图3 b、图3c所示,Cu2O的颗粒形态保持为八面体(与XRD测量一致),并且含La化合物晶粒均匀分布在Cu2O上,增大了Cu2O表面积,提高接受光催化面积和电化学性能。
2.3 电化学性能
2.3.1 倍率性能
图5根据相应的倍率性能曲线比较,在100mA/g的下,3%La-Cu2O,的比电容为340 mhA/g,与其他含量相比有了显著的提高,这些结果进一步证实了Cu2O和一定含量的La在影响到电极的电容性能方面的协同作用。
2.3.2 循环稳定性能

图3 八面体晶体的SEM图

图4 空白组的SEM照片
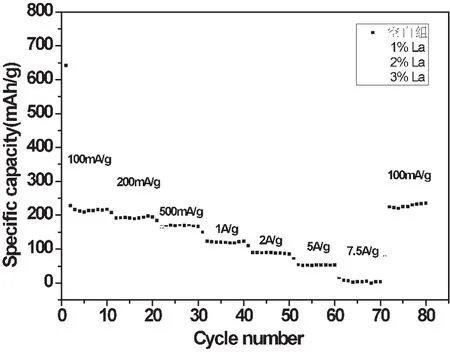
图5 La-Cu2O的倍率性能曲线
对空白组与不同含量La掺杂材料充放电曲线进行了研究。图6显示了在电流密度为100 mAh/g的情况下,10个循环中1%La-Cu2O,2%La-Cu2O和3%La-Cu2O的充放电行为曲线。初始放电容量为440mAh/g,可逆容量保持392 mAh/g的高水平,相当于库仑效率为89%。第一次循环容量损失是由于形成了固态电解质相间(SEI) 钝化层,锂离子不可逆地捕获和电解质分解,并且在第一次循环后观察到SEI稳定。
2.4 光催化性能
通过研究目标污染物的降解速率来评估光催化效率。我们可以观察到,空白组、1%La、2%La、3%La-Cu2O光降解甲基橙的降解率增长趋势基本一致,其中,3%-Cu2O的光催化性能最好,次之为空白组氧化亚铜,然后是1%-Cu2O,最后为2%-Cu2O。在自然光下光催化反应4h后,3%-Cu2O的甲基橙的降解率接近45%。随着La数量的增加,光催化性能的增强。通常,污染物的降解效率在很大程度上取决于载流子分离的程度。从图7b中看出,纯Cu2O表现出线性降解速率,并且4h后约有33%的目标污染物被去除,3%La-Cu2O复合材料的降解速率有一定的提高。
光催化性能的提高归因于La的电子迁移率和电导率,当产生光生电子时,它们立即通过La转移形成具有强还原性的O2-自由基。另一方面,具有强烈氧化性的光激发空穴将参与·OH自由基的形成,这两种自由基都协同参与了对污染物的氧化还原反应。此外,Cu2O的大表面积和更多的活性位点也有助于目标污染物的吸附。
3 结论
本文采用掺杂法制备La-Cu2O复合材料,复合材料中的Cu2O的形状保留了截头的立方体,并La均匀分布在Cu2O上。制备的复合材料表现出稳定的循环性能,可作为锂离子电池的负极,La-Cu2O材料在低倍率下具有很高的容量,可用于潜在的高性能负极材料。并且,随着La含量的增加,复合材料在相同的照射条件下,产生的光电流高于空白Cu2O,可以提高对目标污染物的降解效率,这表明La可以充当电子受体以转移光生电子,提高载流子分离效率。La对污染物的更高吸附能力以及与Cu2O的协同效应是显着提高污染物降解效率的关键。该研究对于进一步研究La对复合材料性能的影响机理以及其他复合光催化剂的开发具有一定的参考意义。
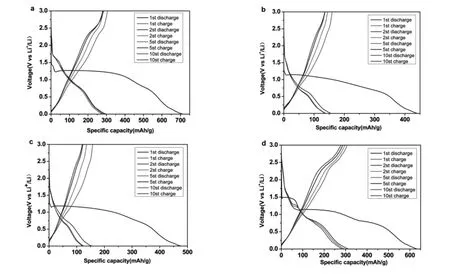
图6 La-Cu2O在100mA/g的电流密度下的充放电曲线
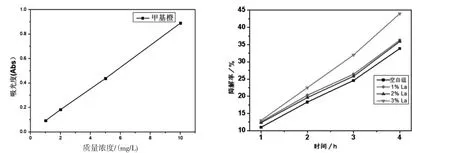
图7 (a)甲基橙的标准曲线 (b)La-Cu2O光降解甲基橙曲线
