蛋白酪氨酸磷酸酶受体D通过STAT3途径影响肝癌细胞PD-L1表达的机制研究
2020-05-19
广西医科大学药学院,广西 南宁 530021
肝细胞癌是全世界范围危害人类生命健康的常见肿瘤,在中国常见恶性肿瘤中发病率排第4位,死亡率排第2位[1]。虽然肝癌的早期发现和手术治疗在全世界已经取得很大的进展,但由于肝癌恶性程度极高,发展隐匿,进展速度快,大多数患者确诊时已进入中晚期,预后都比较差,5年生存率低至12%[2]。晚期肝癌的治疗迫切需要寻求新的系统疗法来改善患者的预后,而肿瘤免疫治疗是很有潜力的发展方向之一。
程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)是重要的免疫调节分子,在T细胞、B细胞和肿瘤细胞中过表达,通过与程序性死亡[蛋白]-1(programmed death-1,PD-1)相互作用抑制CD8+T淋巴细胞增殖和存活并影响肿瘤浸润性T细胞的功能,促进肿瘤细胞的免疫逃逸[3]。研究发现,肝癌组织中PD-L1过表达与肿瘤的转移和侵袭呈正相关[4]。然而,PD-L1在肝癌中过表达的具体机制仍不清楚。有文献报道[5],信号转导与转录激活因子3(signal transducer and activator of transcription-3,STAT3)在多种癌症中与PD-L1的表达调控密切相关,STAT3信号通路的异常激活可诱导PD-L1表达,导致肿瘤逃避免疫监视。PTPRD是蛋白酪氨酸磷酸酶家族的重要成员,参与细胞内许多重要信号的调控[6]。PTPRD基因缺失或表观遗传学的变化与STAT3信号通路异常激活密切相关,PTPRD基因沉默可诱导STAT3异常激活,促进肿瘤细胞的增殖和分化,同时抑制免疫活性[7]。但PTPRD和PD-L1表达是否存在相关性,目前鲜见相关文献报道。本研究拟检测肝癌组织中PTPRD和PD-L1基因的表达,同时构建PTPRD稳定表达的HepG2肝癌细胞系,旨在观察PTPRD和PD-L1在肝癌细胞的表达相关性及两者相互调节的潜在机制,探索肝癌免疫治疗的新靶点。
1 材料和方法
1.1 临床标本收集
收集2018年10月—2019年1月广西医科大学附属肿瘤医院肝二病区原发性肝癌手术治疗的16例肝癌患者的肿瘤标本及其癌旁标本(距肿瘤边缘>5.0 cm)。所有患者术前均未接受放疗或化疗。标本收集在术前征得患者同意,且通过医院伦理委员会批准。
1.2 试剂
人HepG2肝癌细胞购自上海美轩科技股份有限公司,DMEM高糖培养基购自美国Gibco公司,胎牛血清购自美国Gemini公司,RNA提取试剂盒、反转录试剂盒和实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)扩增试剂盒购自宝生物工程(大连)有限公司,PTPRD过表达和阴性对照腺病毒上海吉凯基因化学技术有限公司。PTPRD、PD-L1和GAPDH引物购自英潍捷基(上海)贸易有限公司,PTPRD、PD-L1、STAT3和p-STAT3抗体购自美国Abcam公司,GAPDH抗体购自北京博奥森生物技术公司,HRP标记羊抗兔二抗购自美国Aboirse公司,ECL超敏发光显影液购自上海碧云天生物技术有限公司。
1.3 免疫组织化学染色与半定量分析
将烤干的切片脱蜡后用枸橼酸缓冲液进行高压修复后,3% H2O2溶液温育15 min,自来水冲洗后,用血清封闭10 min,最后加一抗PTPRD(1∶300)和PD-L1(1∶100),4 ℃温育过夜。第2天,复温后,PBS冲洗切片,加二抗温育15 min,PBS冲洗,加三抗温育10 min,PBS冲洗,最后用DAB显色10 min,苏木精复染,脱水,晾干,封片,病理显微镜观察拍照并分析。用IPP软件分析计算每例标本中PTPRD和PD-L1的阳性细胞率,每个标本选3个以上的高倍视野(×200)计数,结合每个样本染色强度作为表达强度的综合评分。阳性细胞所占的百分比评分:
①阳性细胞百分率:0%~5%为0 分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;② 阳性细胞染色强度:0为无着色,1为淡黄色,2为棕黄色,3 为棕褐色。两项乘积作为表达强度的总分。最后0为阴性(-),1~4为弱阳性(+),5~8为中等阳性(++),9~12分为强阳性(+++)[8]。
1.4 RTFQ-PCR检测肝癌组织PTPRD和PD-L1 mRNA的表达水平
采用MiniBEST试剂盒提取组织内总RNA,纯度合格后,通过PrimeScriptTM反转录试剂盒反转录成cDNA。扩增引物设计:PTPRD上游引物为5’-TTTACACGAACACCCGTTGA-3’,下游引物为5’-CGGAGTCCGTAAGGGTTGTA-3;PD-L1上游引物为5’-TGTGGCATCCAAGATACAAACTCAAAG-3’,下游引物为5’-TCCTCCTCTGCTTTCGCCAGGTTC-3’;内参GAPDH上游引物为5’-CAGCCTCAAGATCATCAGCA-3’,下游引物为5’-TGTGGTCATGAG TCCTTCCA-3’。使用TB GreenTMPremix Ex TaqTM试剂盒进行RTFQ-PCR扩增。RTFQ-PCR扩增过程为:95 ℃预变性15 s,95 ℃变性5 s,60 ℃退火34 s,40个循环,收集信号。反应体系20 μL,基因相对表达量用2-ΔΔCt计算分析。每个样本3个重复孔。
1.5 细胞转染
HepG2细胞用含10%血清和1%双抗的DMEM高糖培养基于37 ℃、CO2体积分数为5%的培养箱中培养,48 h更换1次培养基。将状态良好的HepG2细胞以每孔5×105的细胞数目接种于6孔板中,设置PTPRD上调组(HepG2-PTPRD组)、阴性对照上调组(HepG2-NC组)、空载组(HepG2-CK组)、PTPRD下调组(HepG2-shRNA-PTPRD)和阴性对照下调组(HepG2-shRNA-NC),当细胞融合度达50%~60%时,根据病毒转染说明书,以适当的感染指数计算相应病毒体积,并感染细胞,转染10~12 h后更换新的培养基继续培养,转染48和72 h后用荧光显微镜观察绿色荧光蛋白的表达,荧光蛋白发光效率为90%以上,用于后续实验。
1.6 RTFQ-PCR检测实验组和对照组PTPRD和PD-L1 mRNA的表达水平
采用过柱法提取各组细胞总RNA,提取、反转录及扩增反应方法同1.4。
1.7 蛋白质印迹法(Western blot)检测
转染72 h后,分别提取各组细胞总蛋白,用二喹啉甲酸(bicinchoninic acid,BCA)法检测各组蛋白的浓度。按说明书加蛋白上样缓冲液,混匀后,高温煮沸至蛋白变性,冷却至室温后将样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)并电转至PⅤDF膜上,经5%BSA室温摇床上封闭1 h后温育一抗PTPRD(1∶500)、PD-L1(1∶1 000)、STAT3(1∶2 000)、p-STAT3(1∶1 000)、GAPDH(1∶2 000),置于冰箱中4 ℃过夜。二抗(1∶8 000)室温摇床温育1 h,ECL显影并拍照后Image J分析蛋白条带灰度值。目的蛋白相对表达量=目的蛋白条带灰度值/GAPDH蛋白条带灰度值。
1.8 统计学处理
SPSS 17.0软件进行统计学分析,临床样本免疫组织化学染色实验采用Fisher精确概率法检验,定量资料以表示,用独立样本t检验及单因素方差分析分析差异性,用Spearman等级相关分析分析相关性,P<0.05为差异有统计学意义。
2 结果
2.1 PTPRD和PD-L1的表达与临床病理学因素的关系
对16例肝癌组织免疫组织化学的结果分析显示,与癌旁组织相比,肝癌癌组织中PTPRD表达减弱,而PD-L1表达增强(图1A)。利用Spearman相关分析PTPRD和PD-L1在肝癌组织上的表达评分,显示PTPRD与PD-L1表达存在负相关关系(r2=0.275 8,P<0.05,图1B)。在这16例病例分析中,肝癌组织中PD-L1的高表达与乙肝病毒表面抗原(HBsAg)有关(P<0.05),与患者年龄、甲胎蛋白值、谷丙转氨酶和巴塞罗那分期等临床病理学特征无关;同时,PTPRD的低表达与患者年龄、HBsAg、甲胎蛋白值、谷丙转氨酶和巴塞罗那分期等无关(表1)。

图1 PTPRD和PD-L1在肝癌组织中蛋白表达相关性Fig.1 PTPRD expression correlates with PD-L1 levels in hepatocellular carcinoma
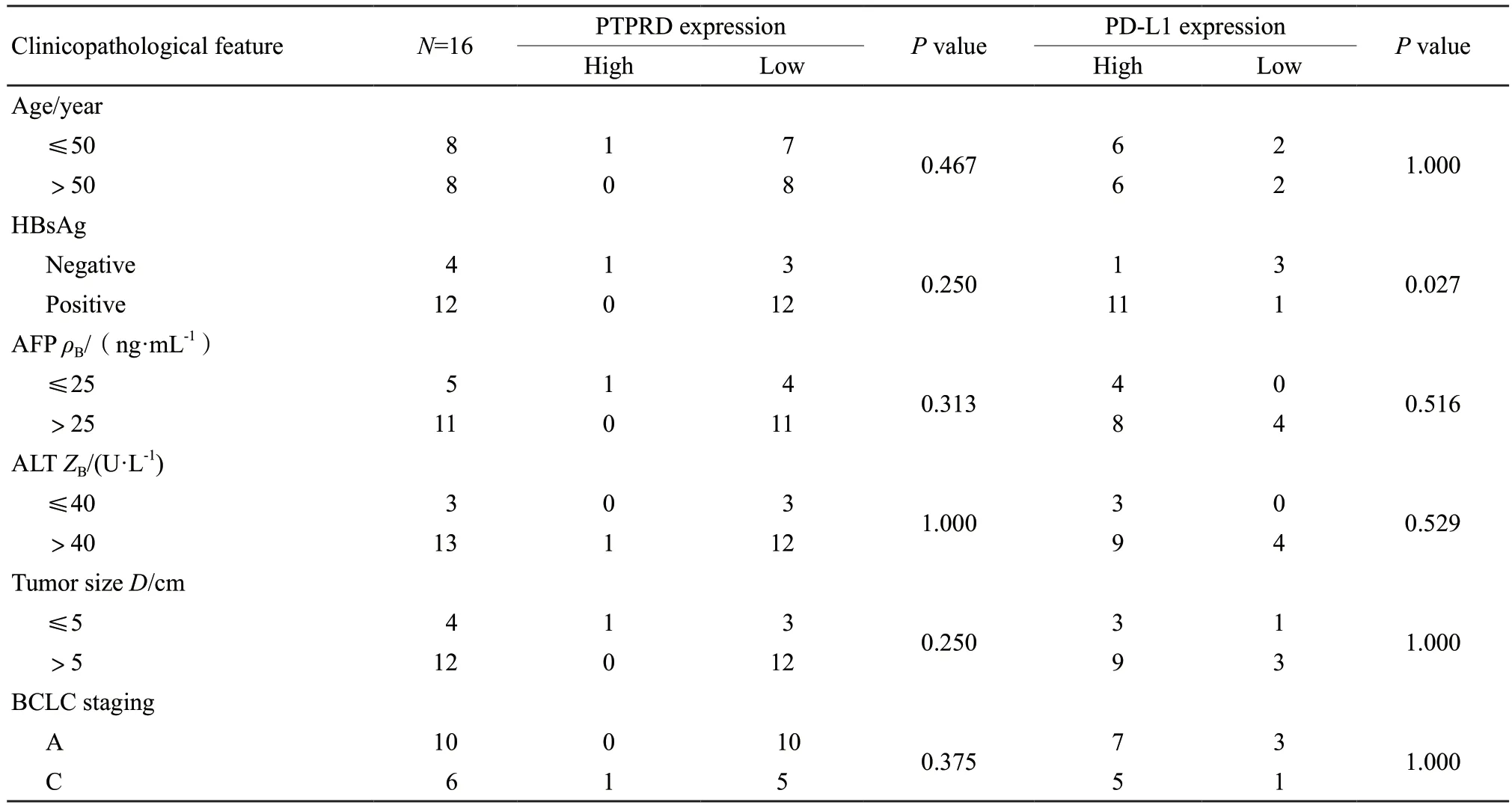
表1 16例肝细胞肝癌患者PTPRD及PD-L1的表达与临床病理特征之间的关系Tab.1 The relationship among the expressions of PTPRD and PD-L1 in paracancerous tissues and the clinicopathological characteristics of 16 hepatocellular carcinoma patients
2.2 肝癌组织中PTPRD和PD-L1 mRNA表达水平及相关性分析
肝癌癌组织中PTPRD基因表达显著低于癌旁组织,而PD-L1基因表达水平显著高于癌旁组织,差异有统计学意义(P<0.05,图2A)。利用Spearman相关分析显示,PTPRD与PD-L1 mRNA表达水平存在负相关趋势,与免疫组织化学染色结果相似(图2B)。

图2 RTFQ-PCR检测肝癌和癌旁组织中PTPRD和 PD-L1 mRNA的表达Fig.2 PTPRD and PD-L1 mRNA levels in hepatocellular carcinoma and paracancerous tissues evaluated by RTFQ-PCR
2.3 PTPRD基因改变对HepG2细胞中PTPRD和PD-L1表达的影响
HepG2细胞转染72 h后,采用RTFQ-PCR和Western blot检测PTPRD和PD-L1 mRNA表达和蛋白水平。结果显示,与空白组相比,PTPRD上调组的PTPRD mRNA(1.00±0.00vs2.17±0.34)和蛋白(0.70±0.28vs1.47±0.13)的表达水平均增高,PTPRD 沉默组的PTPRD mRNA(1.00±0.00vs0.24±0.07)和蛋白(0.70±0.28vs0.38±0.02)的表达水平有所下降,PTPRD mRNA的表达水平增高率或下降率均达75%以上。与空白组相比,PD-L1 mRNA(1.00±0.00vs0.60±0.08)和蛋白(1.68±0.07vs1.09±0.16)的表达水平在PTPRD上调组中下降;在PTPRD下调组中PD-L1 mRNA(1.00±0.00vs5.91±1.40)和蛋白的表达水平(1.68±0.07vs1.28±0.03)升高(P<0.05,图3)。
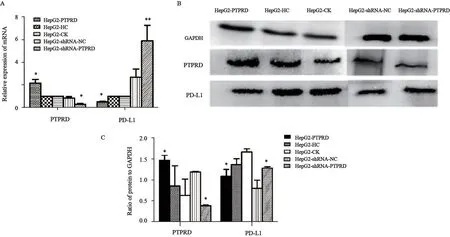
图3 上调或沉默PTPRD基因后PTPRD、PD-L1 mRNA表达和蛋白水平的变化Fig.3 The changes of PTPRD and PD-L1 mRNA expressions and protein level after overexpression or knockdown of PTPRD
2.4 PTPRD通过STAT3信号通路抑制肝癌细胞PD-L1的表达
为研究PTPRD对PD-L1的表达是否有调控作用,本研究进一步在PTPRD基因上调的HepG2细胞中检测STAT3和p-STAT3蛋白的表达水平。结果显示,与空白对照组、阴性对照组相比,PTPRD上调组中STAT3和p-STAT3蛋白的表达量显著下降,与PD-L1蛋白表达水平变化一致,差异有统计学意义(P<0.05,图4)。
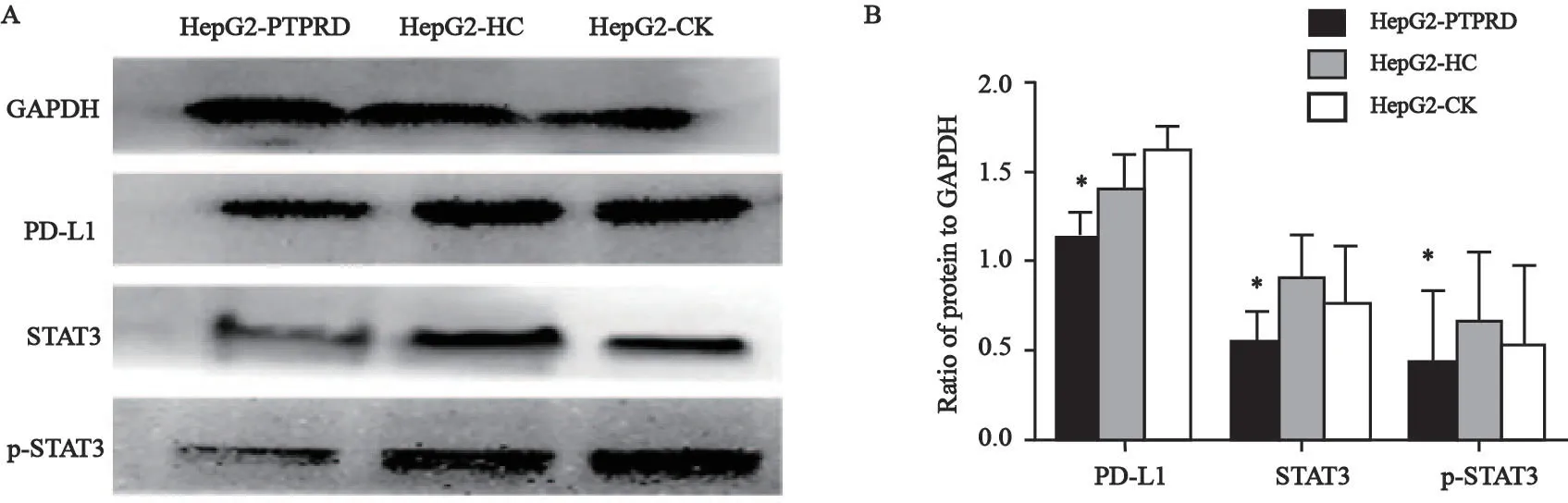
图4 上调PTPRD基因后STAT3、p-STAT3和PD-L1蛋白水平的变化Fig.4 The changes of STAT3,p-STAT3 and PD-L1 protein level in HepG2 cell after transfection
3 讨 论
肝癌是消化道系统常见的恶性肿瘤之一,一些临床前实验研究和临床试验数据均表明,肝细胞癌肿瘤内微环境具有高度免疫抑制性,晚期肝细胞癌中效应T细胞反应极差[9]。肿瘤免疫逃逸是肝癌进一步发展恶化的重要原因之一,肿瘤细胞PD-L1的过表达可促进肿瘤免疫逃逸[10]。PD-1/PD-L1抑制剂可以靶向抑制PD-1/PD-L1信号通路,诱导抗原肽-组织相容性复合体(major histocompatibility complex,MHC)与T细胞抗原受体(T cell receptor,TCR)重新结合,激活T淋巴细胞抗肿瘤免疫应答,抑制肿瘤细胞的生长[9]。近年来,使用PD-1/PD-L1抑制剂如纳武单抗和派姆单抗等的免疫疗法在非小细胞肺癌和胃癌等多种癌症的治疗中取得了巨大成功[11]。在2019年美国癌症研究协会大会上,一项关于pembrolizumab联合乐伐替尼治疗不可切除肝癌的研究报道,联合疗法达到了50%的有效率和93.3%的控制率,且安全性良好[12]。此研究展现了免疫疗法在肝癌治疗上的广阔前景,给不可切除和晚期肝癌患者带来更多生的希望。
有文献报道[13],PTPRD是多种肿瘤的抑制因子。本课题组前期研究发现[14],PTPRD的mRNA表达和蛋白水平在LO2人正常肝细胞中均显著高于HepG2和Huh7肝癌细胞,且PTPRD基因上调后,可明显抑制HepG2和Huh7肝癌细胞的增殖和迁移。已有大量研究显示[15-17],在神经胶质母细胞瘤、胰腺癌和肝癌等恶性肿瘤中PTPRD基因拷贝数的缺失或突变可以使STAT3活性增高,加快肿瘤细胞的生长,诱导PTPRD过表达后可抑制肿瘤细胞的生长。研究发现[18],肿瘤细胞异常激活的STAT3与PD-L1的启动子结合,激活DNA甲基转移酶1和甲基化启动子区域,抑制免疫蛋白酶体和MHC分子的表达,诱导PD-L1上调,促进肿瘤细胞逃避免疫监视。在本研究中,我们分别分析了16例肝癌癌组织和16例癌旁组织PTPRD和PD-L1的表达,结果发现PTPRD在肝癌组织中呈低表达,PD-L1则过表达,二者表达存在负相关性。PD-L1的高表达与肿瘤HBsAg有关,与患者年龄、甲胎蛋白值、谷丙转氨酶和巴塞罗那分期等临床病理学特征无关;同时,PTPRD的低表达与患者年龄、HBsAg、甲胎蛋白值、谷丙转氨酶和巴塞罗那分期等均无关,这可能与收集样本例数较少有关,这也是本实验的局限之处,导致在病理学特征统计上会存在偏倚。但从PTPRD和PD-L1存在负相关性可说明在肝癌发生、发展过程中,PTPRD基因缺失或突变后可能通过某种途径影响PD-L1的转录或蛋白表达过程。为进一步验证PTPRD基因对PD-L1的调节作用,我们分别构建PTPRD过表达和沉默的HepG2肝癌细胞系,观察PTPRD基因表达变化对PD-L1表达水平的影响。结果发现,PTPRD在肝癌细胞中可负向调节PD-L1的表达,当PTPRD基因上调时,PD-L1在mRNA和蛋白水平均显著下降;当PTPRD基因静默后,PD-L1的表达有所增高。为了阐明PTPRD调节PD-L1的分子机制,我们在PTPRD过表达的HepG2肝癌细胞中检测STAT3和p-STAT3蛋白的变化情况,结果显示,当PTPRD上调时,STAT3和p-STAT3蛋白显著下降,与PD-L1变化趋势一致。我们推测,在肝细胞癌中PTPRD缺失后可能通过STAT3通路调控PD-L1的表达,进而影响肿瘤微环境的免疫力。
综上所述,在肝癌中PTPRD与PD-L1 mRNA表达及蛋白水平呈负相关,PTPRD调节PD-L1表达的机制可能部分地通过调节STAT3信号通路。本研究可望为肝癌免疫治疗提供新的靶点,PTPRD基因对PD-L1的具体调控机制及是否会影响其下游相关因子PD-1进而影响免疫细胞T细胞的活性将是我们接下来的研究重点,我们将结合体内外实验深入探讨PTPRD的免疫调控功能,为提高肝癌免疫治疗效果寻找突破口。
