PRMT5在胃癌中的表达及其对胃癌细胞增殖、凋亡、迁移能力的影响
2020-05-19燕飞虎王一尧王芳芳冉浩男
燕飞虎,邹 瑞,王一尧,王芳芳,冉浩男,王 燕
1.海南省肿瘤医院中西医结合科,海南 海口 570100;
2.海南省肿瘤医院肝胆胰外科,海南 海口 570100;
3.海南省肿瘤医院放疗科,海南 海口 570100;
4.海南省肿瘤医院血液肿瘤科,海南 海口 570100
胃癌是起源于胃黏膜上皮的恶性肿瘤,发病率位居中国恶性肿瘤前列[1],其早期临床症状非常隐匿,一般确诊时已是中晚期。找到有效的生物标志物对胃癌进行早期筛查和检测,有利于对患者及时治疗,提高患者的生存率。胃癌的发病机制较复杂,可能与环境、幽门螺杆菌感染、遗传等多种因素有关[2],其中基因异常表达与肿瘤的关系是近年来的研究热点。蛋白精氨酸甲基转移酶5(protein arginine methyltransferase 5,PRMT5)是一种能调控细胞周期的酶,其定位于哺乳动物细胞的细胞质和细胞核,在多种肿瘤中均有异常表达,并能影响患者的预后[3-5]。目前关于PRMT5在胃癌发生、发展中的作用的相关研究尚少见。本研究观察PRMT5在胃癌组织中的表达水平,旨在探讨其对胃癌细胞增殖、凋亡、迁移能力的影响,为临床诊疗提供依据。
1 资料和方法
1.1 一般资料
收集2016年5月—2019年1月在海南省肿瘤医院确诊为胃癌并进行手术治疗的患者的胃癌组织及其癌旁组织(距离癌组织>5 cm)标本88例。其中男性48例,女性40例;年龄45~70岁,平均(54.33±10.47)岁。收集方式:确诊患者行胃癌手术时在胃镜观察下切下胃癌组织;保存方式:将切下的2~3块胃癌组织经液氮快速冷冻后置-80 ℃保存以备提取基因组DNA。
1.2 纳入标准与排除标准
纳入标准:符合胃癌的临床诊断标准[6],并经病理学检查确诊;年龄>18岁;术前均未进行放化疗等相关治疗。排除标准:合并其他系统或器官肿瘤者;处于妊娠或哺乳期者;临床资料不全者。本研究经海南省肿瘤医院伦理委员会批准实施。
1.3 方法
1.3.1 主要材料与试剂
实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒、10%胎牛血清、RPMI-1640培养基、磷脂酰丝氨酸结合蛋白-异硫氰酸荧光素/碘化丙啶(AnnexinⅤ-FITC/PI)细胞凋亡检测试剂盒、细胞转染试剂盒均购自上海沪震生物科技有限公司,BCA蛋白定量试剂盒购自天根生化科技(北京)有限公司,聚丁二酸丁二醇酯[poly(1,4-butylene succinate),PBS]、苯酚购自北京康普汇维科技有限公司,TRIzol 总RNA提取试剂购自合肥博美生物科技有限公司,PRMT5单克隆抗体、内参GAPDH抗体、Transwell小室均购自上海安研商贸有限公司,人胃癌细胞系SGC-7901由海南省肿瘤医院医学与肿瘤研究中心提供。
1.3.2 主要仪器
WS-300恒温培养箱购自上海旦鼎国际贸易有限公司,YKDZ-55显微镜购自上海永科光学仪器有限公司,DXFLEX流式细胞检测仪购自美国贝克曼库尔特公司,酶标仪购自上海纤检仪器有限公司,DYCP-31DN琼脂糖水平电泳仪购自上虞艾科仪器设备有限公司,DP/ZB紫外线投射仪购自北京亚欧德鹏科技有限公司。
1.3.3 蛋白质印迹法(Western blot)检测PRMT5在胃癌组织中的表达
将88例胃癌组织和癌旁正常组织标本放入预冷的研钵中,研磨成粉,加入适量RIPA裂解液,裂解30 min后,离心15 min,取上清液。按照BCA试剂盒说明书上的操作步骤检测蛋白浓度。将蛋白样品和上样缓冲液充分混匀,置于沸水中煮沸变性5 min,将变性的蛋白放入十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶上样孔中,每孔加入25 μL,经凝胶电泳分离蛋白组分后,将蛋白转印于聚偏二氟乙烯膜上,加入5%脱脂奶粉封闭2 h;加入PRMT5单克隆抗体(1∶500)于4 ℃低速摇动温育过夜,加入辣根过氧化物酶标记的二抗(1∶1 000)于37 ℃低速摇动温育45 min,以GAPDH为内参,电化学发光显色后胶片曝光并分析结果。PRMT5蛋白在胃癌组织中的表达量以胃癌组织PRMT5条带灰度值与对应的GAPDH条带灰度值之比表示。
1.3.4 细胞培养
从液氮中取出细胞系,于37 ℃溶解后加到含有10%胎牛血清的RPMI-1640培养基中,离心去除上清液,向细胞沉淀物中加入细胞培养液悬浮细胞,接种到细胞培养瓶中,于37 ℃、湿度95%、CO2体积分数为5%的环境中培养24 h。当细胞融合度达到90%以上时,去除培养液,用胰蛋白酶消化细胞,将对数生长期细胞用于实验。
1.3.5 细胞转染
将对数生长期的SGC-7901细胞以105个细胞/mL接种至6孔细胞培养板中,每孔2 mL,培养过夜。按照LipofectaminTM2000转染说明书进行转染,转染分3组:PRMT5小干扰RNA(PRMT5-siRNA)组加入12 μL PRMT5-siRNA转染SGC-7901细胞;阴性对照无意义siRNA序列(siRNANC)组加入12 μL siRNA空载对照转染SGC-7901细胞;对照组为未转染的SGC-7901细胞。
靶向PRMT 5 的siRNA 序列顺义链为5’-GGGACUGGAAUACGCUAAUTT-3’,反义链为5’-AUUAGCGUAUUCCAGUCCCTT-3’;阴性对照(si)序列顺义链为5’-UUCUCCGA ACGUGUCACGUTT-3’,反义链为5’-ACGUG ACACGUUCGGAGAATT-3’。
1.3.6 转染后细胞中PRMT5 mRNA表达和蛋白水平检测
转染24 h后,将1.3.5中的3组细胞用TRIzol法提取总RNA,用RTFQ-PCR试剂盒进行反转录反应,将cDNA,产物进行PCR扩增:95 ℃预变性5 min,94 ℃ 30 s,54 ℃ 45 s,72 ℃ 60 s,72 ℃ 10 min,35个循环,分别取5 μL RTFQ-PCR产物行琼脂糖凝胶电泳,紫外灯下拍照,采用Image Pro Plus图像分析软件比较电泳条带相对光密度值,以GAPDH为内参基因,分析PRMT5 mRNA相对表达量。取转染48 h后1.3.5中3组细胞,转移细胞至新的离心管,离心5 min,加入TRIzol并进行裂解反应30 min,离心取上清液,BCA蛋白定量试剂检测蛋白浓度,按照1.3.3方法检测各组细胞PRMT5蛋白表达水平。
1.3.7 细胞增殖检测
将转染24 h的上述3组细胞以3×105个/mL分别接种于96孔板细胞培养板中,每孔加入150 μL细胞悬液,置于37 ℃、湿度95%、CO2体积分数为5%的环境中分别培养12、24和48 h后,每孔加入细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂10 μL,37 ℃培养4 h,用酶标仪测定各组450 nm处的光密度(D)值,计算细胞增殖率。细胞增殖率=(D转染组细胞/D对照组细胞)×100%。
1.3.8 细胞凋亡检测
取培养24 h的1.3.5中各组细胞,将细胞分别重悬于RPMI-1640培养基中,将重悬后的各组细胞接种于96孔板中,4×103个/孔,于37 ℃、湿度95%、CO2体积分数为5%的环境中分别培养12、24和48 h后,胰蛋白酶消化重悬,转移至离心管,调整每管细胞数约为1×105个,预冷PBS洗涤2次,按照凋亡试剂盒说明,向细胞中加入AnnexinⅤ10 μL,避光温育10 min,预冷PBS洗涤2次,向每管中加入PI溶液4 μL,立即采用流式细胞术检测细胞凋亡率。细胞凋亡率=凋亡细胞数/(正常细胞数+凋亡细胞数)×100%。
1.3.9 细胞迁移能力检测
取培养24 h的1.3.5中各组细胞,将其接种于24孔板内培养,待细胞长满单层后,用灭菌200 μL吸嘴在细胞单层上划痕,用倒置显微镜观察划痕区域宽度并拍照,然后置于培养箱中温育24 h后在倒置显微镜下观察划痕区域宽度变化,用Image软件测量划痕区域宽度,计算各组细胞对应细胞的划痕愈合率,每组细胞设置3个复孔,取平均值为最终结果。
1.3.10 细胞侵袭能力检测
将Transwell小室进行包被Matrigel基底胶处理。在24孔中加入含10%无双抗的RPMI-1640培养基600 μL,将小室放在其中进行水化预处理,小室上孔加入含10%血清培养基,于37 ℃、湿度95%、CO2体积分数为5%的环境中培养24 h,取出小室,多聚甲醛固定30 min,结晶紫染色液染色15 min。随机选取5个视野拍照计数。
1.3.11 Western blot检测蛋白水平
取转染后培养48 h的1.3.5中各组细胞,按照1.3.3 中方法提取细胞蛋白并检测培养48 h时cleaved caspase 3、磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)和磷酸化AKT(phosphorylated-AKT,p-AKT)蛋白水平。
1.4 统计学处理
以Bioimagining System灰度测量系统测量条带灰度值;采用SPSS 20.0进行统计学数据处理,计数资料用频数表示,比较用χ2检验,计量资料用()表示,比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PRMT5在胃癌组织中高表达
Western blot检测结果显示,胃癌组织中PRMT5的蛋白相对表达量(0.54±0.64)高于癌旁组织(0.24±0.05)(P<0.01,图1)。
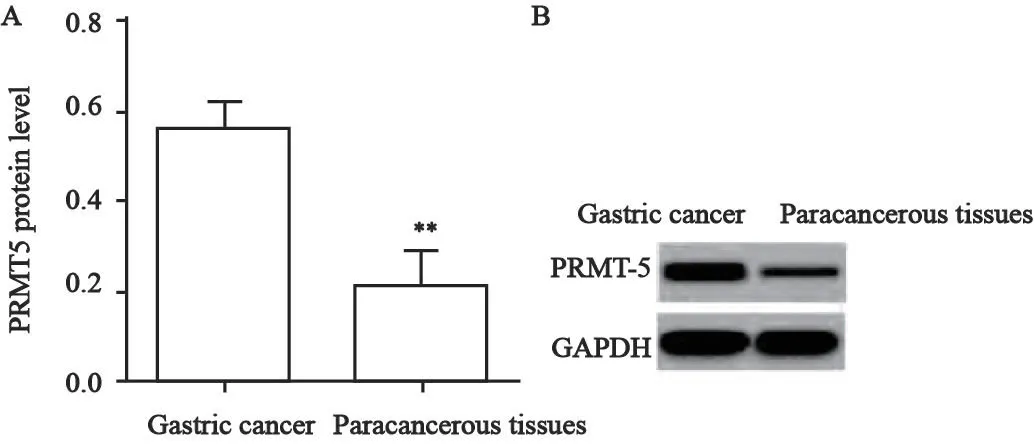
图1 PRMT5在胃癌组织中的表达Fig.1 Expression of PRMT5 in gastric cancer tissues
2.2 胃组织中PRMT5蛋白表达水平与病理学分级及淋巴结转移呈正相关
经统计分析可知,PRMT5蛋白表达量在不同胃癌病理分级、TNM分期及是否有淋巴结转移患者中差异有统计学意义(P均<0.05),而在不同性别、年龄患者中差异无统计学意义(P均>0.05,表1)。
2.3 siRNA能沉默人胃癌细胞系SGC-7901 PRMT5基因的表达
空脂质体、siRNA-NC、PRMT5-siRNA转染人胃癌细胞系SGC-7901 48 h后,RTFQ-PCR和Western blot检测各组织中PRMT5 mRNA表达和蛋白水平。结果显示,siRNA-NC组细胞中PRMT5 mRNA和蛋白相对表达量(0.83±0.32)与对照组(0.81±0.40)相比差异无统计学意义(P>0.05),PRMT5-siRNA组细胞中PRMT5 mRNA(0.21±0.31)和蛋白相对表达量(0.39±0.30)低于对照组和siRNA-NC组(0.41±0.29、0.83±0.32)(P<0.05,图2)。
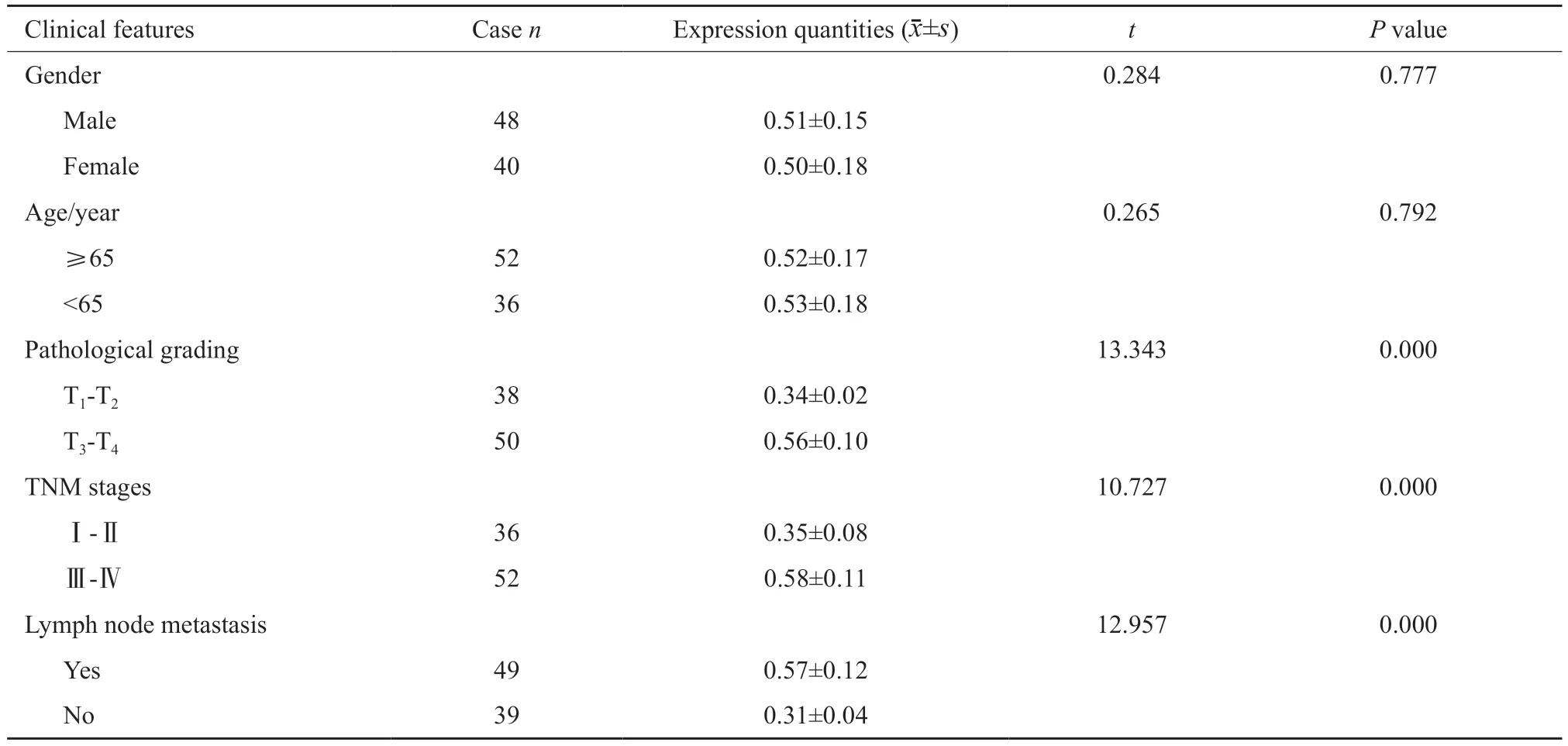
表1 PRMT5表达水平与胃癌临床特征的关系Tab.1 Relationship between expression level of PRMT5 and clinical features of gastric cancer
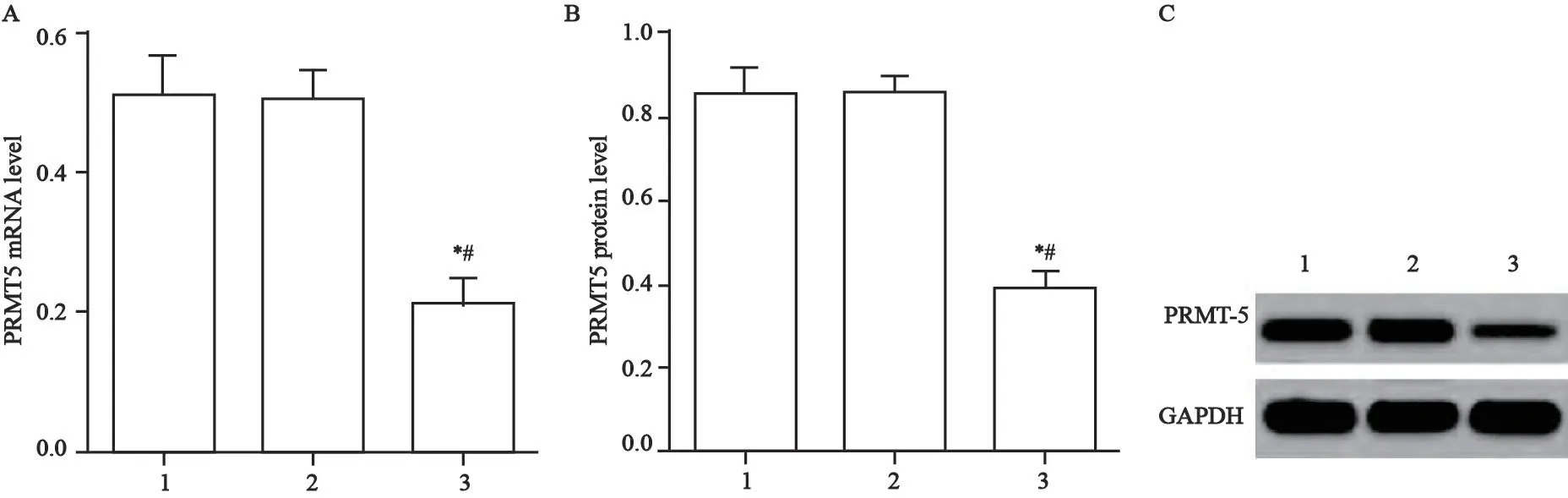
图2 PRMT5在转染后细胞中的表达Fig.2 Expression of PRMT5 in cells after transfection
2.4 沉默PRMT5能抑制人胃癌细胞系SGC-7901增殖
在12 h时,PRMT5-siRNA组细胞增殖率为(8.01±1.00)%,显著低于siRNA-NC组的(21.10±2.14)%和对照组的(22.21±2.00)%(图3)。
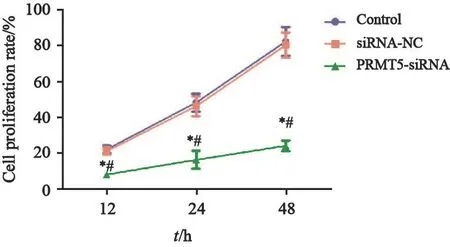
图3 沉默PRMT5对人胃癌细胞系SGC-7901增殖的影响Fig.3 Effects of silencing PRMT5 on proliferation of human gastric cancer cell line SGC-7901
2.5 沉默PRMT5能促进胃癌细胞系SGC-7901凋亡
PRMT5-siRNA组Cleaved caspase 3蛋白相对表达量为0.75±0.04,显著高于对照组的0.21±0.02和siRNA-NC组的0.22±0.02。12 h时PRMT5-siRNA组细胞凋亡率为(12.21±1.01)%,显著高于对照组的(2.10±0.10)%和siRNA-NC组的(2.30±0.12)%,差异有统计学意义(P<0.05);24 h时PRMT5-siRNA组细胞凋亡率为(17.25±3.01)%,显著高于对照组的(4.25±0.89)%和siRNA-NC组的(4.15±0.98)%;48 h时PRMT5-siRNA组细胞凋亡率为(20.89±5.21)%,显著高于对照组的(5.21±1.02)%和siRNA-NC组的(5.20±1.11)%,差异有统计学意义(P<0.05,图4)。
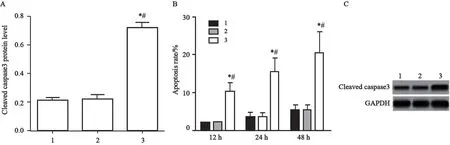
图4 沉默PRMT5对人胃癌细胞系SGC-7901凋亡的影响Fig.4 Effects of silencing PRMT5 on apoptosis of human gastric cancer cell line SGC-7901
2.6 PRMT5能抑制人胃癌细胞系SGC-7901迁移和侵袭能力
PRMT5-siRNA组划痕愈合率为(42.52±5.32)%,显著低于对照组的(84.88±7.65)%和siRNA-NC组的(84.25±7.52)%,差异有统计学意义(P<0.05);PRMT5-siRNA组细胞侵袭数(22.21±1.36)个,显著低于对照组的(240.69±16.98)个和siRNA-NC组的(241.31±17.52)个,差异有统计学意义(P<0.05,图5)。

图5 沉默PRMT5对人胃癌细胞系SGC-7901迁移能力和侵袭能力的影响Fig.5 Effects of silencing PRMT5 on migration and invasion abilities of human gastric cancer cell line SGC-7901
2.7 抑制PRMT5的表达对P13K、AKT、p-AKT蛋白水平的影响
各组细胞转染后培养48 h,Western blot检测结果显示,PRMT 5-siRNA 组P13K、AKT、p-AKT蛋白相对表达分别为0.11±0.02、0.2 1±0.01、0.2 3±0.02,显著低于对照组(0.22±0.02、0.58±0.06、0.57±0.08)和siRNA-NC 组(0.2 3±0.03、0.58±0.05、0.57±0.07),差异有统计学意义(P<0.05,图6)。

图6 抑制PRMT5的表达对P13K、AKT、p-AKT蛋白水平的影响Fig.6 Effects of PRMT5 inhibition on level of P13K,AKT and p-AKT
3 讨 论
胃癌恶性程度高,生存率低,预后较差[7]。探讨胃癌细胞增殖转移的病理生理机制对胃癌的预防和治疗具有重要意义。PRMT5是一种Ⅱ型蛋白精氨酸甲基转移酶,它可改变生物的遗传表观特性,能阻碍抑癌基因的转录,还能调控细胞周期,促进多种肿瘤细胞异常增殖,与肿瘤的浸润、转移密切相关[8-10]。目前国内外关于PRMT5与胃癌细胞增殖、凋亡、迁移关系的研究较少。
基因在癌组织或邻近正常组织中异常表达,则认为该基因可能具有潜在的调控癌细胞增殖及凋亡的作用[11-12]。Kanda等[11]研究发现,PRMT5在胃癌组织中高表达,与胃癌的恶性转移有关。Kong等[13]实验指出,使用PRMT5抑制剂可抑制胃癌细胞生长。本研究结果显示,胃癌组织的PRMT5蛋白相对表达量显著高于癌旁组织。本研究结果与上述研究结果一致,说明PRMT5高表达是胃癌发生、发展的重要因素,可能是潜在调控胃癌细胞增殖的致癌基因。
肿瘤分化程度的高低、对周围组织或器官的侵犯与否、侵犯的程度及淋巴结转移是评估肿瘤患者病情严重程度及预后的重要指标。Kong等[13]研究表明,PRMT5蛋白相对表达量与胃癌患者的TNM分期、远处转移、淋巴结转移密切相关。本研究结果显示,PRMT5蛋白相对表达量在病理分级、TNM分期更高、有淋巴结转移的患者中更高。本研究观点与上述研究观点一致,提示PRMT5高表达与胃癌的转移恶化密切相关。
RNA干扰是指由双链RNA诱发的、同源mRNA的基因沉默,该技术可以特异性剔除或关闭特定基因的表达,可用于基因功能的探索及恶性肿瘤的基因治疗[14-15]。如沉默P27RF-Rho基因可降低肝癌细胞的增殖和侵袭能力[16]。胃癌细胞的增殖分化可通过沉默长链非编码RNAUCA1基因实现,可作为肿瘤基因靶向治疗的依据[17]。目前关于沉默PRMT5基因对胃癌增殖、凋亡和迁移影响的研究较少,为进一步研究PRMT5基因在胃癌发生、发展中的作用,本研究将PRMT5质粒通过脂质体转染至胃癌细胞SGC-7901中,结果显示,通过沉默PRMT5基因表达,可抑制胃癌细胞系SGC-7901的增殖、迁移并促进其凋亡,说明PRMT5促进胃癌的进展,这可能是因为,一方面PRMT5可能通过上调细胞周期蛋白和相关调节因子,加速癌细胞增殖分裂;另一方面,PRMT5可干扰组蛋白精氨酸甲基转移酶1甲基化转录因子E2F1[18],而甲基化的E2F1是细胞凋亡的促进因子。
细胞凋亡也称为“固缩坏死”、“程序性细胞死亡”或“细胞自杀”,是由基因介导的一系列的细胞学变化,是存在于细胞中的自毁机制[19]。正常情况下,通过这个过程,机体能清除衰老及异常细胞,并在维持很多细胞功能方面有重要作用,如该过程发生病理性干扰,肿瘤细胞则会因为存在凋亡缺陷而不断增殖[20]。Caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是细胞毒性T淋巴细胞杀伤机制的重要组成部分,其主要底物多聚腺苷二磷酸核糖聚合酶与DNA修复、基因完整性监护有关,能负调控使Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解核小体间的DNA,引起细胞凋亡[21-22]。本研究中沉默PRMT5基因后检测cleaved caspase 3蛋白表达结果显示,沉默PRMT5能上调cleaved caspase 3的表达,说明沉默PRMT5的表达导致胃癌细胞系SGC-7901的凋亡率增加可能通过上调cleaved caspase 3的表达实现。
PI3K/AKT信号通路是肿瘤形成中至关重要的信号通路。该通路主导细胞的增殖、凋亡、迁移、侵袭等过程,一旦紊乱会导致癌症、神经病变等[23]。PI3K是一种胞内磷脂酰肌醇激酶,与V-SRC和V-RAS等癌基因的产物相关,且PI3K本身具有丝氨酸/苏氨酸激酶的活性,也具有磷脂酰肌醇激酶的活性,当接受来自酪氨酸激酶和G蛋白偶联受体的信号后,PI3K的p85调节亚基即被募集到临近质膜的部位,使AKT从细胞质转移到细胞膜上,并在3-磷酸肌醇依赖性蛋白激酶1和3-磷酸肌醇依赖性蛋白激酶2的辅助下,分别使AKT蛋白上的苏氨酸磷酸化位点和丝氨酸磷酸化位点磷酸化而使其激活,刺激肿瘤细胞的增殖[24-25]。有研究显示,胃癌细胞的凋亡可通过抑制PI3K/AKT信号通路实现[26]。也有文献指出,胃癌细胞的迁移、侵袭能力降低与影响PI3K/AKT信号通路有关[27]。本研究结果显示,沉默PRMT5能下调PI3K、p-AKT蛋白水平,且能降低胃癌细胞的迁移和侵袭能力,说明PRMT5促进胃癌细胞增殖、迁移和侵袭,抑制其细胞凋亡是通过激活PI3K/AKT信号通路实现的。
综上所述,PRMT5在胃癌组织中表达明显升高,其表达水平与胃癌的发生、发展、转移、恶化密切相关,下调PRMT5的表达可明显减弱胃癌细胞的增殖、迁移能力,同时促进胃癌细胞的凋亡。
