胶质瘤相关癌基因同源蛋白2促进结肠癌细胞系SW620的上皮-间质转化
2020-05-19
重庆医科大学附属第一医院胃肠外科,重庆 400016
结直肠癌是一种消化道常见恶性肿瘤,近年来发病率呈明显上升趋势,根据国家癌症中心2015年癌症统计数据,中国结直肠癌的发病率和死亡率均位列第5位[1]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞在特定的生理和病理情况下极性消失,黏附力下降,骨架重塑,转变成运动能力增强的间质样上皮的现象。它不仅与胚胎发育、创伤修复密切相关,而且新近研究表明,它是肿瘤细胞发生侵袭和转移的关键启动步骤[2]。而肿瘤转移又是影响患者预后不良的关键问题,因此深入研究EMT发生的分子机制显得尤为重要。胶质瘤相关癌基因同源蛋白2(glioma-associated oncogene homologue 2,GLI2)作为Hedgehog(Hh)信号通路重要的转录因子,具有转录激活Hh通路的作用,它不仅对细胞分化与器官发育调节有重要作用,而且最新研究发现它在多种肿瘤细胞中异常激活,参与肿瘤增殖和转移的恶性进程[3]。但目前在结肠癌中关于GLI2与EMT关系的研究较少,本研究拟探讨GLI2与结肠癌细胞系SW620的EMT的关系,进一步阐明结肠癌EMT发生的分子机制。
1 材料和方法
1.1 材料和细胞系
SW620、SW480、HCT116、HT29和HUⅤEC 细胞系由重庆医科大学附属第一医院中心实验室提供。干扰人GLI2 的慢病毒(shRNA:5’-GATCTGGACAGGGATG ACT-3’)和空载体慢病毒(shRNA:5’-TTCTCC GAACGTGTCACGT-3’)购自上海纽恩生物科技有限公司,实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)相关试剂盒购自宝生物工程(大连)有限公司,抗人GLI2抗体购自美国Santa Cruz公司,抗人p-AKT抗体购自美国Cell Signaling公司,抗人N-cadherin、vimentin、MMP2和E-cadherin抗体、鼠抗人GAPDH抗体、辣根过氧化物酶(HRP)标记的羊抗兔和羊抗鼠二抗购自武汉三鹰生物技术有限公司,Matrigel基质胶购自美国Becton Dickinson公司,蛋白质印迹法(Western blot)相关试剂购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养
细胞用含10%胎牛血清、5%青霉素-链霉素双抗RPMI-1640或DMEM培养基置于37 ℃、CO2体积分数为5%的培养箱中培养。
1.2.2 RTFQ-PCR检测细胞mRNA表达
细胞常规培养72 h后,按说明书用TRIzol法抽提各组RNA、逆转录获得cDNA,再用SYBY荧光定量试剂盒进行PCR实时扩增,反应在CFX 96型RTFQ-PCR仪上进行,条件:预变性95 ℃ 30 s,然后95 ℃ 5 s,60℃30 s,反应40个循环,结果以2-ΔΔCt值表示待测样本基因表达量相对于校准样本基因表达量的倍数。各引物序列如下:E-cadherin上游引物为5’-TGGCTTCCCTCTTTCATCTCC-3’,下游引物为5’-TCATAGTTCCGCTCTGTCTTTGG-3’,GLI2 上游引物为5’-GGTGTATCCCACGGAAAGCA-3’,下游引物为5’-AAAGCCTAACTGGCATCCTCC-3’;GAPDH上游引物为5’-CTTTGGTATCGTGGAAGGACTC-3’,下游引物为5’-GTAGAGGCAGGGATGATGTTCT-3’,实验重复3次。
1.2.3 分组及慢病毒感染
实验设干扰组(感染干扰慢病毒)、空病毒组(感染空病毒)、对照组(SW620细胞)。取对数生长期细胞,调整细胞成1×106个/mL,铺6孔板(每组设3个复孔),每孔铺2×105个细胞,细胞贴壁后,以MOI 30加入GLI2干扰慢病毒和空载体慢病毒,每孔液体总容量保持在1 mL,每孔加入5 μg的Polybrene,24 h后换夜,72 h后用荧光显微镜摄像。
1.2.4 Transwell小室检测细胞侵袭及迁移能力
侵袭实验:将Matrigel基质胶用无血清培养基1∶3稀释后取40 μL铺Transwell小室(8 μm)上室,紫外线照射过夜,实验前用无血清培养液水化,各组取400 μL细胞悬液加入上室,下室加10%胎牛血清培养液600 μL,常规培养24 h,擦去上室基质胶和细胞,多聚甲醛固定,结晶紫染色、封片,显微镜下计数5个视野平均穿膜细胞数。迁移实验:上室内不铺胶,余操作同前,实验重复3次。
1.2.5 黏附实验
取对数生长期的SW620和HUⅤEC细胞制成细胞悬液,分别取100 μL/1×105个SW620和HUⅤEC细胞接种于96孔板除第1、7、12列的A~C排孔和E~G排孔,培养至细胞基本铺满孔板底部;取空病毒组细胞100 μL/1×105个加至96孔板第3至7列除D排的A~G孔内,等量干扰组细胞加入第8~12列除D排的A~G孔内,每隔30 min吸出3、8列,4、9列,5、10列,6、11列所有孔上清液,120 min后离心,吸出2、7、12列所有孔内上清液,吸出后每孔用磷酸盐缓冲溶液(phosphate-buffered saline,PBS)液轻洗,每孔加入100 μL无血清培养基后再加入20 μL MTT,4 h后离心去上清液后每孔加入150 μL二甲基亚砜(DMSO),即在570 nm波长处测吸光度(D)值;计算同(异)种黏附率=[D同(异)种各时间段-D同(异)种空白组]/D空病毒组或干扰组,对照组黏附能力变化检测同上,实验重复3次。
1.2.6 Western blot检测细胞GLI2、p-AKT、N-cadherin、vimentin、MMP2和E-cadherin蛋白水平
将各组细胞裂解后取上清液,用二喹啉甲酸(bicinchoninic acid,BCA)法定量。每孔加等量蛋白样品,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳,然后电转至聚偏二氟乙烯膜(polyvinylidene fluoride,PⅤDF膜)后封闭2 h,加入稀释后的一抗:抗GLI2抗体(1∶1 000)、抗p-AKT抗体(1∶1 000)、抗MMP-2抗体(1∶500)、抗N-cadherin抗体(1∶500)、抗vimentin抗体(1∶500)、抗E-cadherin抗体(1∶500)和抗GAPDH抗体(1∶2 000),4 ℃温育过夜,TBST洗膜,加入对应二抗,室温1.5 h,漂洗后用ECL发光试剂盒显影。凝胶成像系统扫描分析,以目的蛋白与GAPDH的灰度值比值代表目的蛋白的表达水平,实验重复3次。
1.3 统计学处理
采用SPSS 19.0统计学软件,所有数据用表示,多组之间比较采用单因素方差分析,两组之间的比较采用最小显著差别(least significant difference,LSD)法。P<0.05为差异有统计学意义。
2 结果
2.1 E-cadherin在4组细胞系中的表达情况
SW620与SW480、HCT116、HT29 细胞系相比E-cadherin mRNA表达量最低(P<0.05,图1)。E-cadherin表达减少是细胞发生EMT最主要的标志。故本实验选取该SW620进行后续研究。
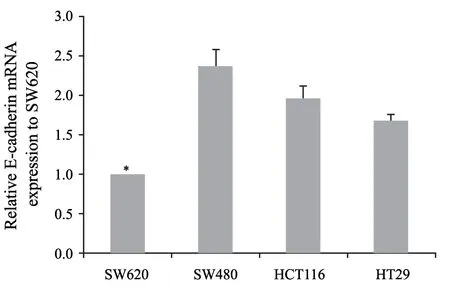
图1 4组细胞系E-cadherin mRNA相对表达量Fig.1 The relative expression of E-cadherin mRNA in the four groups
2.2 重组慢病毒感染效果判定
荧光显微镜观察显示,感染干扰慢病毒和空载体慢病毒72 h后,两组SW620细胞均可见绿色荧光表达,转染效率均达90%以上(图2)。干扰组GLI2 mRNA的表达量约为对照组的0.31倍(P<0.05),蛋白的相对表达量约为对照组的0.44倍(P<0.05,图3)。
2.3 细胞侵袭和迁移能力情况
侵袭实验发现,干扰组穿膜细胞数(57.5±4.6)明显少于对照组(8 7.8±8.2)和空病毒组(80.3±4.8)(P<0.05)。迁移实验发现,干扰组组穿膜细胞数(156.1±7.5)明显少于于对照组(241.2±13.4)和空病毒组(224.8±10.6)(P<0.05,图4~5)。侵袭和迁移实验中,对照组与空病毒组相比差异均无统计学意义(P>0.05)。
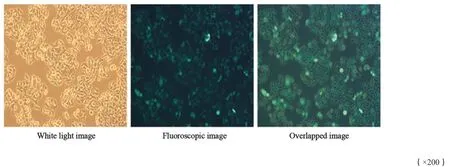
图2 干扰慢病毒感染SW620的荧光图像Fig.2 Fluoroscopic image of SW620 infected with interference lentivirus
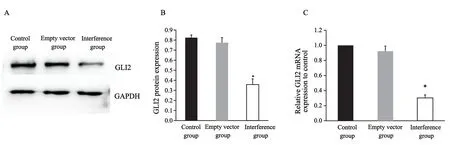
图3 干扰慢病毒感染SW620后GLI2表达变化Fig.3 Expression of GLI2 in SW620 after infection with interference lentivirus
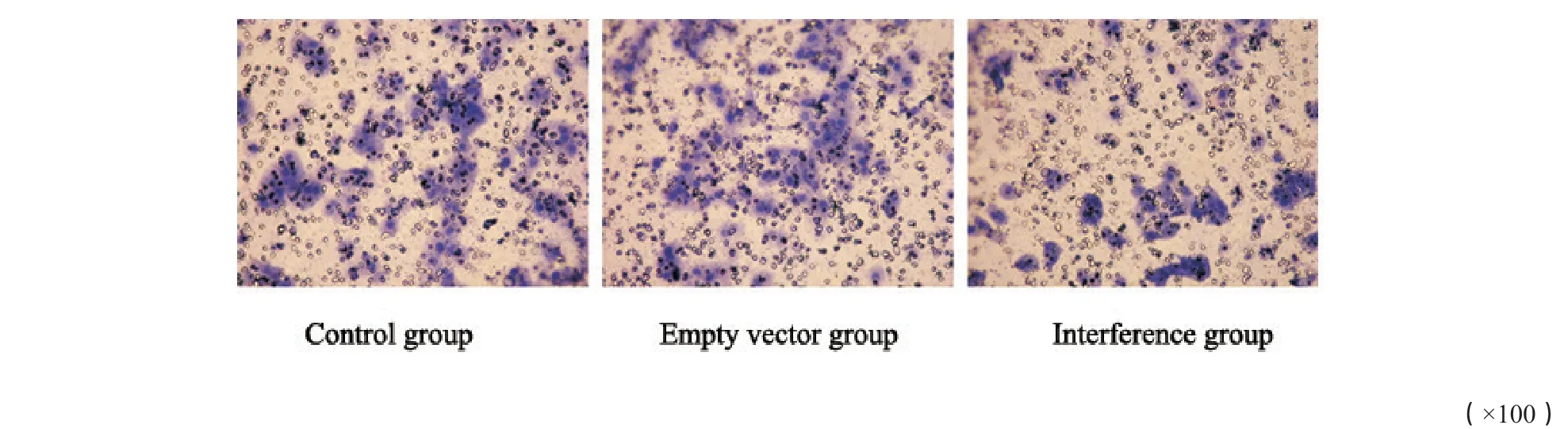
图4 3组细胞侵袭能力比较Fig.4 Comparison of the invasion ability in the three groups
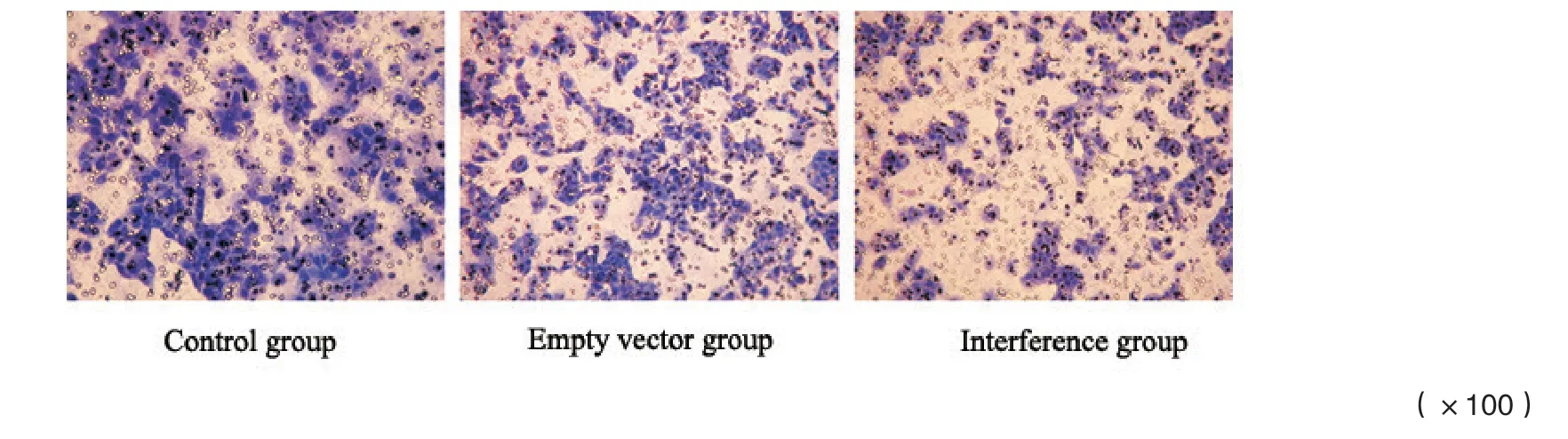
图5 3组细胞迁移能力比较Fig.5 Comparison of the migration ability in the three groups
2.4 细胞黏附率情况
在波长570 nm下测量D值算出各时段细胞间黏附率。结果显示,干扰细胞在90和120 min时间点的同种细胞黏附率高于对照组和空病毒组(P<0.05),在60、90和120 min时间点的异种细胞黏附率低于对照组和空病毒组(P<0.05,表1)。
2.5 Western blot检测p-AKT、E-cadherin、N-cadherin、vimentin和MMP2蛋白的表达。
干扰组p-AKT、N-cadherin、vimentin和MMP2蛋白表达量均低于对照组和空病毒组(P<0.05),E-cadherin蛋白表达量高于对照组和空病毒组(P<0.05,图6)。
表1 同种及异种细胞间黏附率的比较Tab.1 Comparision of intercellular adhesion rate between the homogeneous and heterogeneous cells(,N=3)
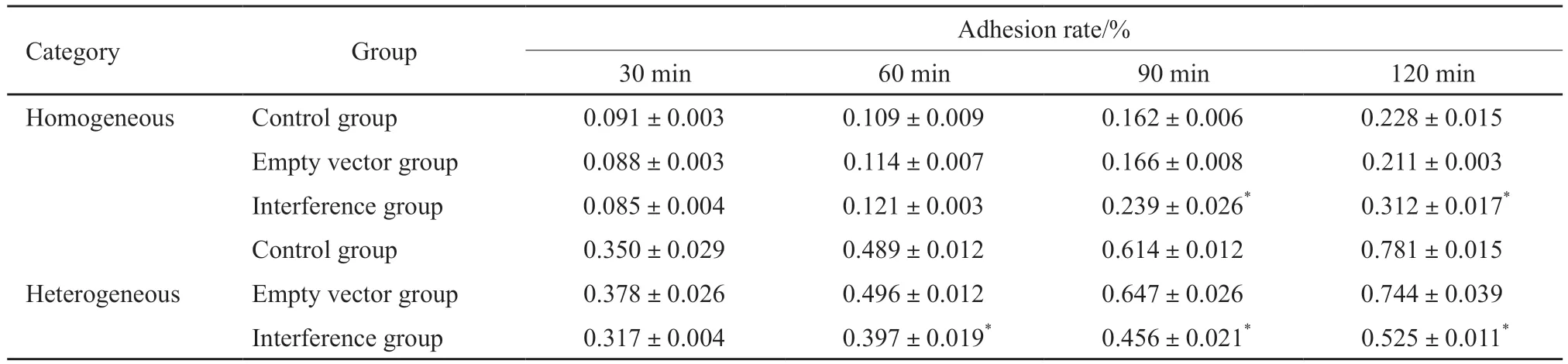
表1 同种及异种细胞间黏附率的比较Tab.1 Comparision of intercellular adhesion rate between the homogeneous and heterogeneous cells(,N=3)
*:P<0.05,compared with control group and empty vector group
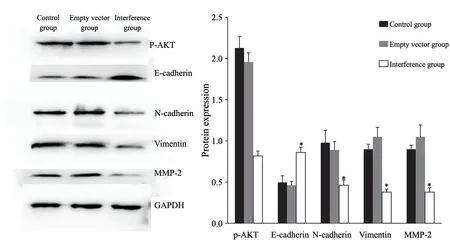
图6 各组细胞p-AKT、E-cadherin、N-cadherin、vimentin和MMP2蛋白的表达Fig.6 The protein expressions of p-AKT,E-cadherin,N-cadherin,vimentin and MMP2 in each group
3 讨 论
肿瘤转移是指肿瘤细胞脱离原发生长部位,通过各种转运途径,在远离原发灶处形成同质肿瘤的过程,它是影响患者预后最主要的因素。这个过程极其复杂,涉及细胞之间黏附能力改变,细胞外基质的降解以及细胞运动能力的改变等各个方面。EMT作为浸润迁移过程中的重要现象,已被证实是肿瘤转移的重要机制之一[4]。上皮细胞发生EMT后,细胞由上皮样表型向间质表型转换,维持上皮细胞之间黏附的上皮标志物E-cadherin等表达水平会降低,间质细胞表型标志物vimentin、N-cadherin等表达水平增加[5]。这些生物学标志的改变会使得细胞骨架重构,细胞极性和黏附力改变,运动能力增强,从而发生转移。
Hh信号通路是近年来肿瘤领域研究热点之一,Hh信号通路由Hh信号多肽、跨膜蛋白受体、跨膜蛋白及转录因子GLI等组成[6]。该通路不仅能够参与正常组织的增殖和分化,而且它的异常激活还与多种恶性肿瘤的发生、发展密切相关[7]。它通过与Notch、phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)、RAS等多种信号通路交联,共同促进肿瘤的发生、发展[8]。GLI作为Hh信号通路终末转录因子,是Hh信号通路产生效应的关键,GLI蛋白进入细胞核后,通过对下游靶基因的调节来影响恶性肿瘤的发展,GLI2作为既有激活功能又有抑制功能的关键因子受到越来越多研究者的重视。有研究者发现,GLI2可以通过转录激活下游的ARHGEF16来促进人胶质瘤细胞的增殖和转移[9]。Yue等[10]同样发现Shh/GLI信号通路还能通过促进肺癌细胞发生EMT来促进肿瘤细胞的转移。但是目前关于GLI2与结肠癌EMT及转移的关系仍不清楚。
为探讨GLI2对结肠癌细胞的EMT及转移能力的影响,本研究首先对4种人结肠癌细胞系SW620、SW480、HCT116和HT29中E-cadherin mRNA表达进行检测,发现E-cadherin在SW620中的表达明显降低,而E-cadherin是介导上皮细胞间黏附的标志分子,它表达减少是细胞发生EMT最主要的标志,这说明来自于淋巴转移灶的SW620细胞发生了较为明显的EMT,故实验选取该细胞系进行后续研究。然后研究者用重组慢病毒沉默了SW620细胞中GLI2的表达后发现,上皮细胞标志分子E-cadherin的表达水平显著增高,而间质细胞标志分子N-cadherin及vimentin 表达水平降低,这提示沉默SW620细胞GLI2的表达可以一定程度上逆转SW620细胞的EMT,研究者再通过transwell侵袭和迁移实验、黏附实验发现,干扰组细胞的侵袭、迁移能力减弱,同种细胞间黏附力增强,异种细胞间黏附力减弱,这提示GLI2能通过促进SW620细胞发生EMT来增强细胞的侵袭和迁移能力,最终导致肿瘤转移。
为进一步探讨GLI2促进SW620细胞发生EMT的机制,实验检测了细胞内p-AKT和MMP-2的表达情况,发现干扰组的p-AKT和MMP-2表达较对照组明显降低。p-AKT作为PI3K/AKT信号通路的核心分子,是该通路发挥生物学效应的关键。PI3K/AKT信号通路广泛存在于各种肿瘤中,它的异常激活与肿瘤的转移密切相关[11]。PI3K/AKT信号通路可以通过上调snail、twist等核转录因子和基质金属蛋白酶(matrix metalloproteinase,MMP)的表达,与Wnt、Notch等信号通过相互作用诱导EMT发生[12]。研究者发现Hh信号通路可以通过PI3K/AKT信号通路上调MMP-2、MMP-9 的表达来促进胶质瘤细胞的侵袭转移[13]。MMP-2是基质金属蛋白酶中重要的一员,它可以通过降解基底膜和细胞外基质来促进肿瘤细胞侵袭转移。Xiang等[14]发现抑制GLI2的表达能够通过MAPK/ERK通路下调MMP-2的表达从而降低细胞侵袭迁移能力。以上研究与本研究有相似之处。由此推测,在结肠癌SW620细胞系中GLI2可能通过促进细胞EMT的进程,参与肿瘤细胞的侵袭转移,其机制可能与p-AKT、N-cadherin、vimentin、MMP-2表达上调和E-cadherin表达下调相关。
EMT的发生涉及多种转录因子和信号通路,是一个复杂的网络结构,它影响肿瘤发生侵袭和转移的具体机制尚不清楚。本研究发现,在结肠癌SW620细胞系发生EMT的过程中可能涉及Hh/GLI通路和PI3K/Akt通路的关联,研究者将在后续研究中进一步通过特异性阻断Hh通路和PI3K/AKT通路,探讨二者与结肠癌细胞EMT发生的关系,以期进一步揭示结肠癌EMT发生的分子机制。
