无创产前检测筛查拷贝数变异的临床应用价值探讨
2020-05-18谢润桂魏顺娣何晓旋江建荣何怡
谢润桂 魏顺娣 何晓旋 江建荣 何怡

【摘要】 目的 探討无创产前检测(NIPT)筛查拷贝数变异(CNVs)的临床应用价值。
方法 选择2017年5月至2019年10月,因NIPT发现染色体结构变异而选择产前诊断的孕妇共52例,利用G显带核型分析及微阵列式基因芯片杂交法(CMA)对羊水细胞进行检测,并比较三种方法的检测结果,计算阳性预测值。
结果 52例羊水CMA检测结果证实CNVs 25例,其中与NIPT结果符合致病性CNVs 15例;与NIPT结果符合临床意义不明确CNVs 7例;与NIPT结果符合良性CNVs 3例。NIPT检测CNVs阳性预测值为48.1%(25/52)。13例NIPT提示CNVs片段<5 Mb的样本中有10例与CMA结果相符,其中3例异常位于引起微缺失/微重复综合征(MDs)的区域,另外39例CNVs片段≥5 Mb的样本中有15例与CMA结果相符。MDs区域的CNVs占致病性CNVs的5/15(33.3%),其中有3例片段<5 Mb(60.0%),位于MDs区域的CNVs片段的阳性预测值为5/8(62.5%)。夫妻双方备用血验证结果显示:致病性CNVs亲本来源占4/15,临床意义不明确CNVs为亲本来源占4/7。随访发现 CMA 结果正常、良性的 CNVs和临床意义不明确 CNVs 孕妇均选择继续妊娠,产后随访均未发现新生儿表型异常; 致病性CNVs 孕妇大多选择终止妊娠,1例位于MDs 区域的CNVs胎儿出生后出现表型异常。
结论 NIPT用于筛查CNVs具有较高阳性预测值,能够检测出各种类型的CNVs,特别是染色体MDs区域的CNVs,具有良好的临床应用前景。同时,该技术仍存在一定的假阳性,应进一步结合其他产前诊断方法做出准确诊断。
【关键词】 无创产前检测;拷贝数变异;微阵列式基因芯片杂交法;微缺失/微重复综合征
中图分类号:R714.5 文献标志码:A DOI:10.3969/j.issn.1003-1383.2020.04.006
Discussion on the clinical value of noninvasive prenatal screening for copy number variation
XIE Rungui,WEI Shundi,HE Xiaoxuan,JIANG Jianrong,HE Yi
(Center of Prenatal Diagnosis,Dongguan Maternal and Child Health Hospital,Dongguan 523107,Guangdong,China)
【Abstract】 Objective To explore the clinical value of noninvasive prenatal testing(NIPT) in screening for copy number variations(CNVs).
Methods From May 2017 to October 2019,52 pregnant women were selected for prenatal diagnosis because of chromosomal structural variations found in NIPT.Amniotic fluid cells were detected by g-banding karyotype analysis and CMA,and the test results of the three methods were compared to calculate the positive predictive value.
Results Results of 52 cases of amniotic fluid CMA confirmed CNVs in 25 cases,including 15 cases of pathogenic CNVs,which was consistent with NIPT result.Variants of unknown significance was 7 cases,which was consistent with NIPT result.3 cases of benign CNVs was consistent with NIPT results.The positive predictive value of CNVs detected by NIPT was 48.1%(25/52).13 cases of NIPT suggested that 10 of the samples <5 Mb of the CNVs fragment were consistent with the CMA results,3 of which were abnormal in the region causing microdeletion /microrepetition syndromes(MDs).In addition,15 of the samples≥5 Mb of the CNVs fragment in 39 cases were consistent with the CMA results.CNVs in the MDs region accounted for 5/15(33.3%) of the pathogenic CNVs,including 3 fragments<5 Mb(60.0%),and the positive predictive value of CNVs fragments located in the MDs region was 5/8(62.5%).The verification results of blood reserve of husband and wife showed that the source of pathogenic CNVs accounted for 4/15 of the parents,variants of unknown significance accounted for 4/7 of the parents.Follow-up revealed that pregnant women with normal CMA results,benign CNVs and unclear clinical significance CNVs all chose to continue their pregnancy,and no phenotypic abnormality was found in postpartum follow-up.Most of the pregnant women with pathogenic CNVs chose to terminate their pregnancy.One pathogenic CNVs fetus located in the MDs region showed phenotypic abnormalities after birth.
Conclusion NIPT has a high positive predictive value for screening CNVs,and can detect many types of CNVs,especially CNVs in the chromosomal MDs region,which has a good clinical application prospect.At the same time,there are still some false positives in this technique,which should be further combined with other prenatal diagnosis methods to make an accurate diagnosis.
【Key words】 noninvasive prenatal testing;copy number variations;microarray gene chip hybridization;microdeletion/microduplication syndrome
基于游離DNA的无创产前检测(noninvasive prenatal testing,NIPT)是利用大规模平行测序技术(massively parallel sequencing,MPS)对包含母体及胎盘来源的所有游离DNA片段进行深度测序,并利用生物信息分析技术确定游离DNA片段的来源,再与正常的参比样本比较,然后获得每条染色体各个位置相对的剂量信息,从而判断染色体是否异常。目前,NIPT已广泛用于13三体、18三体和21三体的产前筛查,并扩展应用到性染色体非整倍体和部分拷贝数变异(Copy numbervariations,CNVs)的筛查[1~2]。不同于整条性染色体数目增加或者减少的性染色体非整倍体,CNVs一般指染色体长度为大于1 kb的DNA片段的缺失、插入、重复,属于染色体上超微结构的失衡。NIPT检测性染色体非整体和CNVs的阳性率及阳性预测值均较高,一些研究已证实NIPT确实能够发现CNVs[3]。传统的细胞遗传学分析难以发现CNVs,常见检测CNVs的方法有Fish、QF-PCR和微阵列式基因芯片杂交法(CMA),其中致病性CNVs 可导致具有复杂临床表现的胎儿微缺失/微重复综合征(MDs)[4]。绝大多数MDs在宫内发育期间基本无异常表现(宫内发育迟缓、羊水过多/过少、特征性的脏器畸形是部分微缺失综合征的唯一表现);缺乏有力的产前筛查指标或方法是目前最困难的挑战[5]。目前CNVs检测多用于新生儿发育迟缓、智力低下患者,在产前诊断的应用尚缺乏有力证据。本研究对NIPT产前筛查CNVs的临床应用价值进行探讨,现报告如下。
1 对象与方法
1.1 对象
选择2017年5月至2019年10月,因NIPT发现CNVs阳性而选择在我院产前诊断的孕妇共52例,年龄21~42 岁,中位年龄31.5岁,NIPT平均孕周18.2周。NIPT排除有以下既往史病例:1年内异体输血史、1年内移植手术史(胚胎移植手术除外)、4周内免疫治疗史和干细胞治疗史。对入选孕妇进行遗传咨询,建议羊膜腔(18~22周)穿刺术取样进行产前诊断,穿刺平均孕周20.6周,行G显带核型分析及CMA检测。本研究经东莞市妇幼保健院伦理委员会批准,所有参加孕妇签署知情同意书。
1.2 方法
1.2.1 NIPT检测方法
样本采集孕妇静脉血7~10 mL,使用CellFree DNA BCT 管,采血后颠倒混匀8~10次,24小时内进行血浆分离。首先将血样在4℃下以1600×g离心10分钟,以使血浆与外周血细胞分离。将血浆部分小心地转移到聚丙烯管中,并在4℃下以16 000×g离心10分钟,以沉淀剩余的细胞。基因组DNA提取、测序文库构建和质量控制用试剂盒(S10020,Capital genomics)提取基因组DNA,测定基因组DNA浓度,然后在-20℃保存。根据晶芯胎儿染色体非整倍体T21、T18、T13检测试剂盒(CFDA注册许可证第0153400300号)的说明书进行文库构建、质量控制和汇集。使用晶芯Bioelectron Seq 4000系统(CFDA注册许可号20153400309)半导体测序仪进行DNA测序,测序读数被过滤并与人类参考基因组(HG19)比对。
1.2.2 染色体核型分析方法
羊水经细胞培养后,用秋水仙素处理,根据低渗、固定、滴片、烤片、消化和G显带步骤,完成制片,采用LEICA GSL-120全自动染色体扫描仪获得染色体中期分裂象,核型分析和命名按照人类细胞遗传学命名国际体制进行。
1.2.3 CMA检测方法
抽取孕妇羊水,并采集夫妻双方外周血备用。若发现临床不明确的CNVs或者致病性CNVs则对父母备用血进行CMA检测,以判断CNVs来源和性质。运用美国Affymetrix公司的CytoScan HD探针检测,按照厂家的标准操作说明书进行操作,主要步骤包括: DNA提取、酶切、连接、PCR、PCR产物鉴定、PCR产物纯化、定量、片段化、片段化的QC质量控制、标记、杂交、洗涤、染色、扫描和数据分析。根据CNVs出现的位置、片段大小、缺失或重复,是否含有OMIM基因、是否已有文献明确致病临床意义,是否大于3 Mb,是否为亲本来源等情况进行判断,参照DECPHER、OMIM、UCSCR等数据库进行结果判读。根据美国ACMG指南[5]分为:良性CNVs (benign CNVs)、临床意义不明确的CNVs (variants of unknown significance VOUS)、 致病性CNVs (pathogenic CNVs)。
1.2.4 随访
52例孕妇在分娩前后1个月由专职护士进行两次电话随访,分别随访孕期胎儿发育情况、妊娠结局和新生儿表型情况。
2 结 果
2.1 NIPT 结果
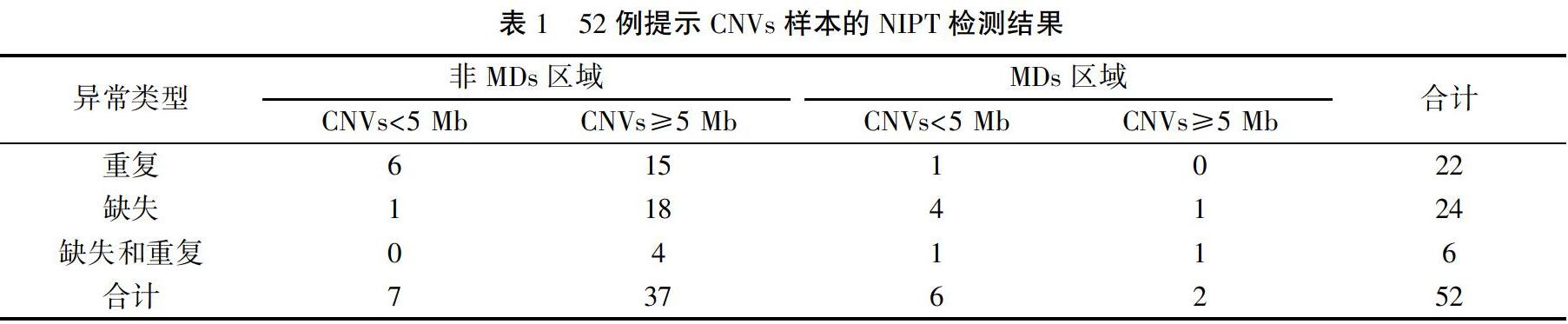
52例CNVs样本的片段大小:13例CNVs<5 Mb,39例CNVs≥5 Mb,CNVs样本提示异常类型:重复22例,缺失24例,同时存在缺失和重复6例。8例在位于MDs区域的CNVs中有6例片段小于5 Mb,见表1。
2.2 染色体核型分析和CMA 检测结果
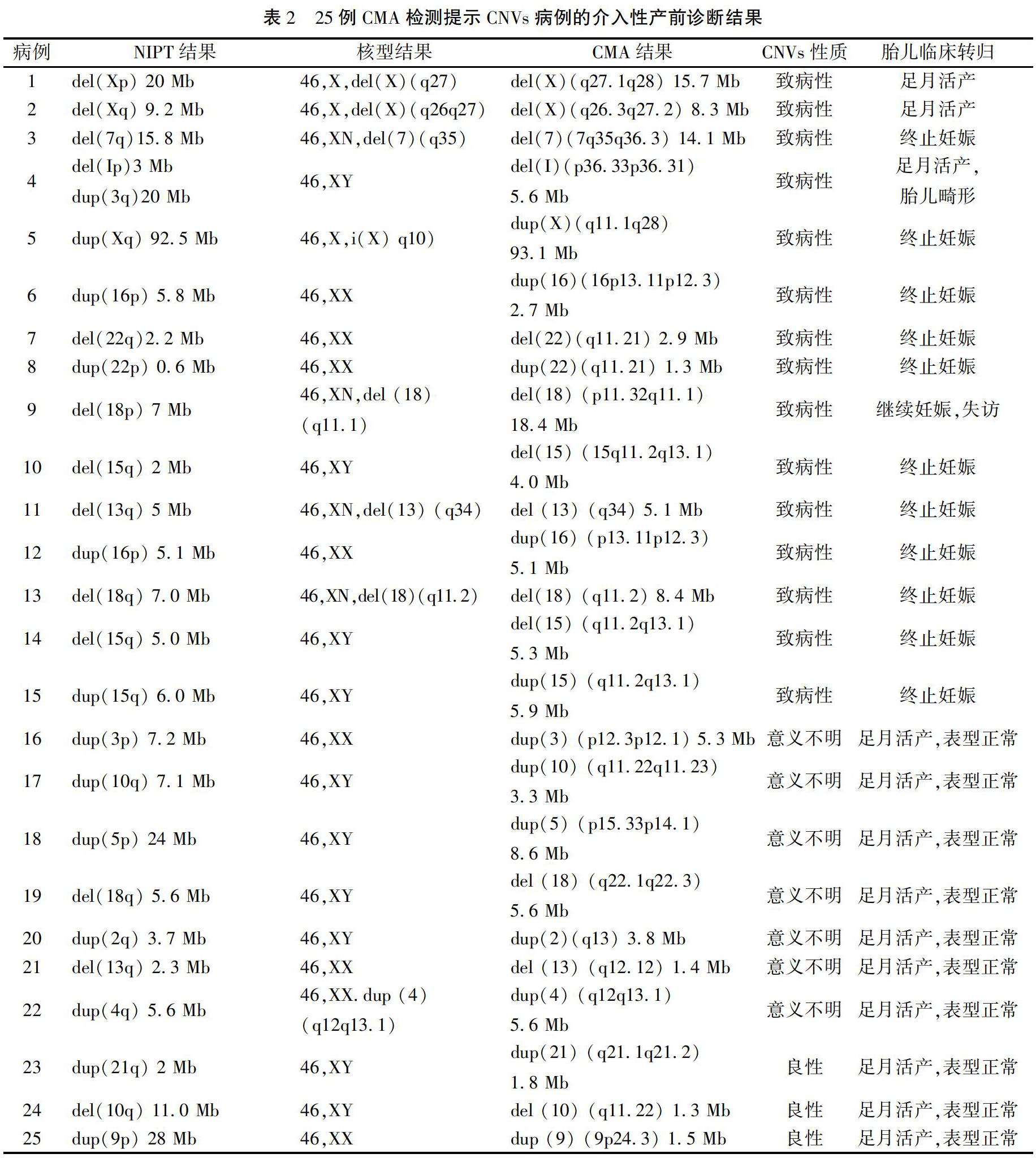
52例病例的介入性产前诊断结果:羊水核型正常44例,异常8例,异常核型结果均与NIPT提示的CNVs相符,且片段均大于5 Mb,并位于非MDs区域。羊水CMA检测结果证实CNVs 25例,其中与NIPT结果符合致病性CNVs 15例;与NIPT结果符合临床意义不明确CNVs 7例;与NIPT结果符合良性CNVs 3例。NIPT检测CNVs阳性预测值为48.1%(25/52),25例CMA检测提示CNVs病例的介入性产前诊断结果见表2。13例NIPT提示CNVs片段<5 Mb的样本中有10例与CMA结果相符,其中3例异常位于引起MDs的区域,另外39例CNVs片段≥5 Mb的样本中有15例与CMA结果相符。MDs区域的CNVs占致病性CNVs的5/15(33.3%),其中有3例片段<5 Mb(60.0%),位于MDs区域的CNVs片段的阳性预测值为5/8(62.5%),52例NIPT检测提示CNVs样本的三种检测方法结果见表3。夫妻双方备用血验证结果显示:致病性CNVs亲本来源占4/15,临床意义不明确CNVs为亲本来源占4/7。
2.3 随访结果
CMA结果正常、良性的CNVs和临床意义不明确CNVs孕妇均选择继续妊娠,产后随访均未发现新生儿表型异常。15例致病性CNVs中有10例选择引产,5例继续妊娠。继续妊娠病例包括2例X染色体异常、1例亲本来源CNVs和2例MDs,产后随访反馈:2例MDs中1例表型异常,另1例失访,其余3例暂时表型正常。25例CMA检测结果提示CNVs病例的随访结果见表4。
3 讨 论
NIPT筛查胎儿的CNVs具有良好的临床应用前景。CNVs发生在染色体上罕见、新生、片段相对大、含有临床相关基因和已确定的综合征,称为致病性CNVs,如果遗传自健康双亲,或者普遍存在于正常人中未表现出病理学表型的,称为良性CNVs,其余的称为临床意义不明CNVs。致病性CNVs出现在特定染色体上并含有重要基因的区域就可能引起MDs,可导致严重智力低下、发育迟缓、生长发育异常等,在胎儿中发生率为1.0%~1.7%[6]。常見的MDs有22q11微缺失综合征、22q11微重复综合征、Angelman综合征、猫叫综合征等至少67种,发病率在1/4000至1/5000之间。MDs传统的产前筛查模式为:孕中期B超检查发现胎儿发育异常或者器官畸形,介入性手术获得胎儿的组织,基因芯片或新一代测序技术检测胎儿DNA的CNVs。B超检测从形态上辨别胎儿发育异常和畸形,不能检测胎儿器官功能异常和胎儿智力异常,漏诊率高。NIPT检测对象为胎儿的游离DNA,直接判断游离DNA是否存在CNVs,是否引起MDs,相比B超筛查有明显优势。NIPT能从全基因组范围筛查出致病性CNVs和MDs,本研究发现,28.8%的致病性CNVs检出率远高于产前超声筛查发现胎儿存在多个器官异常时约9.5%的致病性CNVs检出率[7]。 随着测序技术的改进以及生物信息分析软件的完善、更多大样本研究,NIPT筛查CNVs将更加合理和准确[8]。产前诊断协会(ISPD)2015年声明中指出NIPT检测胎儿CNVs可用于临床意义明确或已知严重表型的疾病[9]。本研究52例NIPT阳性样本中检测到15例致病性CNVs,有5例可引起MDs,其中3例片段小于5 Mb的占60.0%,阳性预测值为62.5%,高于非MDs区域。因此,NIPT报告审核时,必须注意MDs区域出现的CNVs。NIPT能够在产前筛查出各种类型的CNVs,包括染色体MDs区域的CNVs。
CNVs验证应选用CMA作为验证方法。染色体核型分析方法使用显微镜观察染色体的带纹变化,一般只能辨别5~10 Mb的染色体结构异常,而染色体核型分析并不适用于验证CNVs。本研究染色体核型分析CNVs的检出率仅为32.0%,检测到的异常片段均大于5 Mb,与以上推断一致。目前全基因组范围检测 CNVs 研究的方法有: CMA、SNP分型芯片技术和新一代测序技术。CMA通过一次杂交可对全基因组范围内检测的染色体拷贝数量的变化进行检查,分辨率在10 kb左右,能够检测所有染色体结构失衡,包括非整倍体和所有已知引起智力障碍/多发性先天畸形的复发性染色体失衡。目前一些产前诊断中心已将此方法用于产前诊断CNVs[10]。CMA可用于CNVs的验证,但必须注意,NIPT检测结果与CMA并不完全一致。NIPT检测CNVs是基于测序匹配Reads获得染色体上不同位置DNA片段的剂量信息。在目前测序深度条件下,测序得到Reads经过了过滤、筛选和换算, NIPT检测DNA片段的剂量和位置变化并不精确。而CMA检测却能够精确地检测DNA剂量和位置变化。本研究中NIPT和CMA发现CNVs异常类型(缺失或重复)均一致,但CNVs区域的大小和位置不完全一致。如果NIPT和羊水CMA均提示染色体相近位置出现相同类型的CNVs,说明NIPT提示信号为真信号,均应判断为真阳性。
CNVs来源验证及胎儿转归随访是评价NIPT筛查CNVs临床效果的重要方法。CNVs的来源是预测胎儿预后的一个重要因素,CMA检测夫妻备用血可确定CNVs来源。如果CNVs来源于亲本,且亲本临床表型正常,则患病风险低,如系新发突变,则应结合文献报道、涉及基因、片段大小、超声检查结果、生育史等综合判断。本研究中25例真阳性样本中共有8例来源于亲本,验证结果可帮助临床医生遗传咨询和判断胎儿的预后。15例致病性CNVs中5例继续妊娠,其中2例为涉及X染色体异常的女胎。由于女性有2条X染色体且存在互补效应,其中1条X染色体异常对胎儿的表型影响较小;1例系母亲来源,母亲表型正常。3例婴儿出生后均未出现表型异常。另外2例CNVs会引起MDs,1例产后出现了MDs,另1例失访。
NIPT检测CNVs存在假阳性病例现象。NIPT检测时,由于孕妇外周血的胎儿游离DNA含量仅占血浆总游离DNA的19%左右,并且与母体游离DNA混杂在一起,大量的母体血浆游离DNA背景会给胎儿游离DNA的检测和分析造成干扰,如果母亲染色体异常、DNA拷贝数异常、母血中胎儿DNA含量低以及母亲罹患肿瘤等情况,都会引起NIPT假阳性。另外,NIPT检测胎儿游离DNA来源胎盘滋养层,胎盘与胎儿虽然由同一个合子发育和分化形成,但如果在孕期出现限制性胎盘嵌合、双胎一胎凋亡等情况可导致胎儿和胎盘DNA不一致,也会引起NIPT假阳性[11~12]。本研究发现NIPT用于筛查CNVs的阳性预测值为48.1%(25/52),假阳性率为51.9%(27/52),与卢建等人报道的NIPT筛查T18和T13的假阳性率达51.1%和51.9%相近[13]。这说明NIPT用于筛查CNVs具有与T18和T13筛查相似的临床价值, NIPT可用于产前筛查CNVs,但必须通过介入性产前诊断确诊。另外,本研究无法收集到计算真阴性和假阴性所需的同期NIPT检测其他孕妇的筛查结果、产前诊断结果和随访数据,无法计算阴性预测值、敏感度、特异性和约登指数等筛检指标。因此,本研究对NIPT筛查CNVs的效果评价不够全面,仍有待进一步研究。
综上所述,NIPT用于筛查CNVs具有较高阳性预测值,能够检测出各种类型的CNVs,特别是染色体MDs区域的CNVs,具有良好的临床应用前景。同时,该技术仍存在一定的假阳性,应进一步结合其他产前诊断方法做出准确诊断。
参 考 文 献
[1] 戚庆炜.无创产前检测临床应用相关指南解读[J].发育医学电子杂志,2019,7(3):161-167.
[2] 劉俊涛.无创产前检测国际指南与中国规范[J].中国实用妇科与产科杂志,2017,33(6):564-567.
[3] ROSE N C,BENN P,MILUNSKY A.Current controversies in prenatal diagnosis 1:should NIPT routinely include microdeletions/microduplications? [J].Prenat Diagn,2016,36(1):10-14.
[4] WAPNER R J,MARTIN C L,LEVY B,et al.Chromosomal microarray versus karyotyping for prenatal diagnosis[J].N Engl J Med,2012,367(23):2175-2184.
[5] 刘静.373例不明原因智力障碍/生长发育迟缓,多发畸形患者的全基因组拷贝数变异分析[D].长沙:中南大学,2013.
[6] KEARNEY H M,SOUTH S T,WOLFF D J,et al.American College of Medical Genetics recommendations for the design and performance expectations for clinical genomic copy number microarrays intended for use in the postnatal setting for detection of constitutional abnormalities[J].Genet Med,2011,13(7):676-679.
[7] SHAFFER L G,ROSENFELD J A,DABELL M P,et al.Detection rates of clinically significant genomic alterations by microarray analysis for specific anomalies detected by ultrasound[J].Prenat Diagn,2012,32(10):986-995.
[8] 王增阁,郭奇伟,周裕林.染色体微缺失微重复综合征遗传检测的现状及展望[J].中华检验医学杂志,2016,39(6):407-409.
[9] BENN P,BORRELL A,CHIU R W,et al.Position statement from the chromosome abnormality screening committee on behalf of the board of the international society for prenatal diagnosis[J].Prenat Diagn,2015,35(8):725-734.
[10] VAN DEN VEYVER I B,PATEL A,SHAW C A,et al.Clinical use of array comparative genomic hybridization (aCGH) for prenatal diagnosis in 300 cases[J].Prenat Diagn,2009,29(1):29-39.
[11] WANG E,BATEY A,STRUBLE C,et al.Gestational age and maternal weight effects on fetal cellfree DNA in maternal plasma[J].Prenat Diagn,2013,33(7):662-666.
[12] VRACHNIS N,VLACHADIS N,CREATSAS G.DNA sequencing versus standard prenatal aneuploidy screening[J].N Engl J Med,2014,371(6):578.
[13] 卢建,侯亚萍,黄伟伟,等.471例NIPT阳性孕妇产前诊断结果分析[J].中国产前诊断杂志(电子版),2017,9(4):14-17.
(收稿日期:2020-01-12 修回日期:2020-03-24)
(编辑:梁明佩)
