不同方法提取新疆红肉苹果RNA差异研究
2020-05-18汤蕾童盼盼张亚若王芳唐章虎李文辉袁祖胜王江波
汤蕾 童盼盼 张亚若 王芳 唐章虎 李文辉 袁祖胜 王江波
摘要:使用生工柱式植物總RNA抽提纯化试剂盒、Trnzol法以及改良CTAB 3种方法,提取红肉苹果克孜阿尔玛的果肉、果皮、花瓣、叶片中的总RNA,并对比这3种方法提取RNA的产量、质量以及完整性。结果表明,由Trnzol方法提取所获得的RNA纯度较低,有降解现象,且有DNA、蛋白质的污染,果肉和果皮RNA的产量也并不理想;而用改良CTAB法和生工试剂盒法提取的RNA较少降解,所得28 S rRNA和18 S rRNA条带较为清晰,花瓣和叶片的OD260/280均在2以上,生工试剂盒法提取的RNA产量高,OD260/280和OD260/230比值均在1.8~2.5,条带的完整性好。3种方法比较而言,改良CTAB法和TrNzol法提取的RNA条带的清晰度、产量及质量都低于生工试剂盒法。
关键词:新疆红肉苹果;RNA提取;柱式植物总RNA抽提纯化试剂盒;Trnzol法;改良CTAB法
中图分类号:Q819 文献标识码:A
文章编号:0439-8114(2020)03-0144-03
DOI:10.14088/j.cnki.issn0439-8114.2020.03.032
Study on RNA difference of Xinjiang red meat apple extracted by different methods
TANG Lei1,TONG Pan-pan1,2,ZHANG Ya-ruo1,2,WANG Fang1,TANG Zhang-hu3,
LI Wen-hui4,YUAN Zu-sheng5,WANG Jiang-bo1,2
(1.School of Plant Science,Tarim University, Alar 843300,Xinjiang,China;2.National Local Joint Engineering Laboratory of High efficiency and High quality cultivation and Deep processing Technology of characteristic Fruit trees in Southern Xinjiang,Alar 843300,Xinjiang,China;
3.Xinjiang Academy of Agricultural Sciences Luntai National Fruit Tree Resource Garden,Luntai 841600,Xinjiang,China;4.Xinjiang production and Construction Corps fourth Division Forestry Management Station,Kedala 835099,Xinjiang,China;5.Agricultural Development Service Center of the 11th regiment of the first Division of the Xinjiang production and Construction regiment,Alar 843300,Xinjiang,China)
Absrtact: The total RNA extraction and purification kit, Trnzol method and improved CTAB method were used to extract the total RNA, from the pulp, pericarp, petals and leaves of red meat apple Kizi Alma, and the results of yield, quality and integrity of the three methods were compared. The final results showed that the purity of RNA extracted by Trnzol method was low, the degradation phenomenon, and the pollution of DNA, protein, the yield of pulp and pericarp was not ideal, but the RNA extracted by improved CTAB method and kit method was rarely degraded. The 28 s rRNA and 18 s rRNA bands were clear, the OD260/280 of petals and leaves was between 1.8 and 2.5, the yield of RNA extracted by raw reagent kit method was high, the ratio of OD260/280 and OD260/230 was between 2.0 and 2.5, and the integrity of the bands was good. Compared with the three methods, the clarity, yield and quality of RNA bands extracted by modified CTAB method and TrNzol method were lower than those by raw reagent kit method.
Key words: Xinjiang red meat apple; RNA extraction; column plant RNA extraction and purification kit; Trnzol method; improved CTAB method
分子生物学研究对提取RNA要求较高[1],获得纯度高、完整性好的RNA是构建高质量cDNA文库、进行基因表达和功能鉴定等研究的前提[2]。多糖多酚等物质的理化性质与RNA类似,因此在RNA形成沉淀时,多糖物质较易生成凝胶状沉淀,致使形成的RNA难溶于水[3];而红肉苹果由于花、叶、果肉呈粉红色至深红色,花青苷、酚类含量高,RNA提取难度更大。因此,要获得完整的、高纯度的RNA是一项较困难的工作[4]。
目前,关于植物总RNA提取方法的报道有很多,但是由于植物组织及器官本身的特异性,不同研究材料,甚至是同一植物同一材料的不同发育时期RNA的提取方法也不同,均需根据试验分析选取适宜的总RNA提取方法[5]。新疆是红肉苹果的起源地,新疆红肉苹果资源丰富。目前对红肉苹果的活性成分研究相对较多的是花青苷,王延玲[6]对新疆红肉苹果夏红肉的果皮和果肉中花青苷的成分进行了鉴定,同时还研究了在发育过程中花青苷含量的变化。而红肉苹果中花青苷代谢机理等许多科学问题需要从分子生物学水平解析,均需要提取各组织高质量的RNA。但是适宜红肉苹果的不同组织RNA提取方法的研究报道较少,因此本试验采用不同方法对克孜阿尔玛红肉苹果不同组织的RNA进行提取,研究出不同方法提取新疆红肉苹果RNA的差异,为分子生物学研究提供了理论依据。
1 材料与方法
1.1 材料
以轮台特色果树种质资源圃克孜阿尔玛红肉苹果为材料,采其刚展开的幼嫩叶片、盛花期花瓣、成熟果实,将果实分成果肉和果皮,各分成数份装袋放置于-70 ℃超低温冰箱保存。
1.2 试剂与仪器
生工SK8661柱式植物总RNA抽提纯化试剂盒;TRNzol总RNA提取试剂(天根生化科技(北京)有限公司);植物通用抽提试剂(百泰克生物技术有限公司);移液枪(伯乐生命医学产品有限公司);Nano Drop 2000微量分光光度计、小型离心机(ThermoFisher,USA);电泳仪(北京市六一仪器厂);荧光和化学发光成像分析系统(伯乐生命医学产品有限公司);台式低速大容量冷冻离心机(长沙东旺实验仪器有限公司)。
1.3 方法
1.3.1 柱式植物总RNA抽提纯化试剂盒 按照生工SK8661柱式植物总RNA抽提纯化试剂盒法稍作改动。取450 μL裂解液加入1.5 mL离心管中备用。取所需样品放入研钵中,加液氮快速研磨,取50 mg倒入离心管中,立刻振荡混匀,室温放置5 min。4 ℃ 12 000 r/min离心3 min,用移液枪将上清液转入新的离心管中。加入1/2体积的75%乙醇,摇匀。将吸附柱放进收集管中,所有溶液转入吸附柱,室温放置2 min,室温下10 000 r/min离心1 min,弃废液。再加入1/2体积的75%乙醇,摇匀充分,室温放置2 min,室温下10 000 r/min离心1 min。将吸附柱放回收集管中,加入500 μL GT溶液,室温下10 000 r/min离心1 min,弃废液。加入500 μL NT 溶液,室温放置2 min,室温下10 000 r/min离心1 min,弃废液。室温下12 000 r/min离心2 min。在吸附膜上滴入30 μL DEPC-treated ddH2O,静置2 min,12 000 r/min离心2 min后置于-70 ℃留存备用。
1.3.2 TRNzol法 依照TRNzol法作适当的修改。取100 mg样品放入研钵中,加液氮充分研磨,加 1 mL TRNzol溶液。金属浴65 ℃放置5 min,彻底分散核酸蛋白复合物。4 ℃ 12 000 r/min离心10 min,取上清。加入200 μL氯仿,快速振荡15 s,室温静置3 min。4 ℃ 12 000 r/min离心15 min,将上层液移入新的离心管,加入等体积异丙醇,迅速涡旋混匀,室温放置25 min,4 ℃ 12 000 r/min离心10 min,弃清液。加入1 mL 75%乙醇。4 ℃ 6 000 r/min离心 3 min,去上清(洗涤2次,离心2次)。将管盖打开2~3 min,使管内充分晾干,加入30 μL ddH2O。
1.3.3 改良CTAB法 在离心管中加入1 mL抽提试剂,备用,取0.1 g样品放入液氮快速研磨,并移入离心管中,涡旋混匀,65 ℃金属浴下放置5 min。4 ℃ 12 000 r/min离心10 min,取上清,加入等体积的水饱和酚∶氯仿∶异戊醇(25∶24∶1),涡旋振荡混匀,4 ℃ 12 000 r/min离心5 min。弃上清,加入1 mL 75%乙醇,充分混匀,4 ℃ 12 000 r/min离心5 min,弃上清。简单干燥RNA沉淀3 min,加入30 μL ddH2O溶解RNA沉淀。
1.4 RNA浓度检测
用Nano Drop 2000微量分光光度计检测RNA紫外光吸收值,测定260 nm和280 nm波长下的光密度值(OD),并记录RNA的产量以及光密度值[1]。
2 结果与分析
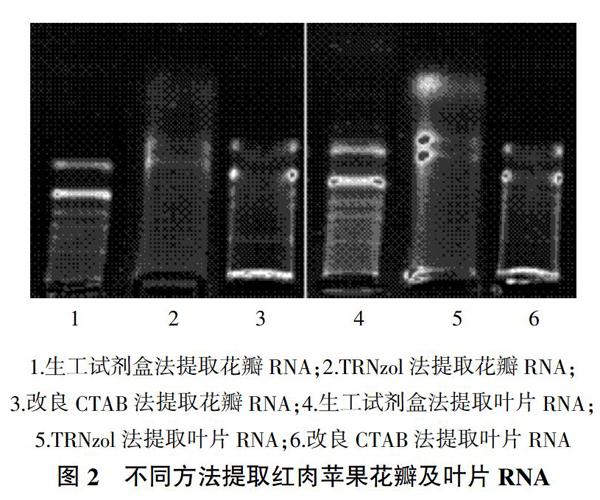
2.1 不同提取方法对红肉苹果不同组织RNA纯度和产量的影响
克孜阿尔玛红肉苹果的各个组织中,生工试剂盒法和改良CTAB法提取的花瓣和叶片RNA的OD260/280和OD260/230比值均在1.8~2.5,纯度较高,无大量污染,且生工试剂盒法RNA产量高于改良CTAB法,生工试剂盒法测得的果肉果皮的OD260/280比值在2.0~2.5,OD260/230比值低于1.0,表明存在蛋白质及盐类物质污染;TRNzol法提取RNA的OD260/280及OD260/230比值均低于標准值(表1),表明存在大量蛋白质或盐类物质以及酚类物质污染,提取效果有待于进一步纯化。
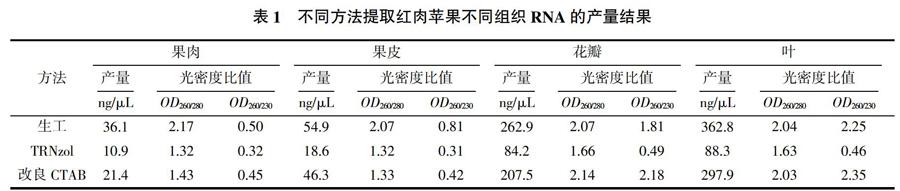
2.2 不同提取方法对红肉苹果果肉、果皮总RNA完整性的检测
取8 μL RNA在1.2%琼脂糖凝胶上电泳,由图可1见,用生工试剂盒法提取的苹果果肉、果皮总RNA中,18 S rRNA和28 S rRNA这两条带的带型与其他两种方法提取的RNA条带相比,清晰可见,且降解量很少,28 S rRNA的亮度约为18 S rRNA的2倍,完整性高;用改良CTAB法提取出的总RNA虽然有条带出现,但条带不够清晰,28 S rRNA和18 S rRNA条带模糊,有少量降解。TRNzol法提取出的苹果果肉、果皮RNA在凝胶上无法成像,说明该法无法很好地提取含有大量多糖多酚物质的植物组织RNA。
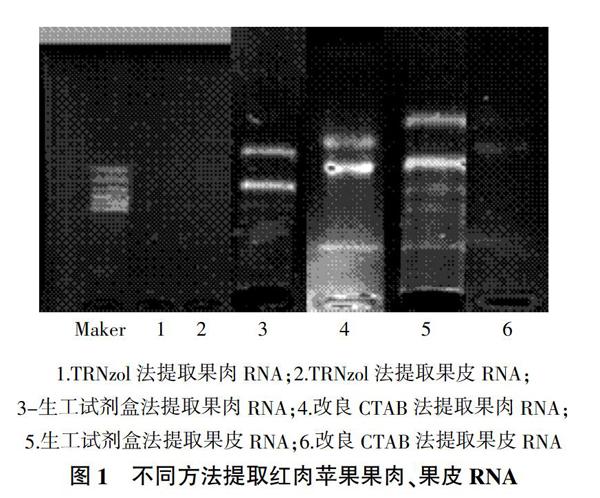
2.3 不同提取方法对红肉苹果花瓣、叶片总RNA完整性检测
取8 μL提取的花瓣和叶片RNA在1.2%琼脂糖凝胶上电泳,通过图2可知,生工试剂盒法提取花瓣及叶片RNA的条带较其他两种方法清晰许多,有少许降解,可见28 S rRNA和18 S rRNA两条带型,28 S rRNA的亮度约为18 S rRNA条带的2倍。TRNzol法提取的RNA虽然可以看到28 S rRNA、18 S rRNA和5 S rRNA这3条带型,但提取的RNA完整性并非最佳,花瓣RNA条带中28 S rRNA和18 S rRNA不是2倍关系,条带较淡,有拖带现象,完整性较低;叶片RNA条带点样孔较亮,表明有DNA残留。改良CTAB法提取的RNA条带可以看出两条带型,虽无拖带现象,但条带亮度不高,完整性低。
3 结论
不同RNA提取方法对不同物种、不同器官及不同组织的提取效率不尽相同。目前,科研人员已经总结出许多科学高效的RNA提取方法[7],但是在实际操作中,即使相同种属的不同个体,采用同一套固定的提取方法也无法保证取得同样的效果[8,9]。TRNzol法是一种提取植物RNA的常用方法,在许多植物中均可分离到高质量的RNA,但是在本试验中发现,TRNzol法并不能有效的去除苹果果肉及果皮中的蛋白质、多糖、多酚等物质,最终提取出来的RNA严重降解。
改良CTAB法成本低廉,步骤简单,提取出的RNA产量也较高,此方法虽然能有效的提取出苹果各组织中的RNA,但是其中混有少量的杂质,质量不高。
生工柱式植物总RNA提取纯化试剂盒虽然价格昂贵,但是操作简便,提取快速简洁,RNA的纯度高,完整性好,RNA的产量高,适用于小量样品的提取,且可以有效进行RT-PCR分析等后续试验。
分离完整的总RNA是对苹果进行分子生物学研究的基础和前提,本次试验可应用于分子生物学角度的分析,同时,也为新疆的红肉苹果的后续试验奠定了基础。
参考文献:
[1] 李志强,李 莹,陶建敏,等.几种果实不同组织总RNA提取及质量分析[J].果树学报,2008(5):764-768.
[2] 陈 晖,何海福.植物组织总RNA提取方法的进展研究[J].甘肃农业,2006(8):226.
[3] 宋成秀,张利义,张彩霞,等.适合转录组测序的苹果果实RNA提取方法的筛选[J].中国果树,2015(2):47-49,61.
[4] 张建秋,陆 海,杜希华,等.白刺总RNA提取方法的研究[J].成都大学学报(自然科学版),2004,23(1):9-14.
[5] 冯延芝,袁德义,张 琳,等.枣花蕾总RNA提取方法的比较[J].经济林研究,2012,30(2):88-90.
[6] 王延玲.新疆红肉苹果红色发育机理的初步研究[D].山东泰安:山东农业大学,2011.
[7] 巩艳明,曹后男,宗成文,等.三种方法提取不同品种梨叶片总 RNA[J].湖北农业科学,2011,50(15):3204-3206.
[8] 庞宏光,许建锋,张江红,等.杜梨不同组织总RNA提取方法比较及质量分析[J].果树学报,2018,35(S1):66-70.
[9] 王 艳,高疆生,金 强,等.不同RNA提取方法在南疆特色果树上的应用[J].新疆农业科学,2015,52(3):461-466.
收稿日期:2019-10-13
基金项目:华中农业大学-塔里木大学科研联合基金项目(TDHNLH201601);兵团南疆重点产业支撑计划项目(2017DB006-2)
作者简介:汤 蕾(1997-),女,新疆乌鲁木齐人,在读本科生,专业方向为分子生物技术,(电话)18099096131(电子信箱)734573781@qq.com; 通信作者,王江波(1978-),女,副教授,碩士,主要从事果树育种与生物技术研究,(电子信箱)wjbok@126.com。
