系统性红斑狼疮致病基因研究进展*
2020-05-18翟建昭孟妍明综述李益洲武永康审校
朱 盈,翟建昭,罗 娟,孟妍明 综述,李益洲,武永康& 审校
(1.四川大学华西医院实验医学科,四川成都 610041;2.四川大学化学学院,四川成都 610061;3.四川大学网络空间安全学院,四川成都 610061)
系统性红斑狼疮(SLE)是一种多基因相关的自身免疫性疾病,表现出明显的家族聚集性,且同卵双生子的发病率一致性(24%)高于异卵双生子(2%),基因研究对于SLE致病机制的研究十分重要[1]。SLE作为一种自身免疫性疾病,发病过程涉及固有免疫和适应性免疫,根据免疫反应过程可分为抗原识别、淋巴细胞间信号传递和免疫过程调节等(图1),任何过程的错误或紊乱都可能增加SLE易感性。本文对SLE各免疫反应阶段的主要致病基因进行综述,以期为SLE遗传与免疫信号通路的全面认识提供依据。
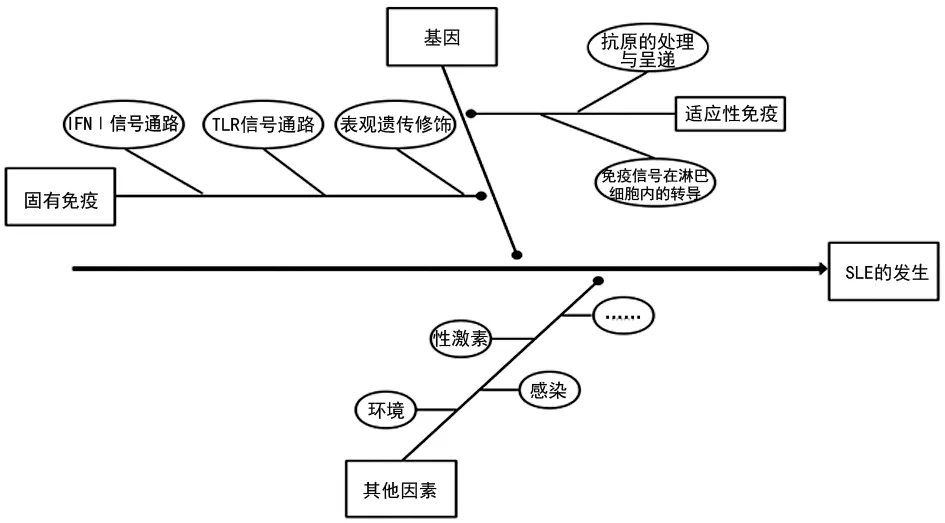
注:IFNⅠ表示Ⅰ型干扰素;TLR表示Toll样受体。
图1 SLE致病因素及发生过程
1 固有免疫应答
1.1IFNⅠ信号转导途径 IFNⅠ信号转导途径在抗肿瘤、抗病毒和免疫调节中都起着重要作用,是固有免疫应答的主要组成部分,在机体控制并清除病原体的过程中扮演着重要角色。免疫细胞通过模式识别受体接受抗原刺激后释放IFNⅠ,IFNⅠ通路过度活化是SLE发病的一大原因。
1.1.1Janus激酶-信号转导及转录激活因子(JAK-STAT)通路 STAT是干扰素依赖性基因表达的主要成分,JAK-STAT通路过程涉及多种细胞因子、激素和生长因子等的信号转导,介导细胞正常增殖、分化、活化、成熟等,而异常的信号转导则会导致SLE等多种自身免疫性疾病。STAT4作为STAT家族的重要分子,主要表达于淋巴细胞、巨噬细胞和树突状细胞等抗原呈递细胞(APC)的细胞质,能在膜结合受体的刺激下活化进入细胞核,调节相关基因的转录和表达并且传输信号,该基因的多态性与SLE的发病呈强关联,如rs7574865 T>G的突变可能与SLE有关[2]。
1.1.2TLR信号通路 TLR是一种跨膜蛋白,是固有免疫的重要组成部分,也是连接固有免疫与适应性免疫的桥梁。自身抗原与TLR结合后,可激活IRAK等基因,导致核因子κB(NF-κB)、干扰素调节因子(IRF)5和IRF7的活化,最终使细胞因子增加和自身抗体产生。
1.1.2.1白细胞介素(IL)-1相关受体激酶1(IRAK1) IRAK1是一种有效的NF-κB激活剂,位于X染色体上,与SLE存在强烈的相关性,可能是导致女性患病率较高的原因之一[3]。TLR与自身抗原结合后,将信号传递给下游的IRAK1。SLE患者CD4+T细胞内IRAK1转录水平显著增加,并且与疾病活动度呈正相关[4]。使用IRAK1抑制剂可以抑制Th17细胞的分化,有望成为新的治疗方案。除了转录水平增加以外,IRAK1(rs3027898)的多态性也会增加SLE的易感性。此外,IRAK1在激活NF-κB的过程中,受到非编码微小RNA146a(miRNA146a)的靶向调节,因此,miRNA146a(rs2910164)的多态性也会影响SLE的发病[5]。
1.1.2.2干扰素调节因子家族(IRFs) IRFs是转录因子的一种,参与病毒相关的干扰素活化、细胞分化凋亡及免疫系统活性的调节。IRF作为IFN通路重要调控因子,在自身免疫反应发生的过程中起重要作用。研究证实IRF5基因rs729302 A等位基因与SLE的发生密切相关[6-7]。另外发现IRF是免疫应答的重要分子,如IRF5与细胞因子的产生有关,并且能够诱导IFNⅠ的生成;IRF7可以影响IFNⅠ信号通路,与SLE发病密切相关[8]。
1.1.3表观遗传修饰
1.1.3.1miRNA miRNA,即小的非编码RNA,通过抑制mRNA的转录和翻译对靶基因进行表观修饰,这类分子对SLE发病起着重要的作用。各类miRNA作用复杂,如miRNA-146a和miRNA-155能干扰TLR-7和TLR-9下游的细胞内信号传导途径,并影响浆细胞样树突状细胞中IFNⅠ的生成。在T细胞和B细胞中,miRNA-126、miRNA-21、miRNA-146a、miRNA-155和miRNA-1246等可能通过表观遗传修饰影响基因表达[9]。有研究表明SLE患者体内miRNA-146低表达,导致其靶基因TRAF6和IRAK-1表达上升,引起IFN通路激活,刺激SLE患者疾病发展[10]。
1.1.3.2甲基化修饰 DNA低甲基化在SLE的发病过程中起着非常重要的作用,DNA的低甲基化会导致一些自身免疫疾病相关基因过度表达,如CD11b、CD40L等[11],从而导致自身免疫性疾病的发展。DNA甲基化与淋巴细胞的发育有关,SLE患者的幼稚T细胞呈现整体低甲基化[12],此外还会影响IL-2、IL-4和IFN-γ等细胞因子的表达,实际上多种表观遗传修饰往往是同时发生、共同作用的。
1.2NF-κB信号活化途径 NF-κB通路是体内多种信号通路的交叉点,多种受体的激活都可以导致其NF-κB的活化,如TLR、B细胞受体(BCR)等。NF-κB信号通路在体内起重要的信号转导作用,其调节异常会引起包括SLE在内的自身免疫性疾病,在这条通路涉及的基因中,有许多与SLE的发生有关。
1.2.1肿瘤坏死因子诱导蛋白3(TNFAIP3) TNFAIP3可被肿瘤坏死因子(TNF)诱导表达,在体内抑制NF-κB通路的活化及TNF介导的细胞凋亡。已有研究证实TNFAIP3 rs2230926多态性与SLE之间的关联,在中国人群中也已经报道过,该位点的改变使对NF-κB的抑制减弱,从而增加SLE的易感性[13]。
1.2.2TNFAIP3相互作用蛋白1(TNIP1) TNIP1编码的产物与TNFAIP3类似,二者协同抑制NF-κB信号传导途径,当两者上调表达时,NF-κB失调,极易导致SLE及狼疮性肾炎等自身免疫性疾病的发生,该基因rs10036748位点也是一个被多次证实的SLE强关联位点[14],其多态性也会使得抑制作用减弱。
1.2.3整合素亚基α(ITGAM) ITGAM基因编码CD11b,与单核-巨噬细胞系统相关,也涉及粒细胞的黏附趋化作用和摄取补体包被的颗粒和病原体的作用,可以调节固有免疫过程和包括NF-κB信号通路在内的一些信号传导途径。ITGAM的遗传变异与SLE、狼疮性肾炎和其他SLE相关并发症的易感性密切相关[15]。目前较常见的与SLE相关的由ITGAM基因编码的CD11b突变单核苷酸多态性(SNP)有rs11574637和rs1143679,其多态性均会增加SLE的易感性[16-17]。
2 适应性免疫应答
2.1自身抗原处理与提呈
2.1.1主要组织相容性复合体(MHC)Ⅱ类基因 MHC是最早被报道的与SLE易感性相关的基因,人类MHC基因编码产物通常被称为人白细胞抗原(HLA),其中MHCⅡ类分子可以识别外源性抗原,主要在抗原呈递细胞表面表达,在免疫应答的始动阶段将经过处理的抗原片段递呈给CD4+T细胞。HLA是目前发现的与自身免疫性疾病遗传性有最强关联的基因。已有多种研究表明,属于MHCⅡ类的HLA-DR2和HLA-DR3的单倍型与SLE易感性相关,是SLE的强烈风险因素[18-19]。HLA-DQA2的SNP(rs2301271)与SLE有显著相关性,并且在rs2187668处观察到抗dsDNA和HLA-DR3之间的强关联,进一步支持HLA区域在SLE致病因素中的重要性[20]。
2.1.2共刺激分子对
2.1.2.1OX-40L与OX40 肿瘤坏死因子超家族成员4(TNFSF4)基因又称为OX-40L,主要在活化的抗原呈递细胞和血管内皮细胞上表达,其受体TNFRSF4(也称为OX40)主要表达在CD4+T细胞表面,已有大样本研究显示,TNFSF4的多个位点多态性均与SLE的发病相关,在中国内地汉族人群证实rs1234315多态性与SLE的发病强相关[21]。
2.1.2.2分化簇(CD)80与CD28 CD80分子表达在抗原呈递细胞表面,可以与T细胞表面的CD28分子结合,活化膜受体从而刺激T细胞增殖分化,在SLE患者体内CD80+细胞显著增加。编码CD80的 rs2222631和rs6804441的基因多态性与SLE显著相关,且彼此独立[22]。此外,在一项SLE小鼠模型实验中,阻断CD80与CD28之间的共刺激作用可以有效阻止狼疮性肾炎的发生[23]。
2.2免疫信号在淋巴细胞间的转导 在自身免疫疾病发生的过程中,淋巴细胞间的免疫信号转导是一个重要环节。在这个过程中,抗原呈递细胞将处理好的抗原提呈给T细胞,T细胞活化后刺激B细胞活化,B细胞活化后分化为浆细胞产生针对抗原的自身抗体,同时T细胞产生细胞因子调节抗体的产生。其中涉及许多与SLE易感性相关的基因。
2.2.1B细胞受体信号通路转导
2.2.1.1具有锚蛋白重复序列1(BANK1)的B细胞支架蛋白 BANK1是编码B细胞支架蛋白的一种基因。该基因编码产物可以转导B细胞信号,当B细胞抗原受体与抗原结合后,刺激BANK1与SRC家族B淋巴细胞激酶(BLK)基因结合,向胞内传递信号,并激活下游的基因。其多态性可能会导致B细胞耐受破坏或者产生持续的信号传导。已有许多研究探讨BANK1多态性与SLE的易感性,均显示出二者之间极强的相关性,如rs10516487、rs71597109的多态性均与SLE存在较强的关联[24-25]。
2.2.1.2蛋白酪氨酸磷酸酶非受体22型(PTPN22) PTPN22基因编码的淋巴特异性酪氨酸激酶(LYP)的蛋白质,是T细胞活化的有力负向调节剂,它与C末端SRC酪氨酸激酶(CSK)相互作用,影响下游SRC家族酪氨酸激酶的活化状态[26]。它的基因多态性与SLE、类风湿性关节炎、系统性硬化症、自身免疫性甲状腺疾病等多种自身免疫疾病密切相关,其中rs2476601是PTPN22中与疾病相关的主要SNP,与SLE有相关性[27]。
2.2.1.3CSK CSK参与SRC家族激酶的调节,主要在免疫细胞表面表达,其基因编码的蛋白质与PTPN22结合后,在T、B淋巴细胞的活化中起重要作用。研究已确定CSK基因内含子的多态性与SLE的关联性,其中rs34933034多态性增加了狼疮的易感性,与SLE的发生有强关联[26]。
2.2.1.4BLK SRC家族激酶是一类非受体酪氨酸激酶,到目前为止有9个成员,即SRC、YES、FYN、FGR、LCK、HCK、BLK、LYN和FRK,其中BLK与SLE的发生密切相关。
BLK原癌基因是SRC家族的酪氨酸激酶,参与细胞增殖和分化。BLK蛋白在B细胞受体信号传导和B细胞发育中起作用。BLK基因存在多种基因多态性位点,其与SLE的易感性相关,其中包括rs13277113、rs2736340和rs2248932[28]。BLK多态性除了与SLE的发病相关以外,还有研究显示其与SLE的疾病活动度相关。与其他基因型相比,rs13277113 G/A型和rs2736340 C/T型在活跃期SLE患者中显著高于其他基因型[29]。
2.2.2T细胞受体信号通路转导 T细胞接受抗原呈递细胞提呈的抗原后,继续提呈给B细胞,同时自身进行分化,其中辅助性T细胞(Th)2、Th17与SLE的发生密切相关。
2.2.2.1IL-17 研究显示,IL-17与SLE的发生相关,Th17细胞产生细胞因子IL-17参与免疫调节,在许多自身免疫疾病中发挥重要作用[30]。目前有研究显示,SLE患者体内IL-17的水平显著高于健康对照,提示IL-17在SLE的发生过程中发挥作用[31]。除了水平升高之外,IL-17基因rs2275913的多态性也与SLE相关,并且影响疾病活动度[32]。
2.2.2.2IL-21 与IL-17类似,IL-21也是由Th17细胞分泌的细胞因子,参与免疫细胞增殖分化过程,在免疫应答中起重要作用,与多种自身免疫疾病相关。SLE患者体内IL-21水平及其mRNA表达量显著升高,说明SLE的发生与IL-21在体内的过表达相关[33]。除此之外,IL-21的基因多态性也与SLE发病相关。已经有病例对照研究显示,rs907715、rs2221903的多态性与SLE的发病相关[34]。SLE相关的常见基因及信号通路见表1。

表1 SLE相关的常见基因及信号通路
3 结 论
SLE目前是一种病因不清、发病机制复杂、临床表现异质性大的自身免疫性疾病,发病过程涉及多个过程和通路。目前已明确的SLE致病相关基因有很多种,本文对其中较为常见的15个基因和2种表观遗传修饰方式进行了综述(表1),涉及超过20种SNPs。除此之外,还有许多基因与SLE致病风险表现出一定的相关性,但尚不能明确,这些可能会对SLE致病有重要影响但未完全明确的基因值得进一步研究。随着SLE遗传学研究的深入,更多的SLE家系患者被发现,研究人员也更加重视SLE的家族聚集性,并且随着分子诊断技术、遗传学技术的进步,更多基因研究技术可供选择,如检测表达数量性状位点(eQTLs)、RNA结合位点、蛋白质结合位点等,这为发现更多SLE易感基因提供了技术支持。
在不同地区及种族之间SLE易感基因不完全相同,疾病表现和严重程度也不完全一致,在对SLE易感基因进行研究时可以将种族或地区进行分层,从而探讨不同人种的最强关联基因或主要致病基因,再对重点基因进行功能学研究,这样可以为SLE致病基因的研究和针对不同基因的靶向治疗提供极大的帮助。此后,也可以分析SLE的疾病情况与不同基因之间的关系,研究疾病的早期产生、进展过程、活动度、并发症及预后等不同过程中涉及的基因,进一步确定不同基因的主要影响方向,通过统计学方法和计算机技术建立数学模型,为以后临床使用人工智能模型对SLE进行多基因分析及预测提供可能。
在之后的研究中,对已发现的易感基因分类研究,如按信号转导通路、对疾病的影响方面等对各种基因进行归类,再结合统计学分析方法,探索不同类别的相关基因与各临床表现及亚型之间的关联性。未来对SLE患者进行基因检测,确定致病基因靶点,可以为SLE的精准治疗提供实验室依据,发展SLE治疗的个体化,提高治疗的有效性,减少治疗不良反应,改善患者预后。
