早期跑步运动对大鼠脑缺血/再灌注损伤后神经行为与神经元凋亡的影响*
2020-05-18彭志锋张继红杨德兵
彭志锋,张继红,杨德兵
(1.山西大同大学医学院生理教研室,2.解剖教研室,山西 大同 037009)
缺血性脑卒中是由血管阻塞引起的大脑供血不足,是导致身体残疾主要原因。许多临床实践指南建议在脑卒中后尽早开始运动,以促进身体残疾恢复[1]。
根据神经元损伤模式,大脑缺血区域可分为缺血核心区和半影区。由于缺血半影区神经元损伤较轻,有恢复的可能,因而成为各种干预治疗的靶点[2]。此外,在急性缺血性损伤后,缺血区神经元可通过激活凋亡途径发生再一步损伤[3]。因而保护缺血半影区神经元凋亡是一种潜在改善缺血性脑卒中后恢复的策略。因此,在本研究目的是观察早期跑步运动是否通过调节缺血半影区神经元凋亡在大鼠缺血/再灌注损伤模型中发挥神经保护作用。
1 材料与方法
1.1 实验动物及分组
雄性SD大鼠(240-280 g),购于山西医科大学实验动物中心(动物许可证号:SCXK(晋)2009-0001)。室内温度保持在(23±2)℃左右,明暗周期12 h,自由饮水和进食。在研究过程中对大鼠处理均按照国家颁布的《关于善待实验动物的指导性意见》和山西大同大学医学研究伦理委员会的要求严格执行。将SD大鼠随机分成4组:假手术+安静组(Sham-St,n=15)(240~280 g)、假手术+运动组(Sham-Ex,n=15)(240~280 g)、缺血+运动组[大脑中动脉闭塞(Middle cerebral artery occlusion, MCAO)-Ex,n=15)(240~280)g和缺血+安静组(MCAO-St,n=15)(240~280)g。
1.2 实验仪器和试剂
显微镜(日本Olympus公司);电动跑步机(安徽正华生物仪器设备有限公司);2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染料(美国Sigma公司);Caspase-3抗体(美国Sigma公司);TUNEL试剂盒(瑞士Roche公司)。
1.3 大鼠脑缺血/再灌模型
采用腹腔注射1%戊巴比妥钠(0.06 g/kg)麻醉大鼠。剪毛后颈部手术。在显微镜下分离出颈总动脉、颈外动脉和颈内动脉。然后用缝合线结扎颈总动脉近心端和颈外动脉远心端,用针头在颈外动脉远端动脉壁上扎一个小口,将准备好的线栓从颈外动脉小孔插入颈总动脉,通过颈内动脉最后到达大脑中动脉,用缝合线固定线栓,MCAO后1 h 拔出线栓,缝合皮肤。MCAO手术成功率约为70%。假手术组大鼠按上述步骤进行手术操作,但不插入线栓。在MCAO后7 d处死大鼠,提取各组大鼠缺血半影区进行分析。缺血病灶与周围正常脑组织之间有一形态和结构过渡区,该区着色和细胞形态结构界于病灶和正常脑组织之间,即缺血半影区。
1.4 运动干预方法
采用ZH-PT型电动跑步机用于大鼠运动训练。在进行MCAO手术前,训练运动组大鼠在跑步机上进行3 d适应,10 min/d。MCAO手术48 h后,MCAO-Ex和Sham-Ex大鼠连续5 d进行跑步运动(15 m/min,30 min/d)。而MCAO-St和Sham-St大鼠不进行任何运动。
1.5 神经行为学评价方法
MCAO后再灌7 d,采用5分制神经分级(0-4)评估神经缺损。0=无明显神经缺损;1=右侧前肢弯曲;2=当尾巴被牵拉时,右前肢握力下降;3=当尾巴被牵拉时,向右转圈;4=自发向右转圈[4]。
1.6 大鼠脑TTC染色方法
行为学评分后将大鼠迅速断头取脑,放入-20℃冰箱冷冻约15 min后,行冠状切片,厚度为1.5 mm。将切好的脑片迅速放入准备好的1% 的TTC磷酸盐缓冲液中,在37℃水浴中避光孵育10 min。脑梗死区域不染色(灰白色),而正常脑组织染为深红色。依据相关文献报道[5]方法计算MCAO后脑梗死体积。
1.7 大鼠脑TUNEL分析神经元凋亡情况
按照TUNEL试剂盒的操作步骤检测各组大鼠缺血半影区神经元凋亡(n=5)。TUNEL阳性细胞在形态学上被认为是凋亡神经元。每只大鼠显微镜下随机取3个视野计数TUNEL阳性神经细胞数量,然后取平均值。
1.8 大鼠脑免疫印记分析Caspase-3表达水平
神经行为学评分后,将大鼠迅速断头取脑,提取大鼠缺血半影区蛋白,按10 ml/g比例加入全细胞裂解液[mmol/L:Tris-Cl 50(pH 7.5),乙二醇双四乙酸,乙二胺四乙酸,二巯基苏糖醇,Na4P2O75,冈田酸5×10-5,高肽酶素、抑肽酶、胃酶抑素A、糜蛋白酶抑制素各5 mg/L,2%SDS]。匀浆、超声破碎,待组织细胞全部溶解后。BCA法进行蛋白定量,加入Loading Buffer制备成电泳样品。取30g进行SDS-PAGE电泳,然后转至PVDF膜上。经5%牛奶孵育1 h。用兔源Caspase-3(1∶2 000)和鼠抗-actin多克隆抗体(1∶2 000)4 ℃孵育3 h。用PBS-T稀释山羊抗兔和山羊抗鼠二抗(1∶ 25 000),室温孵育1 h。利用化学发光扫描系统检测相关蛋白表达并摄片,采用Quantity one图像分析软件对目标条带吸光度积值进行分析,以-tubulin条带吸光度积值做为参照,两者比值为目标蛋白表达水平。
1.9 统计学处理
2 结果
2.1 各组大鼠神经行为学评分比较
对缺血/再灌大鼠进行神经行为学观察,Sham-St和Sham-Ex大鼠神经行为学表现正常。缺血/再灌损伤使MCAO-St和MCAO-Ex大鼠神经行为学功能受到严重损伤,神经行为学评分显著增高,但MCAO-Ex大鼠神经行为学评分又明显低于MCAO-St大鼠(P<0.05,表1)。
Tab. 1 Neurobehavioral scores and infarction volume of rats in each group
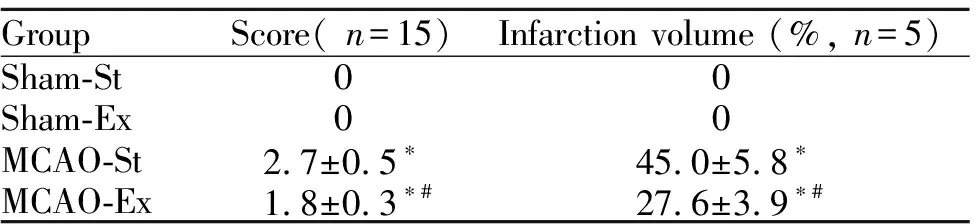
GroupScore(n=15)Infarctionvolume(%,n=5)Sham-St00Sham-Ex00MCAO-St 2.7±0.5∗ 45.0±5.8∗MCAO-Ex 1.8±0.3∗# 27.6±3.9∗#
*P<0.05vssham;#P<0.05vsMCAO-St
2.2 各组大鼠脑梗死体积比较
各组大鼠脑梗死体积如图1所示,Sham组大鼠均无脑梗死。缺血/再灌损伤使MCAO-St和MCAO-Ex大鼠出现明显脑梗死,但MCAO-Ex大鼠脑梗死体积显著低于MCAO-St大鼠(P<0.05, 表1)。
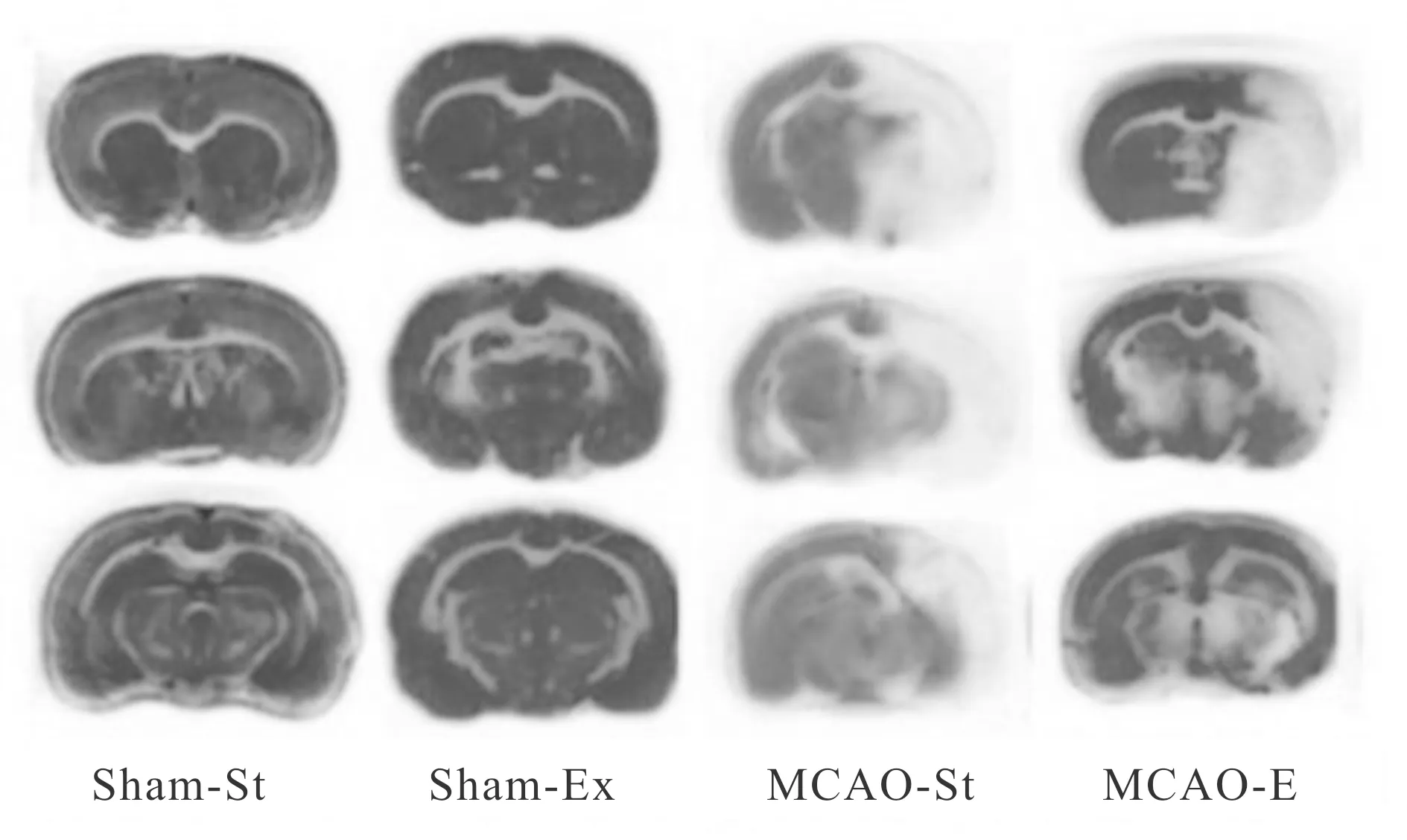
Fig. 1 Typical TTC staining in each group
2.3 TUNEL分析大鼠脑缺血半影区神经元凋亡情况
采用TUNEL方法分析各组大鼠缺血半影区凋亡情况表明,Sham-St和Sham-Ex大鼠未检测到TUNEL阳性细胞(图2)。缺血/再灌损伤使MCAO-St和MCAO-Ex大鼠缺血半影区发生凋亡,但MCAO-Ex大鼠凋亡阳性细胞数显著低于MCAO-St大鼠(P<0.05,表2)。
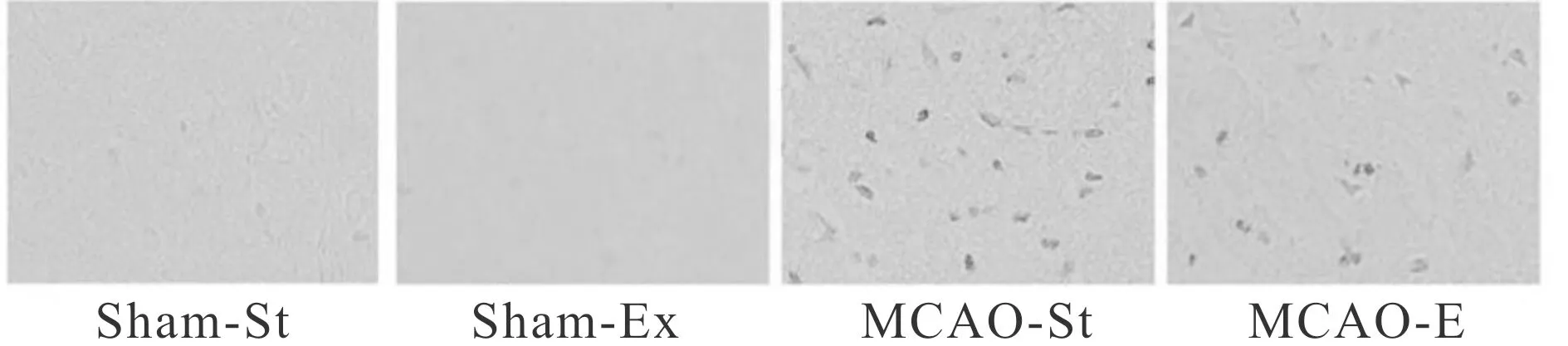
Fig. 2 Typical TUNEL staining in each group(Uncoulored ×40)
Tab. 2 Apoptotic cells and Caspase-3 protein levels of rats in each group(n=5)

GroupApoptoticcells(number/field)Caspase-3(%)Sham-St0 4.8±0.5Sham-Ex0 4.9±0.8MCAO-St 80.0±9.0∗ 18.6±4.0∗MCAO-Ex 60.0±5.0∗# 10.0±3.4∗#
*P<0.05vssham;#P<0.05vsMCAO-St.
2.4 免疫印记分析大鼠脑缺血半影区Caspase-3表达
采用免疫印记方法分析各组大鼠缺血半影区Caspase-3表达的结果表明,MCAO-St和MCAO-Ex大鼠Caspase-3表达均显著高于Sham-St和Sham-Ex大鼠(P<0.05),但MCAO-Ex大鼠Caspase-3表达显著低于MCAO-St大鼠(P<0.05,图3)。
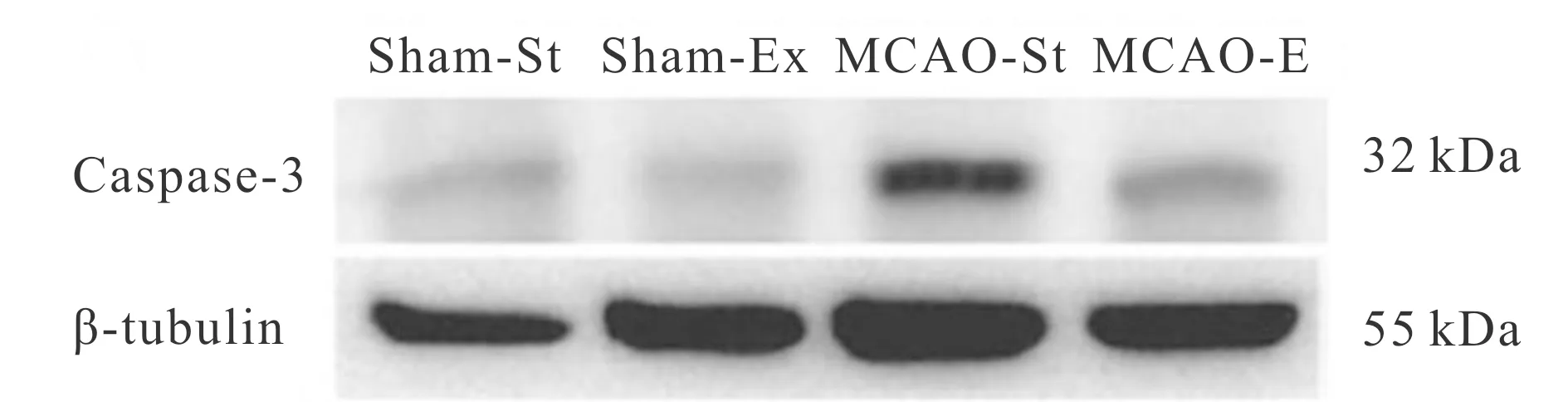
Fig. 3 Typical immunoblotting images in rats of each group
3 讨论
本研究主要观察早期跑步运动对缺血/再灌注损伤大鼠神经行为学损伤和脑梗死体积的影响。同时评估各组大鼠缺血半影区凋亡发生情况。研究结果表明,早期跑步运动可减少缺血/再灌注损伤大鼠脑梗死体积,并改善神经行为学损伤。此外,早期跑步运动可降低缺血/再灌注大鼠缺血半影区TUNEL阳性细胞数及Caspase-3表达。上述结果提示,早期跑步运动可能通过调节凋亡在缺血/再灌注损伤大鼠中发挥神经保护作用。
大鼠缺血区根据神经元损伤模式可分为缺血核心区和半影区,缺血核心区神经元立即坏死,很少能被挽救;相反,半影区神经元缺血损伤相对较轻[6]。因此,半影区可能在缺血后恢复,被认为是治疗干预的靶点。此外,在大脑急性缺血性损伤后,半影区可通过炎症反应和凋亡发生再一步损伤[7]。因此,抑制半影区炎症和凋亡可促进神经元恢复正常。杨林等人也证实,大鼠缺血性卒中后早期运动可通过抑制急性神经炎症反应改善缺血区大脑损伤[8]。本研究表明,早期运动可降低缺血/再灌注大鼠缺血半影区TUNEL阳性细胞数及Caspase-3表达。Caspase信号传导、炎症因子、氧化应激、钙失调和兴奋性毒性是神经细胞凋亡的主要原因[9]。我们的结果表明,早期运动可通过抑制Caspase信号途径,从而调节缺血半影区的神经元凋亡。然而,具体的机制仍然不清楚。下一步需要检测各组大鼠细胞色素-c、凋亡诱导因子(apoptosis-inducing factor, AIF)、热休克蛋白-70(heat shock protein, HSP-70)和细胞外信号调节激酶1/2(extracellular signal- regulated kinase 1/2, ERK1/2)表达。
以往研究表明,早期运动可促进缺血性卒中大鼠运动功能恢复。Coleman等人报告称,在中风2周内进行康复训练有助于患者受损运动功能的改善[10]。Yang等人发现MCAO大鼠24 h后开始2周运动可促进大鼠的运动和空间记忆恢复[11]。多数学者认为,脑梗死后康复治疗介入时间越早,神经功能恢复越好,后遗症并发症越少。有研究发现,大鼠脑缺血后24 h开始运动训练,其神经功能较模型组明显恢复[12]。本研究表明,大鼠脑缺血后48 h开始运动,MCAO大鼠神经功能评分显著低于不运动MCAO大鼠,这与上述研究是一致的。一些可能的机制被用来解释早期运动的积极作用。以前的研究发现,运动可促进血管生成,增加微血管密度,改善大脑血供,从而减少脑梗死体积[13,14]。
综上所述,我们的结果表明,早期跑步运动可显著降低大鼠脑缺血/再灌注损伤的梗死体积,并改善神经功能损伤;此外可降低TUNEL阳性细胞数及Caspase-3表达。本研究提示,脑缺血后早期运动可能通过调节凋亡途径发挥神经保护机制。
