急、慢性运动对2型糖尿病大鼠脂肪PI3K/AKT/GLUT4通路的影响*
2020-05-18衣雪洁孙玉霞姚婷婷曹师承张翠萍
衣雪洁,孙玉霞,姚婷婷,李 晶,高 畅,刘 璐,曹师承,常 波,张翠萍
(1.沈阳体育学院运动人体科学学院, 辽宁 沈阳 110102;2.中国医科大学公共基础学院运动医学教研室, 辽宁 沈阳 110001)
糖尿病(diabetes mellitus,DM)是一种发病原因尚不明确的慢性疾病。2015年糖尿病地图数据显示[1]世界成年糖尿病患者高达4.15亿人,预测到2040 年糖尿病成年患者将高达6.42亿。2型糖尿病(type 2 diabetes mellitus,T2DM)作为糖尿病的重要组成部分,其发病率约占整个DM人群的90%以上。T2DM患者为自身胰岛素敏感性低,出现胰岛素抵抗。胰岛素抵抗的机制较为复杂,年龄的增长和长期的高脂饮食会引起骨骼肌、脂肪、肝脏等组织胰岛素抵抗,出现糖转运、储存、氧化异常,脂肪和骨骼肌是糖、脂代谢的重要器官,在糖尿病的发生、发展以及防治中发挥重要的作用。有研究表明磷脂酰肌醇3激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)-蛋白激酶B(protein kinase B,AKT)通路是调节糖代谢的重要信号转导通路[2],其表达异常可影响外周葡萄糖运载体4(glucose transporter,GLUT4)的合成、分泌、转位,引起外周组织糖代谢异常,进而引起血糖升高。有研究表明:T2DM患者骨骼肌PI3K/AKT/GLUT4信号转导通路不同程度损害,导致骨骼肌糖转运异常,糖的氧化利用下降,引发骨骼肌胰岛素抵抗。脂肪细胞是能量的储存器官,其在糖代谢中的作用往往不被重视,Abale等的研究显示[1],选择性降低小鼠脂肪组织GLUT4的表达,即使肌肉中的GLUT4表达正常,胰岛素刺激的骨骼肌对葡萄糖摄取能力也会下降40%,提示脂肪细胞GLUT4表达的下降可能诱导其它组织发生胰岛素抵抗(insulin resistance, IR)。运动是防治T2DM的重要手段。关于运动对胰岛素介导的PI3K/AKT信号通路的影响存在争议,且研究多集中在骨骼肌。多数研究表明,长期有氧运动可增加骨骼肌PI3K和AKT的mRNA和蛋白表达水平以及活性。但对T2DM大鼠脂肪组织PI3K/AKT/GLUT4的研究还未见报道。本研究通过高脂膳食结合小剂量STZ建立T2DM大鼠模型,探讨长期有氧运动和一次性运动干预对T2DM大鼠血糖、血脂及脂肪组织中PI3K、AKT和GLUT4的蛋白表达的影响,为揭示运动干预改善2型糖尿病胰岛素抵抗的作用机制及探寻2型糖尿病的干预方法提供理论依据。
1 材料与方法
1.1 实验动物及分组
15月龄雄性SD大鼠52只(由中国人民解放军军事医学动物实验中心提供),标准饲料适应性饲养1周后,随机抽取13只作为正常对照组(NC组),给以标准饲料喂养,其余39只为高脂组(HF组),以高脂饲料喂养,高脂饲料的成份[3]见表1,(饲料由沈阳前民饲料厂生产)。组间体重无显著差异。10周后高脂组体重超过NC组的20%以上。给高脂组大鼠一次性腹腔注射STZ,25 mg/kg。注射STZ后的第 2、4 周时,采血测定血糖,血糖≥ 16.7 mmo l/L 为达到造模标准[4],剔除血糖小于16.7 mmol/L大鼠5只。将其余34只造模成功大鼠随机分成糖尿病对照组(Diabetes control group,DC组,10只),糖尿病慢性运动组(Diabetes Chronic Exercise Group,DCE组,12只),糖尿病急性运动组(Diabetes Acute Exercise Group,DAE组12只)。分组后体重血糖见表2。分组后各组小鼠的饮食方案不变,DCE和DAE进行运动干预,NC和DC组不施加任何干预,8周后统一时间取材。

Tab. 1 Nutritional formula of feed during mouse feeding(g/100 g)
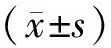
Tab. 2 Body weight and blood glucose after grouping in rats
NC: Normal control group; DC: Diabetic control group; DCE: Diabetic chronic exercise group; DAE: Diabetic acute exercise group
1.2 运动干预方案
在750 cm×115 cm,水温为30℃的泳池中,对DCE组进行8周的游泳运动干预,每周运动6 d,游泳时间见表3。DAE组在取材前12 h进行2次45 min的游泳,间隔45 min,与DCE组末次的运动负荷相同。

Tab. 3 DCE group exercise scheme(min)
W:Week
1.3 取材
游泳干预8周后对所有大鼠进行取材,所有组在取材前禁食12 h,DCE组观察长期运动引起的适应性反应,为排除末次运动的应激反应影响,取材时间定在末次运动后36~48 h;DAE组观察一次性运动的应激反应,由于一次性运动的应激反应一般在运动后24 h减弱或消失,因此取材的时间定在一次性运动后12~16 h。称重后腹腔注射2%戊巴比妥钠溶液(80 mg/kg)进行麻醉,主动脉取血,制备血清。迅速分离肾周、肠系膜周围脂肪,称重后液氮冷冻保存。由于在运动过程中出现动物死亡现象,取材后,将各组标本均随机取8只测量所需指标。
1.4 指标的测定
体重:电子秤称量大鼠体重;血糖:用血糖仪测定血糖;血脂四项:利用半自动生化分析仪(中生北控生物科技股份有限公司生产的试剂盒);血清胰岛素:放免法(北京中国原子能科学研究院同位素研究所125I-胰岛素放射免疫分析药盒);PI3K、AKT1、AKT2、GLUT4蛋白表达含量测定:Western blot印迹分析方法。取 100 mg 样品加入 400 μl蛋白裂解液,1 μl蛋白酶抑制剂,匀浆、离心、取上清;BCA 法测定蛋白含量;每泳道上样量为 30 μg。电泳后将蛋白转印至PVDF 膜上,封闭后一抗孵育过夜。洗去多余一抗,于脱色摇床上避光孵育二抗1 h。扫描条带,测量灰度值。
1.5 统计学处理
2 结果
2.1 各组大鼠体重,空腹血清胰岛素、血糖浓度
如表4所示,与NC组比,DC组体重,血清胰岛素,血糖水平显著升高(P<0.01)。与DC组比,DCE组血清胰岛素,血糖水平显著降低(P<0.01),体重下降但无显著性差异(P>0.05);DAE组血清胰岛素,血糖水平降低(P<0.05),体重基本无变化。

Tab. 4 Comparison of body weight, serum insulin, blood glucose
**P<0.01vsNC group;#P<0.05,##P<0.01vsDC group
2.2 各组大鼠血脂浓度(TG、TC、HDL-C、LDL-C)
如表5所示,与NC组相比,DC组的TG、TC、LDL-C含量显著升高(P<0.01),HDL-C含量显著降低(P<0.01);与DC组相比,DCE组和DAE组的TG、TC、LDL-C均显著降低(P<0.05),HDL-C含量均显著升高(P<0.05)

Tab. 5 comparison of TG, TC, HDL-C and LDL-C
TG:Triglyceride;TC:Total cholesterol;HDL-C:High density liptein cholesterol;LDL-C:Low density liptein cholesterol
**P<0.01vsNC group;#P<0.05vsDC group
2.3 大鼠脂肪PI3K,AKT1,AKT2,GLUT4表达水平
如图1所示,与NC组相比,DC组PI3K、AKT1、AKT2和GLUT4含量显著降低(P均<0.01,表6)。与DC组相比,DCE,DAE组PI3K、AKT1、AKT2和GLUT4含量显著升高(P<0.01,P<0.05;P<0.01,P<0.01;P<0.01,P<0.01;P<0.01,P<0.05)

Tab. 6 Comparison of PI3K,AKT1,AKT2,GLUT4 relative protein levels
PI3K:Phosphatidylinositol 3-hydroxy kinase; AKT: Protein kinase B; GLUT4: Glucose transporter 4
**P<0.01vsNC;#P<0.05,##P<0.01vsDC

Fig. 1 PI3K,AKT1,AKT2,GLUT4 protein expression
**P<0.01vsNC group;#P<0.05,##P<0.01vsDC group
3 讨论
大量研究表明,年龄老化和肥胖与胰岛素抵抗关系密切,肥胖中老年人群IR和T2DM发病率明显高于同年龄正常人群。T2DM患者常表现为肥胖和糖、脂代谢紊乱,并以血糖和TG、TC、LDL升高,HDL-C下降为特点[5]。动物实验表明,长期的高脂饮食引发肥胖和脂代谢紊乱,并发高血脂和高游离脂肪酸(free fatty acid, FFA),FFA的升高会诱发骨骼肌、肝脏等器官胰岛素抵抗,糖的氧化利用和糖原的合成减少,使血糖升高。本实验结果显示:糖尿病对照组大鼠血糖、血清胰岛素、血脂均显著升高,相反HDL-C则显著下降。进一步证明:长期的高脂饮食结合小剂量的STZ可有效的诱导大鼠糖脂代谢紊乱,诱发大鼠产生T2DM。一些研究表明,外周胰岛素抵抗是引发2型糖尿病的主要原因,脂肪和骨骼肌作为外周器官分别发挥着能源物质的储存和利用作用,在2型糖尿病的发生和发展中起着重要的作用,也是运动改善胰岛素抵抗的重要作用靶器官。
GLUT4穿梭于细胞的内外膜,能在胰岛素的作用下刺激骨骼肌摄取葡萄糖[6]。在这个过程中 PI3K /AKT信号通路发挥重要作用,胰岛素激活PI3K /AKT信号通路后可引起GLUT4的构象发生改变,由细胞内转位到细胞膜上,将血液中的葡萄糖转运到骨骼肌中,从起到降低血糖的作用[7]。长期高脂饮食引发的肥胖下调骨骼肌GLUT4总量,抑制细胞内膜GLUT4向细胞外膜的转位[8]。但2型糖尿病和运动干预对脂肪细胞PI3K /AKT信号通路影响的报道很少,本实验结果显示:糖尿病大鼠脂肪组织中PI3K、AKT1、AKT2和GLUT4的蛋白表达均显著下降。提示T2DM脂肪细胞PI3K/AKT/GLUT4通路受损,可能是脂肪组织产生胰岛素抵抗原因之一。另外T2DM引起的糖脂代谢紊乱,会引起脂肪组织中FFA 浓度超过正常水平时,过量的FFA会对细胞以及细胞器产生“脂毒性”作用,产生内质网应激[9]、氧化应激[10]、凋亡及炎症等。有研究发现,这种脂毒性作用可下调胰岛素介导的PI3K/AKT/GLUT4通路,抑制外周组织对葡萄糖的摄取和氧化利用。Abale等[1]选择性降低小鼠脂肪组织GLUT4的表达,肌肉中的GLUT4表达正常,但胰岛素刺激的骨骼肌对葡萄糖摄取能力下降40%,提示脂肪细胞GLUT4表达的下降可能诱导其它组织发生IR。TaKahash[11]的研究同样证实脂肪细胞中GLUT4含量的减少可能由GLUT4转录障碍引起。
有氧运动是降低体重和减脂的有效方法手段,并在临床T2DM的防、治中发挥作用。人体[12]和动物[13]实验表明,长期运动能有效降低体重、血糖,改善血脂紊乱。本实验显示:一次性运动可在12~16 h以内引起体内产生糖、脂代谢的应激反应,但并不能有效的降低体重;8周的游泳运动可有效的降低体重、血糖和胰岛素水平,改善血脂紊乱,并将这一结果保持在末次运动后36~48 h,但其作用的机制还不太清楚。
运动是防治T2DM的重要手段[14-16]。但对PI3K/AKT/GLUT4的影响结果不尽一致,本课题组在前期研究中发现:运动可有效提升2型糖尿病大鼠骨骼肌PI3K/AKT/GLUT4的蛋白表达,改善胰岛素抵抗[17]。但HOLTEN[18]在对健康成年人和糖尿病患者进行递增负荷力量训练发现每次运动不少于30 min,6次/周,6周后,运动并不增加PI3K p85亚基的蛋白含量。本研究结果显示:急性运动12~16 h和长期有氧运动36~48 h后均可以上调脂肪组织PI3K/AKT/GLUT4蛋白的表达,增加组织对葡萄糖的利用,缓解T2DM引起的糖、脂代谢异常,且长期运动的效果优于一次性运动。有研究显示[19],运动可以增加脂肪细胞和骨骼肌GLUT4的表达,提高IR状态下,脂肪和肌肉组织对葡萄糖的转运和利用,从而改善胰岛素抵抗Hussey[20]的研究也证实,急性运动能够增加2型糖尿病患者骨骼肌GLUT4 mRNA表达。
综上所述,T2DM使脂肪PI3K/AKT/GLUT4通路受损,可能是引发机体糖、脂代谢异常的原因之一。一次性运动引发的应激反应上调了该通路的蛋白表达,增强对血糖的摄取;长期运动则通过适应性反应缓解脂肪组织PI3K/AKT/GLUT4通路受损,改善糖脂代谢紊乱,缓解胰岛素抵抗。
