不同年龄段隐源性脑梗死患者卵圆孔未闭情况调查分析*
2020-05-18兰春伟袁昆雄李俊娜赵延杰叶佩茵王梦华王清勇
兰春伟,刘 涛,袁昆雄,李俊娜,赵延杰,叶佩茵,王梦华,王清勇
(中国科学院大学深圳医院神经内科,广东 深圳 518107)
隐源性脑梗死(cryptogenic cerebral infarction,CCI)是指通过系列的全面排查,仍未明原因或相关原因难以解释其发病原因的脑梗死[1-2]。卵圆孔未闭(patent foramen ovale,PFO)与隐源性卒中关系密切,CCI患者中PFO的发生率高达40%以上[3-4],然而目前研究仍未能确立PFO在缺血性卒中发病的独立危险因素地位[5]。为此,我们回顾我院进行过PFO检查的267例脑梗死患者的临床资料,比较不同年龄段CCI与已明原因脑梗死(dentified cerebral infarction,DCI)患者中PFO的阳性率差异,并探讨PFO与CCI的可能关系。
1 资料与方法
1.1 一般资料
选择2016年9月至2019年2月于中国科学院大学深圳医院神经内科住院治疗的267例脑梗死患者为研究对象。脑梗死诊断标准符合《中国急性缺血性卒中诊治指南2018》[6]临床诊断标准,均经MRI证实新近梗死灶。纳入标准:①发病72h内就诊;②入院3d内行头部MRI及头部MRA或CTA检查;③入院3d内完成颈动脉超声或颈部MRA或CTA检查;④入院1周内行经颅多普勒超声TCD发泡试验(contrastenhanced transcranial doppler,c-TCD)检查,阳性者进一步完成经食道超声或经心脏MRI检查确诊者;⑤年龄18~80岁。排除标准:①未行c-TCD检查者;②临床资料不全者。
1.2 方法
1.2.1 临床资料收集方法
收集患者基本信息,记录主要症状、体征、NIHSS评分等临床表现资料;记录吸烟、饮酒、高血压、高脂血症、糖尿病、冠心病、缺血性脑血管病病史及家族史等脑梗死危险因素;记录患者血常规、凝血五项、肝肾功能、血脂、血糖、心肌酶谱、血同型半胱氨酸、风湿四项、ENA12项、ANCA2项等血液学检验;记录患者心电图或动态心电图、胸部X线、经胸超声、头颅MRI等影像学检查;记录患者颈动脉超声、头颈部MRA或头颈部CTA检查资料。
1.2.2 分组方法
所有脑梗死患者的临床资料均重新经过系统评估,按照TOAST病因分型标准及2009年Timsit隐源性脑梗死最新定义[2],对脑梗死具体病因进行分型,病因明确者纳入DCI组,原因不明者或缺乏充足病因的脑梗死患者纳入CCI组,其界定由3名经验丰富的神经内科专家来最终确诊。每组患者根据年龄进一步分为青年组(18~44岁)、中年组(45~55岁)、老年组(>55岁)3个亚组。研究共入选患者267例,其中男165例,女102例;年龄22~80岁,平均(59.97±14.45)岁。经过病因评估分组,CCI组患者152例,其中男97例,女55例;平均年龄(59.11±14.57)岁。DCI组患者115例,其中男68例,女47例;平均年龄(61.12±14.29)岁。115例DCI患者中,大动脉粥样硬化型患者67例,心源性栓塞型患者15例,小动脉闭塞型卒中患者26例,其他明确原因型患者卒中7例。
1.2.3 PFO检查诊断方法
所有脑梗死患者均在入院1周内及时行c-TCD检查筛检PFO合并情况,阳性者进一步经食道超声或经心脏MRI电影成像技术检查确诊PFO存在情况及未闭PFO大小。PFO相关检查及结果判读均由经验丰富的相关专家完成。
(1) c-TCD检查方法。所用仪器为南京科进经颅多普勒仪,按文献[7]要求采用2 MHz探头监测患者大脑中动脉或椎动脉进行检测。
(2)经食道超声检查方法。检查前患者保持4h以上禁食状态,采用利多卡因胶浆对其口咽部行局部麻醉,患者取左侧卧位,口中放置咬合保护器;开始检查后,将探头缓慢插入患者食道,对患者的房间隔、卵圆窝处进行全面的观察,检查过程中同时进行动态存储的记录,检查完成后再对图像进行回放观察,观察记录患者PFO存在情况及其长度、内径,记录是否合并其他情况[8]。
(3)经心脏MRI检查方法。采用GE1.5T超导型MRI系统,按文献[9]方法进行检查获取图像。动态观察房间隔、室间隔及卵圆孔区解剖结构及血液分流情况,测量缺损孔径大小。
1.3 统计学方法
2 结 果
2.1 两组患者一般资料比较
两组脑梗死患者的年龄、性别、体质指数、吸烟、饮酒等一般资料差异均无统计学意义(P>0.05),见表1。

表1 两组患者一般资料比较
2.2 两组脑梗死患者卵圆孔未闭阳性率比较
CCI组和DCI组患者PFO的阳性率分别为36.84%(56/152)、20.87%(24/115),其差异有统计学意义(χ2=8.00,P=0.01)。按年龄段将两组患者进一步分为青年、中年、老年组3个亚组,青年组、中年组CCI患者中PFO阳性率均高于DCI组(54.55% VS 13.33%、41.86% VS 16.67%),其差异均有统计学意义(P=0.01、P=0.04)。老年组CCI与DCI组患者中PFO阳性率差异无明显统计学意义(29.89% VS 23.68%,P=0.37)。见表2。
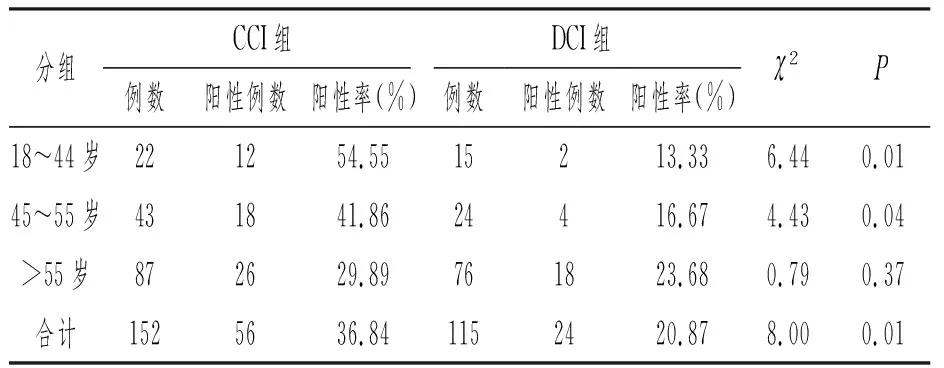
表2 两组不同年龄段患者卵圆孔未闭发生率
2.3 两组不同性别脑梗死患者卵圆孔未闭阳性率比较
按性别分组比较,男性CCI组患者中PFO阳性率均高于DCI组(38.14% VS 22.06%),其差异有统计学意义(P=0.03)。女性CCI组患者中PFO阳性率与DCI组比较(34.55% VS 19.15%),其差异无统计学意义(P=0.07)。见表3。
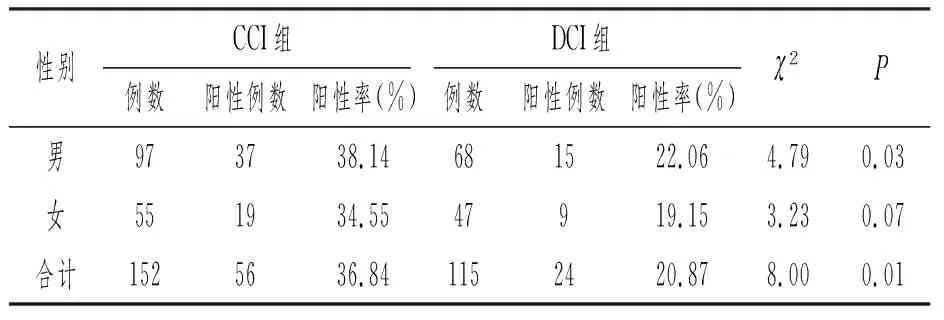
表3 两组不同性别患者卵圆孔未闭发生率
3 讨 论
卵圆孔是胎儿时期的血液循环通道,胎儿出生后,肺循环开始工作,此时左心房压力升高大过右心房,卵圆孔开始从功能性上逐渐闭合。卵圆孔大多在出生后1年内逐渐闭合,超过3岁仍未闭合者则称为PFO。来源于右心房、未闭卵圆孔通道局部或下肢、骨盆等外周静脉系统等的栓子,可以经过未闭卵圆孔异常通道进入左心腔及主动脉系统从而造成脑栓塞临床事件的发生[10]。
不同人群中的PFO发病率不尽相同,尸检报道表明总的发病率在17%~35%[11],多达23项的对照病例数据表明,不明原因缺血性卒中患者中PFO的发生率更高,合并PFO者卒中风险更高[12],在这些研究中,多为隐源性卒中与正常群体PFO合并情况的对照研究,隐源性脑卒中与已明原因缺血性卒中患者中PFO发生率研究较少。本研究表明,CCI患者PFO发生率(36.84%)明显高于已明原因脑梗死组(20.87%)患者,其差异有明显统计学意义(χ2=8.00,P=0.01),由此说明,PFO可能为隐源性卒中可能病因之一。
不同年龄段人群中卵圆孔未闭发生率不尽相同,Hagen等[13]对965例心脏尸检患者调查发现,PFO的发生率在30岁以下为34.3%,40~80岁为25.4%,90~100岁为20.2%,其发生率随年龄的增长呈下降趋势,其大小却呈增大趋势。不同年龄段缺血性卒中人群中PFO的发生率也有不同,有Meta分析表明,<55岁的隐源性卒中患者较同龄段已明病因的卒中患者相比,PFO的患病率增高6倍[14]。本研究显示,与已明原因脑梗死患者比较,小于55岁的青年、中年患者群体隐源性卒中患者中PFO的发生率明显增高(54.55% VS 13.33%、41.86% VS 16.67%),其差异均有统计学意义(P=0.01、P=0.04),而老年组CCI与已明原因组患者中PFO阳性率差异无明显统计学意义,说明相对老年人来说,PFO与中青年不明原因的缺血性卒中风险增高的相关性更强,PFO更可能是中青年隐源性卒中的独立危险因素之一。
不同性别人群脑卒中发病率有所不同,脑卒中群体中男性发病率高于女性,其原因可能与男性群体有更高的吸烟、酗酒风险,在家庭社会中承担更多的压力责任等有关。Nedeltchev等[15]曾研究表明男性CCI患者中男性PFO阳性率高于女性(38%VS28%,P=0.014)。本研究表明,男性组CCI患者中PFO阳性率也高于已明原因组(38.14% VS 22.06%,P=0.03),分析其原因可能与男性患者更多的参与日常体力劳动,举重、用力等类活动更多,更易导致一过性的右向左分流发生或使原来小量的分流变为大量的分流,从而增加了PFO及相关脑卒中事件的发生。
PFO是缺血性卒中发生的重要危险因素,与老年人相比,中青年缺血性脑卒中的病因和危险因素更加复杂化。本研究进一步表明,隐源性卒中患者中PFO的发生率更高,尤其是对于55岁以下的中青年隐源性卒中患者,PFO可能为其独立危险因素之一。对于此类患者,临床中更应警惕卵圆孔未闭的存在,并深入研究其潜在的病因及治疗手段,从而利于隐源性卒中的进一步防控。
