α-L-鼠李糖苷酶基因的重组表达及其应用
2020-05-18叶德晓李慧灵林育成邓诚陈宏基周金林
叶德晓,李慧灵,林育成,邓诚,陈宏基,周金林*
(1.广东金骏康生物技术有限公司,广东佛山 528225;2.佛山汇腾生物技术有限公司,广东佛山 528225)
α-L-鼠李糖苷酶(EC 3.2.1.40)是一类糖苷水解酶,主要属于GH13、GH28、GH78和GH106家族,能高效水解许多天然糖苷酶类化合物末端的鼠李糖基,如水解橙皮苷、柚皮苷、芦丁和槲皮苷等天然黄酮类糖苷化合物为橙皮素单葡萄糖苷、普鲁宁、异槲皮苷和槲皮素等。α-L-鼠李糖苷酶能应用于食品业中柑桔类果汁的去苦、饮料风味改善以及食品添加剂的生产等[1]。除了在食品领域的应用,α-L-鼠李糖苷酶还能应用于医药行业,如用于生产药物或者药物中间体以及对药物进行改性以提高药效等[2]。
橙皮苷在柑桔属的果皮中含量丰富,而我国是柑桔属果树种植和产量的第一大国,因此提高其综合利用率对增加产业附加值具有重大意义。橙皮苷溶解性极低,人体较难吸收,生物利用率低,表现出相对较弱的药理作用。研究表明,黄酮类化合物脱掉部分糖苷或者全部糖苷后,能被小肠更好地地吸收,以此来提高黄酮类化合物在人体的生物利用率[3]。利用α-L-鼠李糖苷酶将橙皮苷水解为橙皮素单葡萄糖苷,改善其溶解性,提高其生物利用率,可以加大其在食品和医药行业的运用范围;另外,橙皮素单葡萄糖苷在鼠李糖转移酶的催化下生成新橙皮苷,新橙皮苷是合成天然甜味剂NHDC的关键中间体,在酸橙中含量低,提取工艺复杂,成本高。因此,选用低成本的橙皮苷通过α-L-鼠李糖苷酶和鼠李糖转移酶转化得到新橙皮苷在合成NHDC的产业化上有重大价值。
将来源于T.petrophila的TpdRha基因进行分子克隆和异源表达,探究其水解橙皮苷为橙皮素单葡萄糖苷的活性,为后续研究酶转化新橙皮苷及NHDC奠定物质基础,能产生较好的社会价值。
1 材料与方法
1.1 材料
克隆宿主大肠杆菌Top10、表达宿主毕赤酵母GS115和毕赤酵母KM71H、表达载体pPIC9K均为实验室保存。实验所用酵母粉、蛋白胨、氯化钠、山梨醇、琼脂粉、琼脂糖、磷酸氢二钠和柠檬酸钠等试剂均为分析纯,购自生工生物工程(上海)股份有限公司;BIO-RAD MicroPulser 1652100型电转仪,购自美国BIO-RAD公司;Agilent 1100型高效液相色谱,购自安捷伦科技有限公司。
1.2 方法
1.2.1 TpdRha序列分析
由CAZy数据库,获知6个已鉴定3D结构α-L-鼠李糖苷酶。在NCBI中获知其氨基酸序列,利用Clustalx软件进行氨基酸多重序列比对,再通过ESPript 3.0对比对结果进行渲染,最后用MEGA7软件制作分子进化树。
1.2.2 TpdRha基因克隆
根据TpdRha在NCBI数据库中公布的序列信息,利用密码子偏好性进行优化,依据优化结果进行合成,将其克隆至pPIC9K载体上。提取质粒pPIC9K-TpdRha,以质粒为模板,通用引物AOX进行PCR反应,产物经琼脂糖凝胶电泳检测,交由生工生物有限公司测序。
1.2.3 异源表达
利用SalⅠ酶线性化pPIC9K-TpdRha质粒,回收后将其电转化毕赤酵母GS115和毕赤酵母KM71H中。经过含G418的YPD培养基筛选,挑选单克隆裂解后以通用引物AOX进行PCR鉴定,将正确的阳性克隆命名为GS115-TpdRha和KM71H-TpdRha。
接种菌株到YPD培养基于30 ℃活化培养,1%的接种量至BMGY培养基,30 ℃培养OD600到2~6。室温离心,收集菌体,用BMMY重悬菌体,28 ℃诱导表达,每天加终浓度为0.5%的甲醇,维持诱导条件。诱导表达5 d,4 ℃离心,上清即为粗酶液。
1.2.4 TpdRha酶解橙皮苷
分别加入pH为4.5的磷酸氢二钠-柠檬酸缓冲液、橙皮苷混匀,加入粗酶液到混合后的橙皮苷溶液中,60 ℃恒温反应4 h,加入等体积的乙酸乙酯抽提,取上层有机相,经真空浓缩后,反应产物溶解于甲醇中,结果用HPLC检测。
2 结果与分析
2.1 序列分析
检索CAZy数据库,TpdRha属于GH78家族,具有876个氨基酸残基和糖基化位点,无信号肽序列,包含4个超家族保守结构域,其中Bac_rhamnosid_N可能与识别底物有关,另3个保守结构域与其生物活性相关。TpdRha与DtRha(ACI19983.1)序列同源性为46.25%;与SaRha78A(BAC68538.1)序列同源性为35.64%;与AtRha(AFH54529.1)序列同源性为31.86%;与RhaB(BAB62315.1)序列同源性为27.78%;与KoRha(AEX05711.1)序列同源性为24.52%;与BtRha(AAO76108.1)序列同源性为20.76%。多重序列比对结果显示Asp456、Trp466、Gly468、Asp469、Asp572、Trp573、Trp745、Glu746、Ser758和His761的氨基酸残基高度保守,其中Asp456、Glu462、Asp469和Glu746在底物结合方面和生物催化活性上起到重要作用[4-5]。图1的系统发育进化树表明,TpdRha和DtRha进化关系相近,属于一个进化分支,研究报导DtRha具有水解橙皮苷为橙皮素单葡萄糖苷的活性[6],为研究TpdRha的水解橙皮苷的活性提供了进化理论基础。
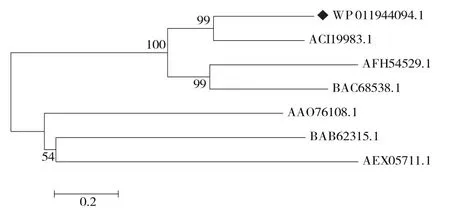
图1 TpdRha系统发育进化树
2.2 TpdRha基因克隆
将TpdRha克隆至pPIC9K载体上。图2A是使用AOX引物进行菌液PCR鉴定的结果,可以得到约2 800 bp大小的片段,测序正确。对构建成功的重组菌命名为Top10-pPIC9K-TpdRha,保留菌种,培养,提取质粒(图2B)。
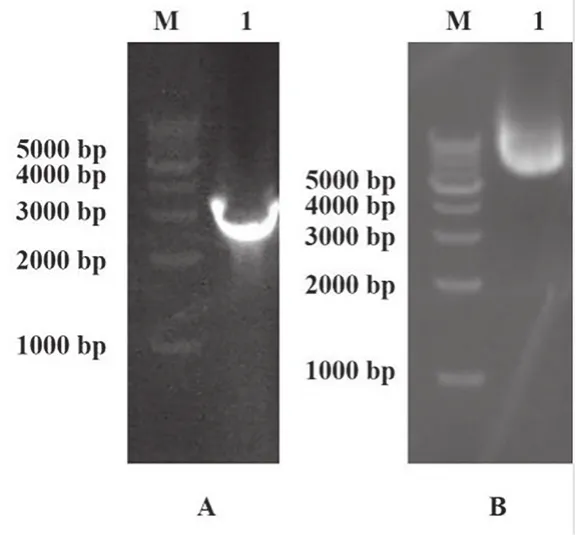
图2 pPIC9K-TpdRha克隆及质粒提取
2.3 构建pPIC9K-TpdRha重组表达毕赤酵母菌
线性化pPIC9K-TpdRha质粒电转化至毕赤酵母GS115和KM71H中,得到的重组表达菌株分别命名为GS115-TpdRha和KM71H-TpdRha。挑选单菌落通用引物AOX进行菌落PCR鉴定。
图3为重组毕赤酵母菌液PCR鉴定结果。图3A结果显示GS115-TpdRha阳性菌株在2 200 bp出现AOX条带以及在2 800 bp左右出现目的基因条带,由于TpdRha基因大小为2 600 bp,当重组载体整合于GS115基因组后,TpdRha基因与pPIC9K两端序列同源臂结合,在PCR扩增时,目的基因将变成2 800 bp的片段。结果表明,TpdRha基因实现与毕赤酵母GS115基因组成功整合。
图3B结果显示KM71H-TpdRha阳性菌株只在2 800 bp左右出现目的基因条带,由于TpdRha基因大小约为2 600 bp,当重组载体整合于KM71H基因组后,TpdRha基因与pPIC9K两端序列同源臂结合,在PCR扩增时目的基因将变成2 800 bp的片段,而KM71H细胞本身不具有AOX基因,因此只出现一条条带。结果表明,TpdRha基因实现与毕赤酵母KM71H基因组成功整合。

图3 pPIC9K-TpdRha重组毕赤酵母鉴定
2.4 TpdRha酶转橙皮苷应用
重组表达菌株GS115-TpdRha和KM71HTpdRha经甲醇诱导表达后,分离得到粗酶液。以橙皮苷为底物进行反应,反应产物用HPLC进行检测。图4检测结果显示,GS115-TpdRha和KM71HTpdRha异源表达得到的粗酶液均对橙皮苷有水解活性,转化率分别为25.38%和36.64%,KM71HTpdRha表达得到的酶活相对更强。两种不同宿主表达出来的活性存在差异,推测与TpdRha在宿主的糖基化或表达量有关,其次与分泌表达后的降解率相关。对二者表现出的酶活差异,后续相关研究将采用KM71H-TpdRha重组菌进行优化发酵生产TpdRha,为其进一步应用于以橙皮苷为底物生产橙皮素单葡萄糖苷奠定基础。
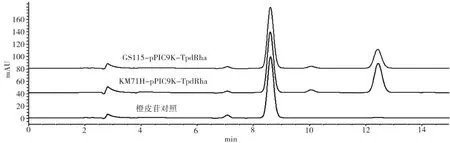
图4 TpdRha异源表达活性检测
3 结论
α-L-鼠李糖苷酶在天然产物的转化应用中具有重大价值,从不同水平对其进行研究,可以为其在食品医药行业上的产业化应用提供理论基础。以可耐热生长的T.petrophila的α-L-鼠李糖苷酶为目标,对其氨基酸序列进行分析,发现其含有876个氨基酸残基,无信号肽序列,有糖基化位点和4个保守超家族结构域。序列比对显示TpdRha与DtRha同源性较高,为46.25%;多重序列比对结果显示TpdRha有10个氨基酸残基位点高度保守;经3D结构分析推测Asp456、Glu462、Asp469和Glu746在底物结合方面与生物催化活性上起重要作用;系统发育进化树结果显示TpdRha与DtRha属于同一个进化分支。
