单细胞拉曼分选技术在大肠杆菌分离中的应用
2020-05-18李备张来明李文杰
李备,张来明,李文杰
(1.中国科学院长春光学精密机械与物理研究所,吉林长春 130033;2.长春长光辰英生物科学仪器有限公司,吉林长春 130033)
微生物是地球上最多样化和最丰富的细胞生命形式[1]。培养法是最常见的微生物研究方法,但自然界中99%微生物难以被培养,且脱离了原始生活环境,也很难反映其真实的生态功能[2-3]。
目前微生物研究主要通过宏基因组学来进行[4-5],此方法可以揭示微生物多样性并发现新基因,但无法区分、验证单个细胞的生态功能[6]。单细胞技术能够可逐一表征微生物在其原生群落中的特性,建立表型与基因型的关联,为微生物研究提供新思路[3,7]。
单细胞技术包括特征细胞的识别、单细胞分选以及单细胞测序等分析过程。
单细胞拉曼光谱作为一种非标记、原位的识别方法,能够表征细胞的核酸、蛋白质、脂肪等代谢物质的组成与含量,并依据这些细胞固有生化信息来区分不同种属的微生物。传统单细胞分离方法有流式细胞术[8-9]、激光显微切割[10]等,但由于微生物通常尺寸很小,难以使用这些方法实现准确分离[11]。基于激光与物质相互作用原理的细胞分离技术具有准确率高、适用性广等特点,适用于微生物单细胞的分选[12]。本文结合拉曼光谱技术与单细胞分选技术,实现对微生物单细胞的非标记识别与精准分选。
本研究选用大肠杆菌、鼠李糖乳酸杆菌、芽孢杆菌、放线菌和稻瘟菌等常见的微生物菌株,在单细胞水平上进行多种微生物拉曼光谱的检测,采用聚类分析算法,实现对不同微生物拉曼光谱数据的聚类分析,并应用单细胞分选技术成功将大肠杆菌分离出来,用于单细胞基因研究。
1 材料与方法
1.1 材料与试剂
MDA试剂盒(REPLI-g Single Cell Kit, Qiagen);TaqDNA聚合酶(2×EasyTaq® PCR SuperMix,北京全式金生物);微生物培养基(Luria-Bertani液体培养基,索莱宝);单细胞分选芯片(Sorting Chip,长春长光辰英生物科学仪器有限公司);生物共聚焦拉曼光谱仪(HOOKE P300,长春长光辰英生物科学仪器有限公司)。
1.2 微生物的培养与制备
取过夜培养的细胞悬液,将其稀释至合适浓度,滴加至单细胞分选芯片上。
1.3 微生物拉曼光谱分析
通过生物共聚焦拉曼光谱仪获得拉曼光谱,选用532 nm激光器,检测功率为5 mW,积分时间为3 s。
1.4 目标微生物单细胞分选
将芯片及接收器分别放在载物台与接收装置中,调节物镜聚焦至样品面,根据微生物的拉曼图谱信息分选目标细胞至接收器。离心将液体转移至无菌PCR管中。
1.5 单细胞基因组扩增
按照REPLI-g Single Cell Kit操作流程完成基因组扩增。具体方法为:向4 μL细胞悬液中加入3 μL裂解液,65 ℃孵育10 min,向反应管中依次加入3 μL终止液与40 μL扩增反应液(9 μL H2O,29 μL Reaction Buffer,2 μL DNA Polymerase),30 ℃孵育8~12 h,65 ℃孵育 3 min,使酶失活。
1.6 微生物鉴定
选取16s rRNA通用引物27F、1492R,使用TaqDNA Polymerase对全基组扩增产物进行PCR鉴定。
2 结果
2.1 微生物单细胞的拉曼光谱检测与分析
选取9种微生物培养过夜后制片,应用拉曼光谱仪检测每种菌的单细胞拉曼光谱,结果见图1。对全部原始拉曼光谱数据进行去除宇宙射线、消除光谱基线漂移、去除光谱背景噪音、对特定峰位进行归一化等处理。应用无监督学习策略对拉曼光谱数据进行聚类分析,根据定义在特征空间的距离来度量不同拉曼光谱数据的相似性,把相异性的拉曼光谱数据分类到不同的簇中,观察每一簇数据的特征,实现基于拉曼光谱的微生物种类鉴别。
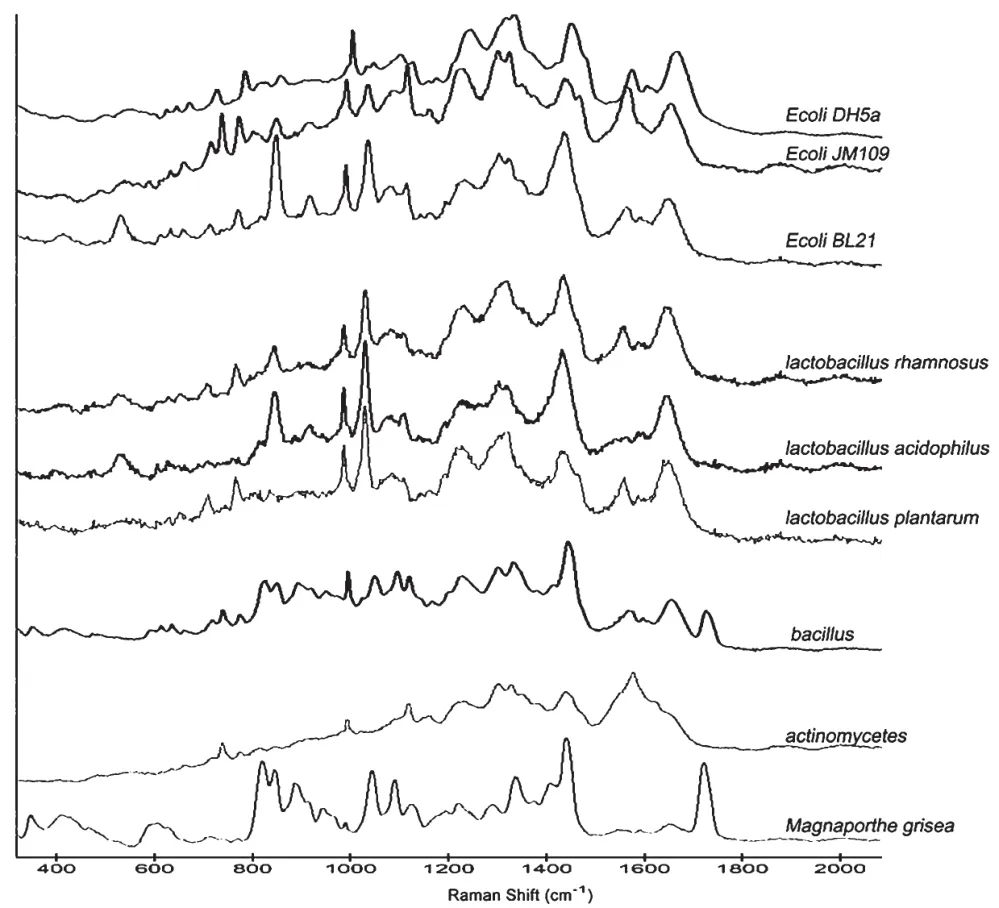
图1 9种微生物的拉曼光谱图
2.2 大肠杆菌的分选
通过对拉曼光谱的分析,确定大肠杆菌的特征图谱,识别样品中的大肠杆菌,应用单细胞分选仪,将大肠杆菌单细胞从分选芯片上分离至接收器中,以此来获得大肠杆菌。如图2所示,分选前,在芯片上可以清晰地观察到微生物单细胞,经过细胞分离操作,目标菌从芯片上消失,被分选至接收器,而非目标细胞保持不变。

图2 单细胞分选仪分选大肠杆菌
2.3 分选细胞鉴定
由于单个微生物细胞的基因组含量非常低,达不到基因检测对样品量的需求。为了实现单细胞的基因信息分析,我们使用多重置换扩增技术(MDA)对分选得到的单细胞进行全基因组扩增,获得目标微生物单细胞的全基因组产物。随后以全基因组扩增产物为模板,进行细菌的16s rRNA PCR扩增,琼脂糖电泳结果见图3。如图3所示,分选细胞的16s rRNA PCR为阳性,证明此全基因组产物是细菌的基因组;而对照组无条带,说明分选和扩增过程中无外源微生物或基因污染。将此16s rRNA扩增产物进行测序,鉴定如图4所示,证明此分选细胞为大肠杆菌。
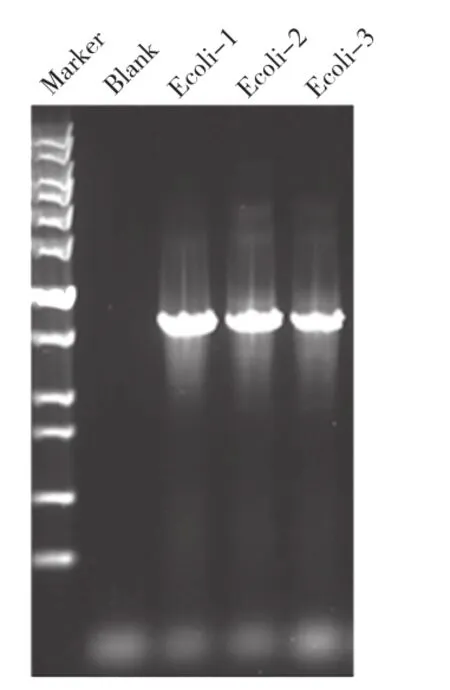
图3 DNA琼脂糖电泳鉴定16S PCR分选接收样品
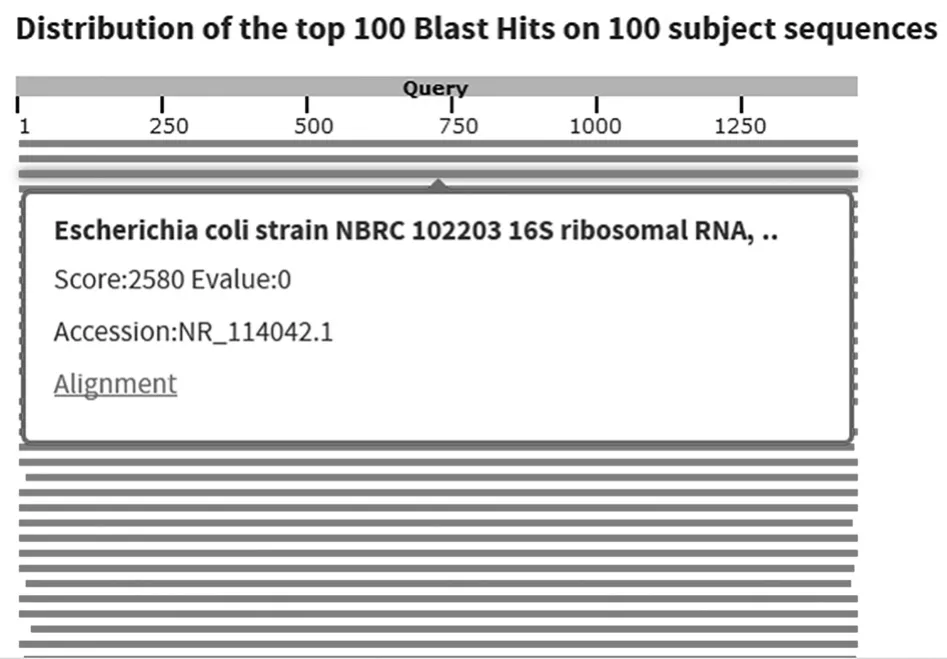
图4 PCR产物测序结果比对
3 结论
选用实验室最常用的大肠杆菌作为研究对象,利用单细胞拉曼分选,经过微生物拉曼检测、微生物单细胞分选、单细胞扩增及测序鉴定这3个步骤,成功从复杂样品中分离出了目标微生物,证明了应用单细胞分选技术在微生物识别与分离鉴定应用方面的可行性。本研究使用的单细胞分选技术可以完成1~20 μm大小的微生物分选,该方法为未知标记方法及难以培养的微生物的研究提供了可能。相比于宏基因组学方法,该方法可以得到期望的细胞个体乃至特定的细胞群体,并能够明确对应细胞的基因型,这有助于对其状态、内部通路和特殊功能的研究。
