心力衰竭老年患者肾功能不全的预后指标分析△
2020-05-17高晓丽刘英华张小坤崔慎情刘亚宁王健兵顾爱峰于成娟
高晓丽,刘英华,张小坤,崔慎情,谢 明,刘亚宁,王健兵,顾爱峰,于成娟
(华北石油管理局总医院心内科,河北任丘 062550)
慢性心力衰竭是各种心血管疾病的终末阶段,其病死率是一般人群的4~8倍。伴随着心力衰竭发病率的逐年增高,早期肾功能不全的发病率也显著增加[1]。与中青年患者相比,老年心力衰竭患者的临床症状表现多样化,因此临床诊治比较困难[2]。而随着年龄的增长,老年人肾脏、心脏的结构和功能均会发生改变[3]。心力衰竭患者心肌细胞逐渐萎缩,肾血流量下降,肾小球数量减少,肾脏间质纤维化增加,从而导致肾脏功能减退[4]。以往临床常用肾小球滤过率(glomerular filtration rate,GFR)、血肌酐(serum creatinine,SCr)来评估肾脏功能,但是受年龄、性别等因素的影响比较大,难以反映肾功能的早期损害。半胱氨酸蛋白酶抑制剂——胱抑素C(cystatin C,CysC)可由肾小球滤过,参与了机体内的炎症过程[5]。肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6、IL-8等相关细胞因子可直接或间接影响心力衰竭的发生、发展,其能够减弱心肌收缩力、诱导凋亡和坏死、促进心室重构[6]。现代研究表明IL-23通路可能是心血管疾病发病的重要免疫应答通路,在心血管疾病发病中可能处于重要地位[7-8]。本研究以老年心力衰竭患者作为研究对象,探讨了CysC、氨基末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)、TNF-α、IL-1β、IL-6、IL-8、IL-23对合并早期肾功能不全老年心力衰竭患者预后的影响,以期更进一步认识肾功能不全与心力衰竭之间的内在联系。现报道如下。
1 资料和方法
1.1 一般资料
回顾性分析2014年2月到2016年6月在华北石油管理局总医院心内科住院诊治的老年心力衰竭患者112例的临床资料。纳入标准:(1)患者年龄60~80岁;(2)患者在自愿条件下签署知情同意书;(3)符合心力衰竭的诊断标准,心功能分级为纽约心脏协会心功能Ⅱ~Ⅲ级;(4)临床与随访资料完整;(5)医院伦理委员会批准了此研究。排除标准:(1)近期有外科手术史或创伤史的患者;(2)6个月内进行过冠状动脉血流重建术的患者;(3)恶性肿瘤晚期及血液系统疾病导致贫血的患者;(4)住院时间≤2 d的患者;(5)年龄<60岁的患者;(6)存在内分泌疾病的患者。记录患者入院时GFR,计算患者估计GFR(estimated GFR,eGFR),根据eGFR结果将入选患者分为肾功能正常组(eGFR≥60 mL·min-1·1.73 m-2,n=62)和肾功能不全组(eGFR<60 mL·min-1·1.73 m-2,n=60)。
1.2 观察指标检测方法
所有患者于清晨空腹抽取静脉血50 mL(空腹时间≥10 h),严格消毒后采静脉血3 mL于离心管,3 000 r/min离心10 min(离心半径15 cm),分离出血清置于-80℃冰箱保存。采用胶乳增强免疫比浊法检测CysC浓度,试剂盒由宁波美康生物科技有限公司提供。采用电化学检测法分析患者NT-proBNP浓度,试剂盒由美国雅培公司提供。TNF-α、IL-1β、IL-6、IL-8、IL-23采用酶联免疫吸附试验(ELISA)方法检测,试剂盒由厦门慧嘉生物科技有限公司提供。
1.3 其他指标检测与记录
所有患者入院后给予详细询问病史并进行全面体格检查,详细记录患者的性别、年龄、体质量指数、纽约心脏协会心功能分级、收缩压、舒张压、心率、原发疾病,记录患者脂蛋白、尿素氮、GFR、尿酸、Scr的检测值。所有患者随访调查2年,以患者住院期间及出院后2年内死亡为本研究的主要研究终点,以恶性心律失常、脑卒中、心源性死亡、再次心力衰竭、再发冠状动脉事件等主要不良心血管事件(major adverse cardiovascular events,MACE)为次要研究终点。
1.4 统计学分析
选择SPSS 19.00软件对数据进行分析。计量数据以()表示,采用t检验。计数资料以[n(%)]表示,采用χ2检验。相关性分析采用Spearman检验,检验水准为α=0.05。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较
两组患者的性别、年龄、体质量指数、心功能分级、收缩压、舒张压、心率、原发疾病等比较,差异无统计学意义(P>0.05),见表1和表2。
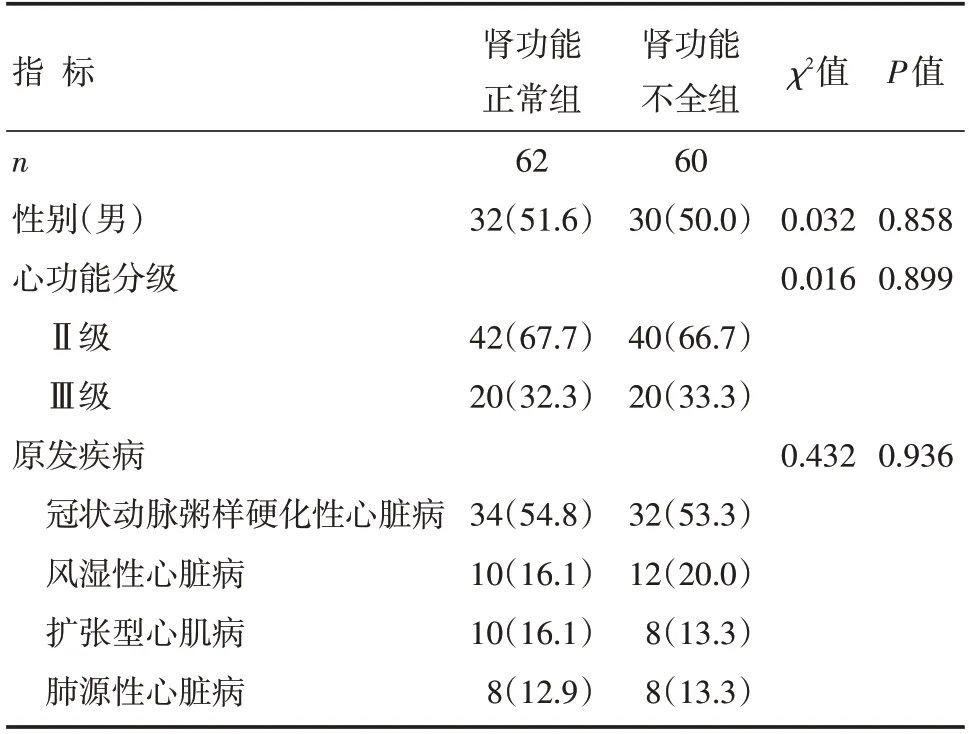
表1 两组患者计数基线资料比较 [n(%)]
表2 两组患者计量基线资料比较 []
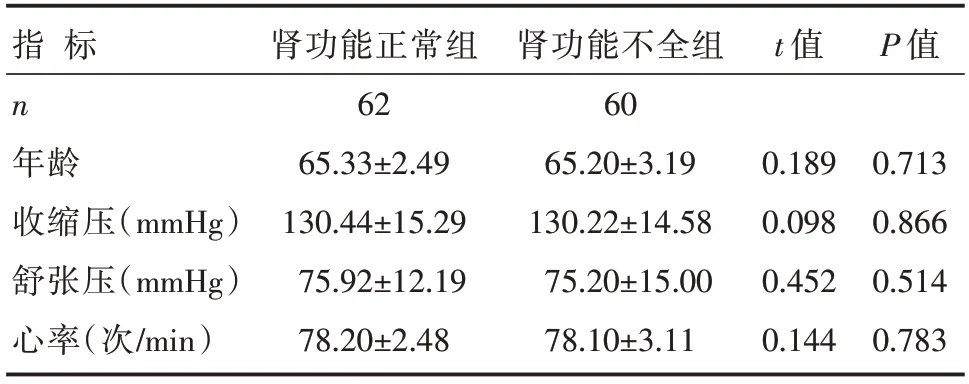
表2 两组患者计量基线资料比较 []
注:1 mmHg=0.133 kPa
2.2 两组患者各观察指标比较
肾功能不全组患者的血清CysC、NT-proBNP、TNF-α、IL-1β、IL-6、IL-8、IL-23浓度显著高于肾功能正常组患者,差异有统计学意义(P<0.05),见表3。
表3 两组患者各观察指标比较 []
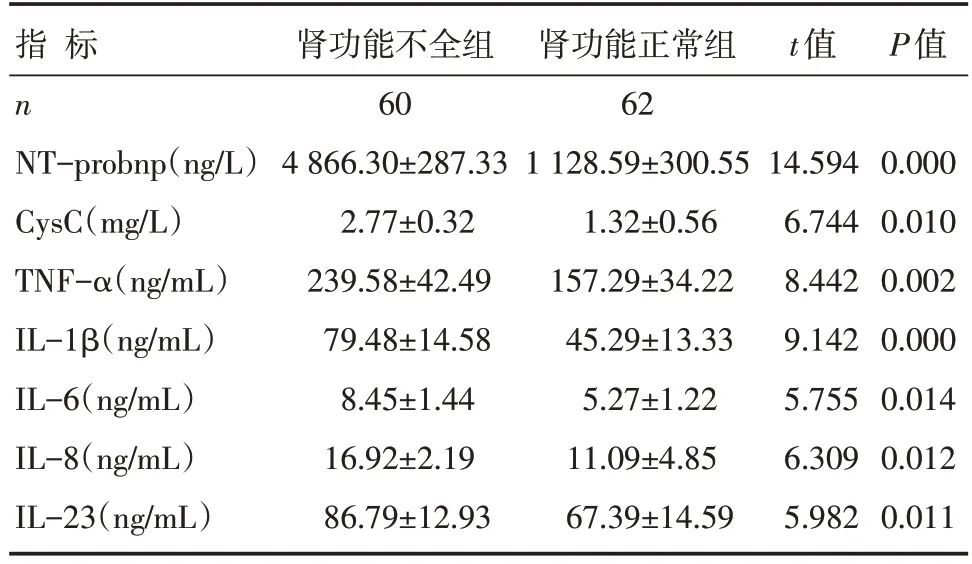
表3 两组患者各观察指标比较 []
2.3 两组患者常规血液学指标比较
肾功能不全组的GFR显著高于肾功能正常组,差异有统计学意义(P<0.05);两组尿酸、尿素氮、Scr、脂蛋白浓度比较,差异无统计学意义(P>0.05),见表4。
2.4 两组患者预后情况比较
肾功能不全组的恶性心律失常、脑卒中、心源性死亡、再次心力衰竭、再发冠状动脉事件等MACE发生率为5.0%,肾功能正常组为24.2%,两组比较差异有统计学意义(P<0.05),见表5。
2.5 相关性分析结果
在肾功能不全组患者中,Spearman检验显示患者MACE与CysC、NT-probnp、TNF-α、IL-1β、IL-6、IL-8、IL-23都有显著正相关性(P<0.05),见表6。
表4 两组患者常规血液学指标比较 []
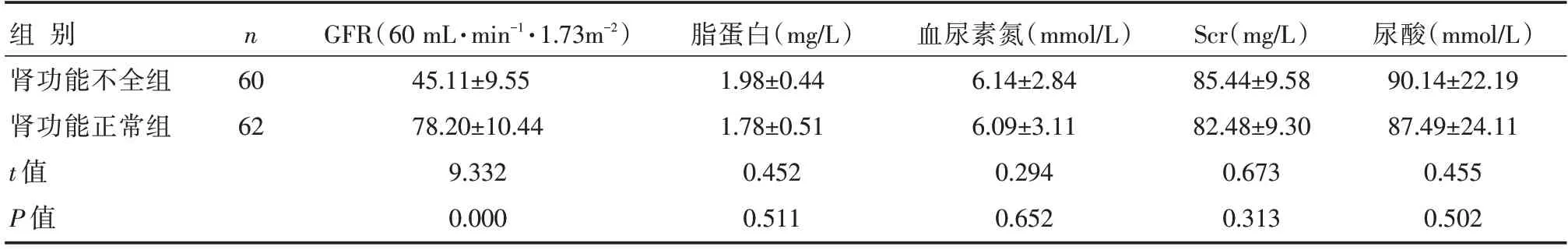
表4 两组患者常规血液学指标比较 []
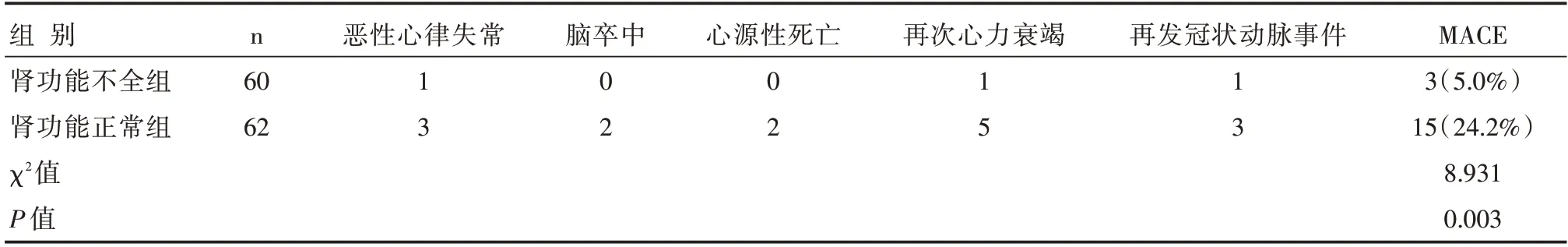
表5 两组患者预后情况比较 (n)

表6 影响肾功能不全组患者预后指标的相关性分析结果 [n=60]
3 讨论
心力衰竭是一系列复杂的临床症候群,是临床上心血管疾病发展到终末阶段的表现。该病在临床上可表现为心绞痛、心肌梗死、心律失常、心源性猝死等,特别是老年患者更易出现心脏结构改变[9]。在老年心力衰竭患者中,动脉粥样硬化可导致外周阻力的增加及心脏后负荷增加,使得肾小球数量减少,肾脏间质纤维化增加,可形成肾功能不全[10]。
本研究显示肾功能不全组患者的血清CysC和NT-proBNP显著高于肾功能正常组患者,差异有统计学意义(P<0.05)。肾功能不全组患者的GFR显著高于肾功能正常组患者,差异有统计学意义(P<0.05)。两组尿酸、血尿素氮、Scr、脂蛋白浓度比较,差异无统计学意义(P>0.05)。CysC作为GFR内源性标志物,被临床广泛用来评价肾功能不全。CysC是一分子量为13.5 kD的低分子量非糖基化碱性蛋白质,由122个氨基酸组成[11]。CysC能够恒定、持续地表达及转录于所有的有核细胞中,保护细胞免受不适当的蛋白酶水解。有研究发现,CysC浓度升高与左心室质量增加显著相关,提示CysC可能参与心室重构[12]。NT-proBNP作为无生物学活性物质唯一的清除途径,其经肾小球滤过,能有效预测患者肾功能情况,有研究显示肾功能不全患者的血清NT-proBNP浓度与血尿素氮、Scr呈正相关[13]。相关研究也表明CysC和NT-proBNP的生理作用涉及抗炎、激素前体、抑制酶的活性等,可作为心血管疾病诊断中的重要分子生物学标志[14]。
炎性细胞因子参与免疫应答、介导炎症反应等。心力衰竭患者外周血或者局部心肌中存在大量的炎症细胞因子能够促进心室重构,减弱心肌收缩力、诱导凋亡和坏死[15]。本研究显示肾功能不全组患者的血清TNF-α、IL-1β、IL-6、IL-8、IL-23浓度显著高于肾功能正常组,差异有统计学意义(P<0.05)。从机制上分析,心力衰竭患者的心肌组织和受损的血管内皮细胞可能产生大量促炎细胞因子,心力衰竭越重,其浓度升高越明显[16]。IL-1β当前被确认为是引起多种自身炎症性疾病的关键原因,当尿酸盐结晶沉积于肾脏时,将会出现IL-1β表达增高,造成肾脏损害[17]。此外,IL-1β可共同参与炎症反应以及血管内皮的损伤、血管平滑肌细胞的增殖,诱发肾功能不全。TNF-α、IL-6、IL-8可激活JAK2/STAT3信号系统,减弱肌质网功能,可刺激促纤维化因子表达,使组织纤维化,产生负性肌力作用。IL-23主要是由被激活的单核巨噬细胞和树突状细胞所分泌,其能刺激炎性反应细胞向病变部位聚集[18]。有研究显示随着肾脏疾病的进展,IL-23免疫通路逐渐失调,自身组织和抗原的免疫耐受逐渐破坏,最终诱发肾功能不全[19]。
肾功能不全是心力衰竭最常见的并发症,尤其是重症心力衰竭者更易并发肾功能不全。本研究显示肾功能不全组患者的恶性心律失常、脑卒中、心源性死亡、再次心力衰竭、再发冠状动脉事件等MACE发生率为5.0%,肾功能正常组为24.2%,两组比较差异有统计学意义(P<0.05)。也有研究显示心力衰竭患者中肾功能不全的发生率为40%左右,心力衰竭合并肾功能不全的患者住院病死率的相对危险度为2.41,1年病死率的相对危险度为1.92[20]。本研究Spearman检验显示,肾功能不全组患者MACE发生与CysC、NT-proBNP、TNF-α、IL-1β、IL-6、IL-8、IL-23浓度都有显著正相关性(P<0.05)。从机制上分析,肾功能不全通常伴随着血压升高、血容量的明显增加,最终引起左心房的扩大[21-22]。NT-proBNP及TNF-α、IL-1β、IL-6、IL-8、IL-23不仅参与了机体许多生理和病理过程,也与多种心血管疾病的发生和发展关系密切[23-24]。促炎细胞因子能够通过不同的机制,使心肌β受体失匹配,促进左心室重构,引起收缩功能障碍,诱发形成肾功能不全,也可增加患者的病死率[23]。同时上述指标的检测不受患者主观影响,更能客观反映患者心功能与肾功能的实际状况,有利于预测[24-25]。
总之,NT-proBNP及TNF-α、IL-1β、IL-6、IL-8、IL-23在合并早期肾功能不全老年心力衰竭患者中呈现高表达,与患者预后状况显著相关,对肾功能不全合并心力衰竭患者的临床诊断有着重大意义。