体外循环下冠状动脉旁路移植术后患者发生低心排血量综合征危险因素分析△
2020-05-17刘海渊张成鑫葛圣林
刘海渊,张成鑫,刘 状,李 鑫,葛圣林
(安徽医科大学第一附属医院心脏大血管外科,合肥 230022)
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)主要病因在于冠状动脉因粥样硬化导致管腔狭窄或闭塞进而引发心肌缺血、缺氧,继而诱发一系列临床症状,如胸痛、呼吸困难、活动受限等。目前,CHD在临床层面主要分为两类综合征,即慢性心肌缺血综合征和急性冠状动脉综合征(ACS)。CHD在我国的发病率呈现逐年上升趋势,根据2016年报道,我国城市地区CHD患病率为1.2%,农村为0.8%,城乡合计为1%[1]。冠状动脉旁路移植(coronary artery bypass grafting,CABG)术是当前治疗CHD的主要外科手段,通过血管的移植减轻心肌缺血,缓解临床症状并能够改善患者的预后。然而,CABG的风险相对较高,术后可能出现心脏以及其他脏器功能不全甚至衰竭的不良事件,因此,此类患者在围术期的风险管控意义尤为重要。低心排血量综合征(low cardiac output syndrome,LCOS)是CABG术后常见且严重的并发症,同时也是导致患者死亡的重要原因[2]。本研究通过对310例CHD患者的临床资料进行回顾性分析,探讨CHD患者CABG术后发生LCOS的独立危险因素,现报道如下。
1 资料和方法
1.1 一般资料
选取2005年6月至2017年6月于安徽医科大学第一附属医院心脏大血管外科行CABG术的310例CHD患者,其中男163例,年龄(56.6±13.4)岁;女147例,年龄(55.4±9.2)岁。患者均取胸部正中切口,在全身麻醉中、低温体外循环(cardiopulmonary bypass,CPB)下行CABG术。其中,原发性高血压(高血压)患者146例,糖尿病患者12例,脑梗死患者11例,既往行经皮冠状动脉介入(PCI)治疗患者19例。术后并发LCOS的患者归为LCOS组,未并发LCOS的患者归为对照组。所有患者术前均经冠状动脉造影(CAG)确诊CHD且均符合CABG术适应证。由于合并瓣膜置换术患者在围术期的治疗和预后存在差异性,因此本研究将CABG术联合瓣膜置换术的患者排除。LCOS的诊断标准[3]包括心脏指数<2.0 L/(min·m2)、平均动脉压<60 mmHg(1 mmHg=0.133 kPa)、心率>90/min、尿量<1 mL/(kg·h)、pH<7.4而乳酸>3.0 mmol/L、混合静脉血氧饱和度<65%伴有皮肤苍白、潮湿、末梢湿冷和低氧血症。
1.2 研究方法
对患者术前及术中的临床资料进行统计分析,术前资料包括性别、年龄、并发症(高血压、糖尿病、脑梗死、心律失常)、实验室检查(白蛋白、肌酐、C-反应蛋白、总胆红素、血红蛋白)、病变血管的类型和数量、超声影像学检查[左心室舒张末期内径、左心室射血分数(left ventricular ejection fraction,LVEF)]、既往治疗史(经皮冠状动脉介入治疗)。术中资料包括体外循环(cardiopulmonary bypass,CPB)时间、主动脉阻断时间、手术时间、移植桥血管流量、输入晶体量、输入胶体量、失血量、输血量。同时也记录术后资料,包括乳酸浓度、血管活性药物维持时间、呼吸机辅助时间、重症监护病房住院时间及死亡例数。
1.3 统计学分析
2 结果
2.1 两组患者术前和术中临床资料比较
CABG术后,患者心功能予以持续动态监控调整,并发LCOS患者40例,发生率为12.9%。患者术后死亡6例,LCOS组4例,对照组2例。LCOS组患者死亡原因是心功能衰竭,对照组患者死亡原因是术后感染。两组患者肌酐浓度(P<0.001)、年龄>60岁(P=0.019)、CPB时间>100 min(P=0.009)、移植桥血管流量(P=0.032)、多支血管病变(≥2支)(P=0.003)、既往经皮冠状动脉介入治疗(P=0.001)、术中失血量>800 mL(P=0.036)、心律失常(P=0.000)、LVEF<45%(P=0.000)比较,差异具有统计学意义,是CHD患者行CABG术后并发LCOS的危险因素;而两组患者性别、高血压史、糖尿病史以及脑梗死史患者比例比较,差异无统计学意义(P>0.05),详见表1和表2。
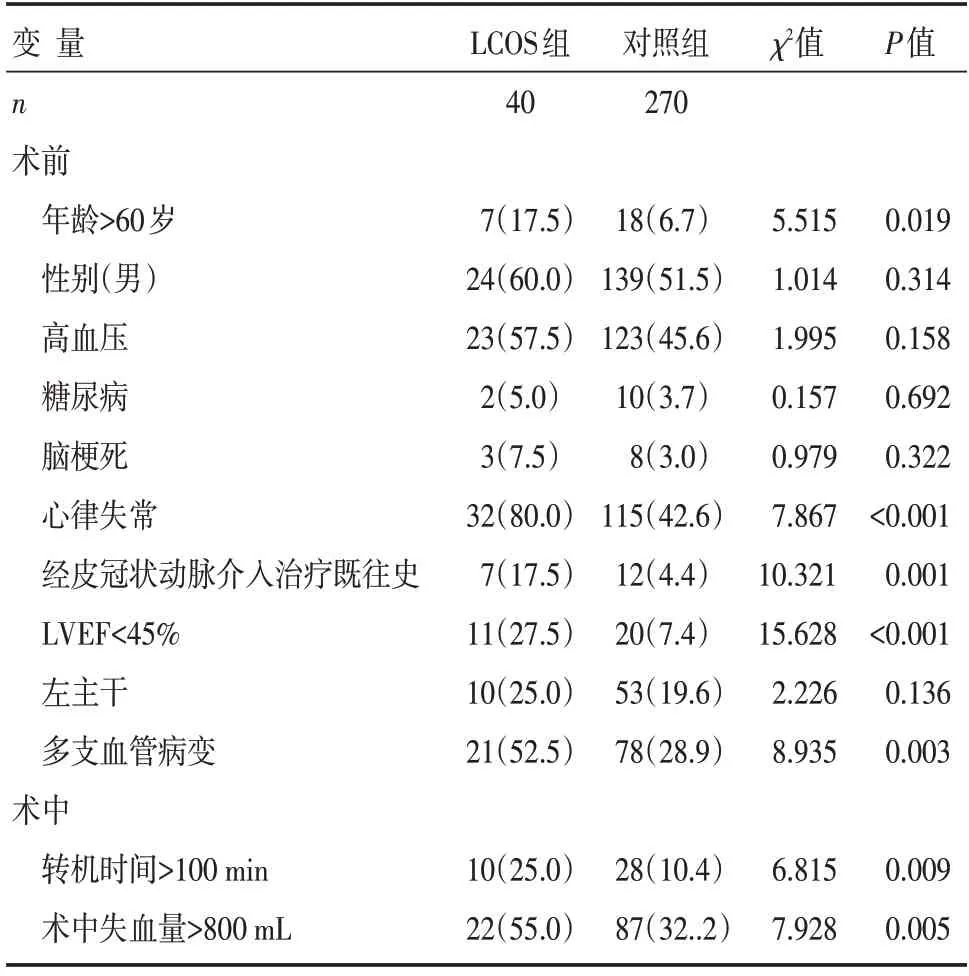
表1 两组患者术前和术中计数临床资料比较 [n(%)]
表2 两组患者术前和术中计量临床资料比较 []
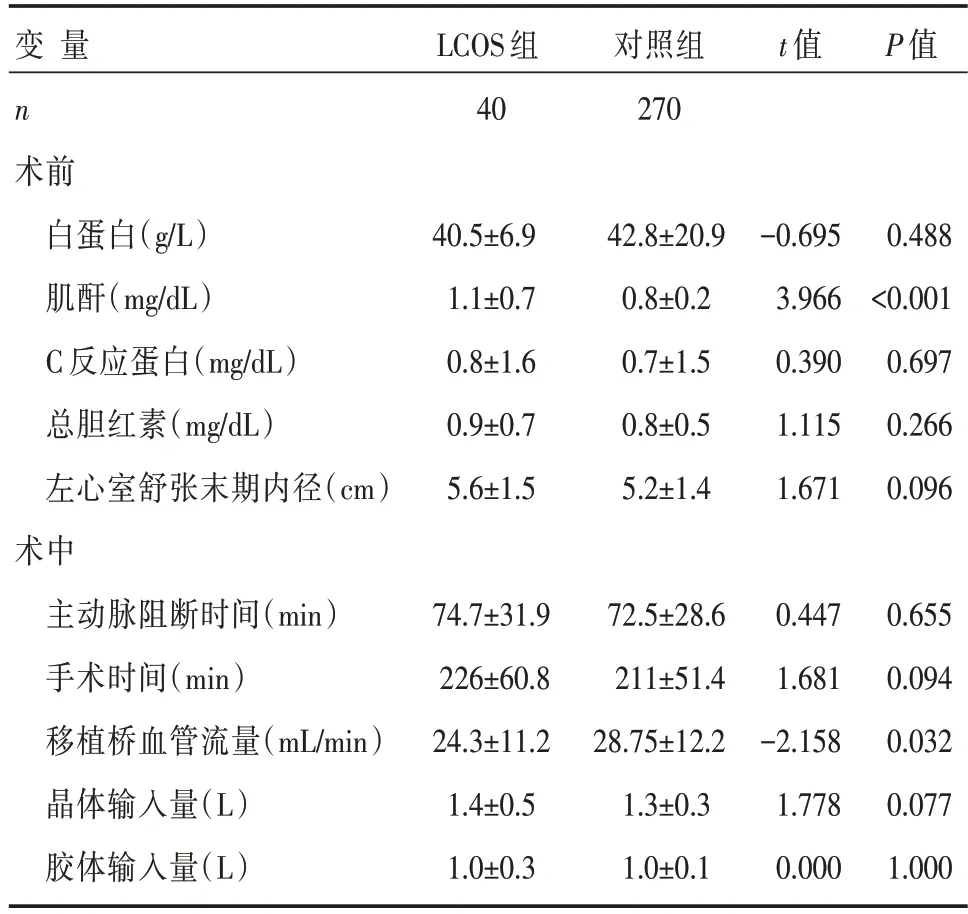
表2 两组患者术前和术中计量临床资料比较 []
2.2 低心排血量综合征风险因素的二分类Logistic回归分析结果
单因素分析中具有统计学差异的指标,即患者心律失常、CPB时间>100 min、术中失血量>800 mL、LVEF<45%、多支血管病变、年龄>60岁、既往经皮冠状动脉介入治疗、肌酐浓度以及移植桥血管流量予以行二分类Logistic回归分析,结果发现,心律失常(P=0.000)、CPB时间>100 min(P=0.016)、术中失血量>800 mL(P=0.036)、LVEF<45%(P=0.000)以及多支血管病变(P=0.002)是CHD患者行CABG术后发生LCOS的独立危险因素,见表3。
2.3 低心排血量综合征对临床预后的影响
两组患者术后乳酸浓度(P<0.001)、血管活性药物维持时间(P<0.001)、呼吸机辅助时间(P<0.001)、重症监护病房时间及病死率(P<0.001)比较,差异均具有统计学意义,见表4。

表3 LCOS风险因素二分类Logistic回归分析结果
表4 两组患者CABG术后LCOS的资料比较 []

表4 两组患者CABG术后LCOS的资料比较 []
3 讨论
CHD起病形式具有多样性,慢性心肌缺血综合征发病较为稳定,呈间断发作,发作频率和治疗疗效相对固定。而急性冠状动脉综合征则是发病急骤,短期内病情急剧恶化,常常提示预后欠佳。由于CHD的特殊性和凶险性,其对于临床诊疗的要求也是极为严苛。CABG术是治疗CHD以及缓解症状、延长患者生存期的有效治疗方式,但是,作为外科手术,CABG术也存在着创伤大、患者恢复慢、术后出现并发症等不利因素。其中,LCOS是导致患者术后死亡的主要并发症,病理特点在于心排血量不足从而继发外周脏器灌注难以维持。因此,对于术后LCOS采取实时必要的防控措施尤为关键。Sunny等[4]在之前的研究中指出,在瓣膜置换的患者术后使用钙离子增敏剂左西孟旦进行心功能的调整能够有效改善LCOS患者的预后。
本研究中,对于310例行CABG术的CHD患者临床资料进行统计学分析,结果发现,术中CPB时间>100 min、术中失血量>800 mL、术前合并心律失常、多支血管病变以及LVEF<45%是患者术后并发LCOS的独立风险因素。所有CHD患者均在CPB辅助下行CABG术,而在CPB过程中,血液经过膜肺、管道、微栓、超滤等人工材料,由于人工材料的独特性质,可能会诱发患者体内免疫系统出现炎性反应导致体内炎性因子水平上调,包括白细胞介素(interleukin,IL)-6、IL-8以及肿瘤坏死因子-α(TNF-α)等,进而造成重要组织脏器,如肾脏的损伤破坏[5-7]。因此,CPB时间与患者的心肌破坏程度之间存在相关性[8-9]。
在CPB辅助时,由于术前晶体和胶体交替预充会造成血液出现稀释。在CABG术中,滚压泵的挤压会进一步加重红细胞的破坏,再者,血液予以肝素化处理使得失血量增加,以上因素联合作用最终造成红细胞数量减少,血液携氧能力下降,机体的氧供平衡被破坏,患者术后并发LCOS的风险明显增加。这与之前的研究结果相似[10]。
CHD发作期间心肌血供不足且钾钙等离子分布失衡导致电生理活动出现紊乱,易诱发心律失常,尤以室性心律失常多见,表现为频发室性期前收缩或室性心动过速。心率的异常变化对于心脏的充盈时间产生不良影响,心率低于40次/min或高于160次/min均会导致心肌氧耗量增加以及心肌收缩力减弱,进而引发组织灌注量不足最终并发LCOS[11]。除术前并发心律失常,术中因桥血管条件不佳、手术操作中搬动心脏、因暴露血管导致房室变形等因素而诱发长时间的心律失常也会导致组织灌注受到影响[12-13]。
LVEF是评价左心功能的可靠指标,同时也是监测LCOS较为敏感的参数。在Kim等[14]的研究中,将老年组(>75岁)行CABG手术的非ST段抬高型心肌梗死患者作为观察组,非老年组(<75岁)的非ST段抬高型心肌梗死患者作为对照组,对两组的临床预后进行比较,结果发现,LVEF≤40%是CABG术后病死率的独立危险因素。Ding等[15]则指出,当多支血管病变且基础LVEF极度低下时(≤40%),经皮冠状动脉介入治疗和CABG均无法显著改善LVEF,而LVEF改善的相关因素分别是左心室舒张末期内径、左心室收缩末期内径、抗凝药物(肝素和氯吡格雷)以及利尿药。药物干预是CABG术后调控LVEF预防LCOS的有效手段。郭艳娟等[16]在CABG术中于桥血管吻合完成时予以米力农持续负荷剂量给药24 h,结果发现,米力农组患者术后心肌缺血和梗死的风险显著降低。赵峰等[17]在麻醉过程中给予右美托咪定0.5~1.0 μg/kg,对于CPB下心肌具有保护作用,可能原因与改善LVEF有关。
冠状动脉系统分支复杂,密集广泛分布于心脏表面,左主干、前降支、回旋支等主要血管承担心脏的血供功能。而完善的侧支系统能够在冠状动脉血管病变时充分发挥代偿作用,缓解病变所致的心肌损伤效应。而多支血管病变时心肌累及范围广,心肌组织受损严重且心功能恢复困难,其中,左主干、前降支作为心肌的主要血供来源,其发生病变对于心肌造成的不良影响尤为显著。本研究结果显示,合并多支冠状动脉血管病变是CABG术后并发LCOS的危险独立因素,LCOS组患者中术前经冠状动脉造影确诊均存在左主干或前降支血管的严重病变。但是在单因素分析中左主干病变则并未发现具有统计学意义,原因可能在于样本量的限制。作为冠状动脉系统重要的组成部分,左主干的狭窄程度是冠状动脉病变的重要评估指标,超过50%对于CHD的预后具有意义[18]。而在无保护左主干病变的研究中,相比较于CABG,经皮冠状动脉介入治疗意义更为显著[19]。对于前降支病变的观察中可见,乳内动脉血管桥与其近端的狭窄程度之间存在相关性,这与之前在非CPB-CABG中的研究结果相似[20]。侧支循环的状态对于前降支病变的改善具有积极的作用,在经皮冠状动脉介入治疗中,侧支循环良好的患者术后心功能的恢复更为理想[21]。
此外,还需要指出的是,移植桥血管的流量测定对于评估CABG术患者心功能的预后也是至关重要的。即时血流测定技术(TTFM)由于操作简单且测试精确的优势被广泛用于移植血管的血流通畅性评估[22]。移植桥血管流量不足可能会导致心肌灌注不足,从而影响心肌的生理代谢功能甚至导致LCOS。在远期预后评估中,心功能不全以及心源性并发症的发病率均具有潜在的上升趋势。在本研究中发现,LCOS组患者中的移植桥血管流量为(24.3±11.2)mL/min,而对照组患者中的桥血管流量为(28.75±12.2)mL/min,两者在单因素分析的对比中具有显著统计学意义(P<0.05)。但是,在回归分析中却并未见统计学意义,分析原因可能在于两组中流量的均值水平相似。在当前的CABG术中,移植桥血管的主要来源分别为乳内动脉和大隐静脉。两者流量评估的有效安全阈值分别为20 mL/min和30~40 mL/min[23]。结合国人自身的生理特点和发病机制,乳内动脉和大隐静脉的理想流量分别为22 mL/min和35 mL/min,而安全阈值分别为10 mL/min和15 mL/min[24-25]。近年来,非CPB-CABG手术技术日趋完善,相比较于CPB-CABG手术,非CPB-CABG冠状动脉移植血管的流量水平偏低,尤以前降支为甚,但是两者术后早期的心功能评估无显著差异[26]。
本研究中尚存在缺陷和不足。首先,样本量相对较小可能会对于结果产生偏差。其次,尽管术后指标作为LCOS的重要参考予以分析并得出有意义的结果,但并未明确LCOS和指标因素之间的因果联系。
综上所述,术中CPB时间>100 min、术中失血量>800 mL、术前合并心律失常、合并多支冠状动脉血管病变以及LVEF<45%是CHD患者行CABG术后并发LCOS的独立危险因素。在未来的研究中,将重点开展针对危险因素的防控措施并探讨术后变量对于LCOS的影响。