延胡索中叔胺碱和季铵碱类组分的高效分离及镇痛活性鉴定
2020-05-16高振华王超然郭秀洁王纪霞郭志谋王联芝
高振华,王超然,郭秀洁,王纪霞,郭志谋,王联芝
1湖北民族大学,恩施 44500;2中国科学院大连化学物理研究所,大连 116023;3中科院大化所中国医药城生物医药创新研究院,泰州 225300
延胡索为罂粟科紫堇属植物延胡索CorydalisyanhusuoW.T.Wang的干燥块茎,别名元胡、延胡、玄胡索、元胡索等,是传统的“浙八味”之一[1,2]。作为一味应用历史悠久的活血、行气、止痛中药,其疗效一直为历代医家推崇,目前也仍广泛应用于治疗心律失常、气虚瘀滞、胸痹心痛、脘腹疼痛、产后瘀滞腹痛、跌打损伤等,是中药复方制剂中的常用药[3,4]。
现代研究表明,延胡索中主要活性成分为生物碱,其中以叔胺型的原小檗碱类和季铵型的小檗碱类含量最高,占比可分别达到0.65%和0.3%左右[5-7]。这两类成分骨架结构非常类似,但生物学效应大不相同。药理学研究表明,延胡索的镇痛、镇静、催眠和安定等作用主要与水溶性极差的叔胺型生物碱相关[8,9],其中以乙素、丑素最强,甲素次之,虽然都比吗啡弱,但其作用受体为多巴胺受体,没有成瘾性缺陷,耐药性也优于吗啡。相比之下,延胡索中的季铵碱成分,在镇痛方面发现较少,但在抗心肌缺血、较少心肌耗氧等方面具有更显著的作用[10-12]。
延胡索中叔胺碱和季铵碱的不同作用靶点和功效,提示了分别以叔胺碱和季铵碱类组分开发活性部位制剂将使药效作用机制更加清晰,在治疗具体疾病时更有针对性,具有中药5类新药的开发前景,而目前对延胡索作用机制和制剂产品的研究仍主要以总碱为主[13,14],成分较复杂,往往难以有效阐明疗效物质基础。也有部分研究工作采用树脂层析或酸碱萃取的方式,得到了延胡索叔胺碱或季铵碱的组分,但总体工艺稳定性较差,酸碱废液量大,难以符合现代的环保生产要求,得到的组分纯度也不高[15,16]。在前期分离纯化延胡索生物碱单体的过程中,我们也发现这两类成分在色谱填料上的色谱峰形和保留行为具有很大差异,将其采用C18WCX实现类组分分离后,分别采用C18和C18SCX来制备叔胺碱和季铵碱单体,可以使两类成分在不同的分离方法中获得良好的色谱峰形和载样量,从而降低纯化制备的难度[17]。因此,发展高效的延胡索生物碱类组分制备方法,不仅对延胡索类组分制剂的开发具有重要作用,对生物碱单体的制备,深入研究延胡索的组成成分也能带来很大的便利。
为克服使用C18WCX填料进行类组分制备过程中载样量不易控制,填料比较小众不易产业化等缺点,本文采用普通C18填料,利用延胡索叔胺碱和季铵碱在不同pH值条件下电荷性质不同的特点,发展了一种更为简便易行的延胡索类组分高效制备方法,并对得到的两类组分进行了生物碱含量测定和多巴胺D2受体拮抗活性的验证,结果显示,两类成分在新方法中得到了有效分离,且类组分的生物碱含量以已知对照品计分别达到了84.0%和60.7%,符合有效部位中药制剂的开发要求,延胡索提取物的多巴胺D2受体拮抗活性也集中在了叔胺碱组分中,可为相应的类组分新药制剂开发奠定基础。
1 材料与方法
1.1 仪器、试剂与材料
实验仪器:Alliance e2695高效液相色谱仪(美国Waters公司)包括自动进样器,2695型分离单元,柱温箱系统,2996型光电二极管阵列检测器和 Empower 色谱工作站。YJD20D-GL十功能自动煎药机(北京东华原医疗设备有限责任公司)、LX-0400型20 L旋转蒸发仪(上海申胜生物技术有限公司)、CeraMem0100-015型500 nm陶瓷膜(厦门福美科技有限公司)、DAC-50动态轴向压缩柱(江苏汉邦科技有限公司)、PUERLAB Chorus实验室纯水机(英国ELGA公司)、FLIPR Tetra 高通量实时荧光检测分析系统(美国Molecular Devices公司)、SCIENTZ-10N冷冻干燥机(宁波新芝生物科技股份有限公司)。
使用的色谱柱:Kromasil 100-5-C18柱(4.6×150 mm,5 μm,Kromasil,瑞典);C18柱(4.6×250 mm,10 μm,大连思谱,大连)。
延胡索药材样品(产自浙江金华)。乙腈、乙醇、醋酸、醋酸铵均为分析纯(购自上海国药集团化学试剂有限公司)、多巴胺、氟哌啶醇(购自梯希爱上海仁成工业发展有限公司)、制备乙醇(购自上海星可高纯溶剂有限公司)。所使用的对照品(1∶1,3-甲基去氢紫堇达明碱;2:去氢紫堇球碱;3:巴马汀;4:去氢紫堇碱;5:海罂粟碱;6:延胡索乙素;7:延胡索甲素.)均为实验室自制,HPLC检测纯度为95%以上。制备实验所使用的C18填料购自大连思谱精工有限公司,粒径10 μm,孔径10 nm。固相萃取实验所使用的C18CEX填料购自大连思谱精工有限公司,粒径40 μm,孔径10 nm。
1.2 实验过程
1.2.1 延胡索生物碱提取物制备
取延胡索干燥样品500 g,放入十功能自动煎药机,第一次提取加入70%乙醇水溶液5 L,提取温度80 ℃,沸腾后煎煮60 min,第二次提取加入70%乙醇水溶液5 L,温度80 ℃,沸腾后煎煮40 min,合并两次提取液。用20 L旋转蒸发仪进行浓缩去除乙醇至1.6 L后,使用500 nm陶瓷膜进行澄清过滤,收集透过液,至循环端液体体积降低至200~300 mL后,加0.8 L纯化水进行洗滤,合并膜透过液,得到延胡索澄清透过液1.80 L,旋蒸浓缩至180 mL,取2.0 mL样品冻干得固体0.245 g,测得其固含量为122.5 g/L,总提物为22.05 g。
1.2.2 延胡索生物碱提取物样品分析和类组分制备方法开发
样品分析:Kromasil 100-5-C18(5 μm,4.6×150 mm)色谱柱,流动相A相为乙腈,B相为0.1%磷酸(三乙胺调节pH值至6.0)或0.1 mol/L醋酸铵(加醋酸调节pH值为6.0、6.5、6.8),C相为纯水,梯度洗脱条件:0~20 min,23% A;20~30 min,23%→55% A;30~50 min,55% A;B相固定20%。检测波长280 nm,流速1 mL/min,进样量10 μL,柱温30 ℃。
类组分制备方法开发:C18(10 μm,4.6×250 mm)色谱柱,流动相A为乙醇,B为20 mmol醋酸铵(pH值为6.8),梯度洗脱条件:0~20 min,23% A;20~30 min,23%←55% A;30~50 min,55% A。台阶等度洗脱条件:0~30 min,23%A;30~30.1 min,23%~55%A;30.1~50 min,55%A。检测波长280 nm,流速0.6 mL/min,进样量10 μL,柱温30 ℃。
1.2.3 延胡索类组分制备
制备柱为DAC-50 mm动态轴向压缩柱,填装C18(10 μm,大连思谱,大连)填料300 g,流动相A为乙醇,B为20 mmol醋酸铵(pH值为6.8),梯度洗脱条件:0~30 min,23%A;30~30.1 min,23%→55%A;30.1~50 min,55%A。检测波长280 nm,流速70 mL/min。
1.2.4 延胡索类组分含量测定
对照品溶液的配制:使用十万分之一天平,准确称取延胡索乙素、延胡索甲素和海罂粟碱各10 mg,使用含0.1%甲酸的50%甲醇进行溶解,配制成一系列梯度的叔胺碱混合对照品溶液,另称取去氢紫堇碱、巴马汀、去氢紫堇球碱、1,3-甲基去氢紫堇达明碱各10 mg,使用含0.1%甲酸的50%甲醇进行溶解,配制成一系列梯度的季铵碱混合对照品溶液。以混合对照品的浓度为横坐标、峰面积为纵坐标建立标准曲线。结果表明,叔胺碱混合标准品在3.2~2 000 mg/mL范围内线性关系良好,线性相关系数(r2)均大于0.999 7,季铵碱混合标准品在40~1 000 mg/mL范围内线性关系良好,线性相关系数(r2)均大于0.999 9。
延胡索类组分供试品制备:称取类组分制备得到的叔胺碱和季铵碱类组分冻干粉末各10 mg,使用50%甲醇水溶液超声溶解后于10 mL容量瓶中定容,配置成1 mg/mL的叔胺碱及季铵碱类组分供试品溶液。
1.2.5 镇痛活性测试实验条件
将延胡索提取物及类组分样品取样,在表达多巴胺D2受体的细胞人胚肾293T细胞(HEK293T)上,采用FLIPR(Fluorometric Imaging Plate Reader,Molecular Device Corp)进行活性筛选,样品终浓度为50 μg/mL。以每孔80 000个细胞接种于用poly-D-lysine涂层的96孔细胞培养板中,24 h后除去培养基并于每孔中加入100 μL荧光染料溶液(calcium-6)在37 °C下恒温1 h时,除去染料溶液并于每孔加入100 μL 0.5% amaranth,将待测样品用二甲基亚砜(DMSO)溶解后置于96孔板中,采用FLIPR进行自动加样与细胞培养板中孵育10 min后在520和488 nm波长下进行荧光检测从而对细胞内的Ca2+浓度进行监测。
2 结果与讨论
2.1 延胡索提取物样品分析
参考文献方法[18,19],我们首先以乙腈和磷酸三乙胺缓冲盐(pH 6.0)为流动相对延胡索提取物进行了分析。结果如图2a所示,延胡索主要生物碱成分都得到了较好的分离,20 min以后峰色谱峰峰形良好,但5~20 min区域的色谱峰均较拖尾。通过DAD检测器的色谱峰紫外光谱图分析可知(如图3所示),峰1~6均具有季铵型小檗碱类生物碱的特征吸收,而峰8~12均为叔胺型原小檗碱类生物碱的特征吸收,峰7为海罂粟碱为阿朴啡类生物碱的特征吸收。通过与实验室前期自制的标品对比,2、3、4、6号峰分别为1,3-甲基去氢紫堇达明碱、去氢紫堇球碱、巴马汀、去氢紫堇碱(均为季铵碱),峰9、12分别为延胡索乙素、延胡索甲素,峰7为海罂粟碱(均为叔胺碱),也证实两类成分在接近中性的流动相体系下,色谱保留时间存在较大差异,能够实现两类组分的良好分离。在该pH条件下,碱性较弱的叔胺碱电离已经得到大部分抑制,主要呈分子态,保留较强,色谱峰形也较好,而季铵碱永久带电荷,呈离子状态,因而保留总体弱于叔胺碱。
磷酸三乙胺不易挥发,且在后续工业生产中无法用膜分离回收套用,为便于后续的液质联用分析和工业化制备应用,我们尝试用中性的醋酸铵代替磷酸三乙胺。如图2b所示,0.1 mol/L 醋酸铵(pH 6.8)条件下,叔胺碱与季铵碱同样可以实现良好的分离,且具有镇痛活性的海罂粟碱与叔胺碱更为接近,可将其归入叔胺碱类组分。但海罂粟碱与8号峰的保留过于接近,不利于含量分析,经pH微调,发现pH为6.5时,7号峰海罂粟碱能与周边峰得到更好的分离,故选择pH6.5为分析条件,而在类组分制备时可选择pH6.8。
2.2 延胡索类组分制备方法开发与组分制备
在传统方法中,常使用大孔吸附树脂对延胡索生物碱成分纯化分离,但是大孔吸附树脂对溶剂需求量大,样品分离过程缓慢,且大孔吸附树脂再生复杂,不适合大量样品的分离制备[20]。制备色谱通常使用10 μm以上的填料,且优先使用甲醇、乙醇等易于纳滤回收且价格相对低廉的有机溶剂,以节约溶剂的使用成本。本实验采用了10 μm的C18填料,先使用4.6×250 mm的预装柱上进行溶剂和梯度方法考察。通过实验发现,在乙醇/醋酸铵(pH 6.8)体系下,采用相同的梯度条件,延胡索提取物中的季铵碱虽然峰形更为拖尾,但与叔胺碱的类分离由于叔胺碱的保留增强,类分离效果更优(如图4a所示),这也可能是制备填料与分析柱填料选择性略有差异导致。为便于生产制备,将梯度条件简化为23%乙醇和55%乙醇两个台阶梯度,分别用于洗脱季铵碱和叔胺碱。考虑到图4a中20 min 23%的乙醇还不能把季铵洗脱完全,因此把季铵碱的洗脱时间延长到30 min,结果如图4b所示,叔胺碱和季铵碱的分离度进一步扩大。

图1 延胡索中主要的叔胺碱和季铵碱Fig.1 Structures of main tertiary and quaternary alkaloids in Rhizoma Corydalis
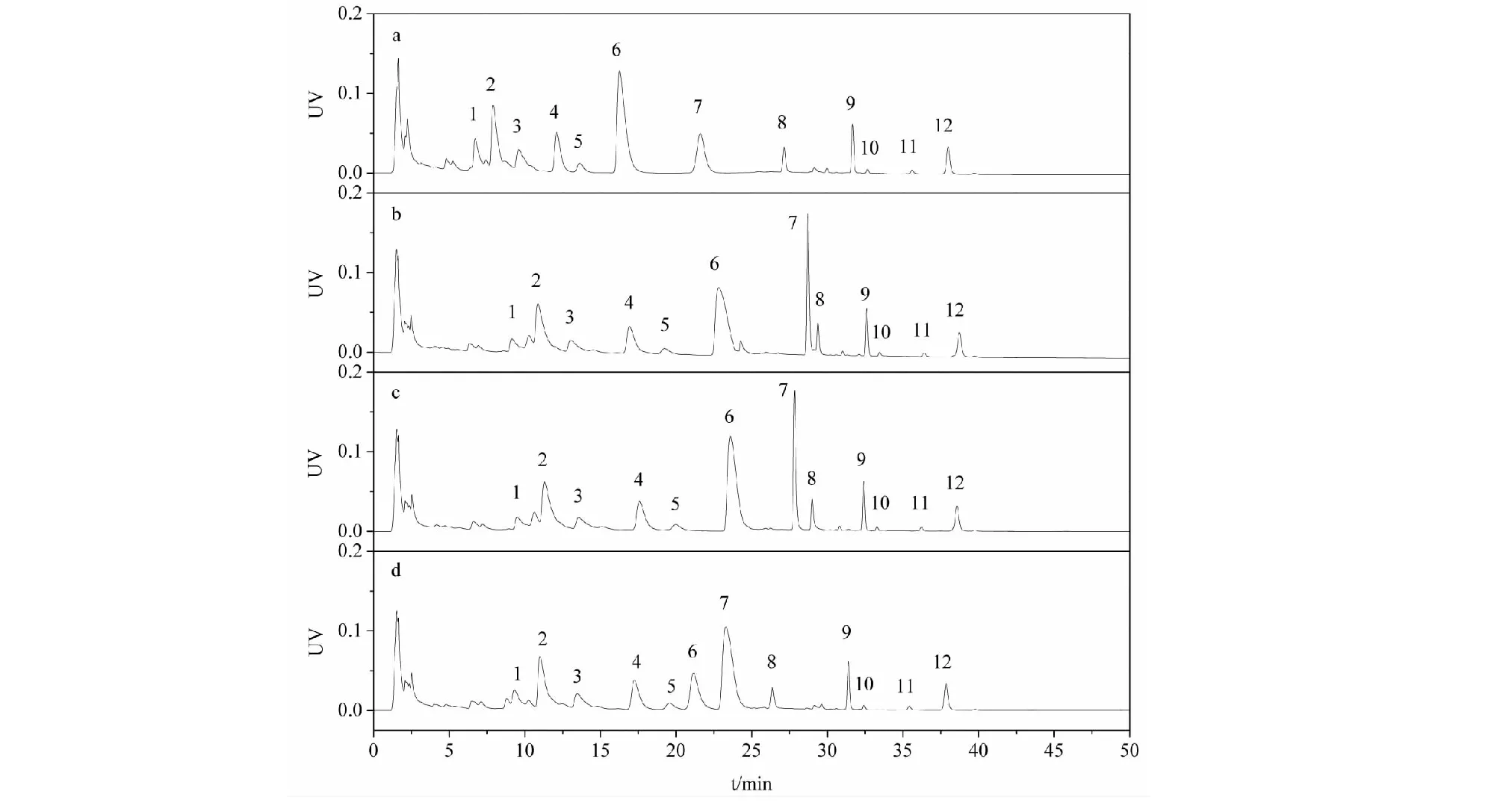
图2 延胡索提取物在不同缓冲盐条件下的分离谱图Fig.2 Separation chromatogram of Rhizoma Corydalis extracts with different buffer salt 注:流动相添加剂:(a)0.1%磷酸三乙胺;(b~d)0.1 mol/L醋酸铵,pH值分别为6.8、6.5、6.0。洗脱梯度(a):0~20 min,23% A;20~30 min,23%→55% A;30~50 min,55% A;洗脱梯度(b~d):0~20 min,23% A;20~30 min,23%→55% A;30~50 min,55% A,缓冲盐相固定20%。色谱峰:叔胺碱:7.海罂粟碱;9.延胡索乙素;12.延胡索甲素;季铵碱:2.1,3-甲基去氢紫堇达明碱;3.去氢紫堇球碱;4.巴马汀;6.去氢紫堇碱。Note:Additives:(a) 0.1% triethylammonium phosphate;(b-d) 0.1 mol/L ammonium acetate with pH at 6.8,6.5,6.0 respectively.gradient(a):0-20 min,23%A;20-30 min,23%→55%A;30-50 min,55%A.gradient(b-d):0-20 min,23%A;20-30 min,23%→55%A;30-50 min,55%A,buffer salt phase fixed at 20%.Peaks:Tertiary alkaloids:7.Glaucine;9.Tetrahydropalmatine;12.Corydaline;Quaternary alkaloids:2.1,3-Methyldehdrocorydalmine;3.Dehydrocorybulbine;4.Palmatine;6.Dehydrocorydaline.

图3 延胡索提取物主要色谱峰的紫外吸收谱图Fig.3 Ultraviolet spectra of main chromatographic peaks of Corydalis extracts

图4 乙醇/醋酸铵体系梯度及台阶等度色谱图Fig.4 Gradient and step equivalent chromatography of ethanol/ammonium acetate system
在选定的流动相条件下,将方法转移至装填有300 g相同C18填料的DAC-50 mm制备柱上进行放大。经简单摸索,样品上样量为80 mL(含固体9.8 g,相当于填料量3.3%)时的制备谱图如图5所示:
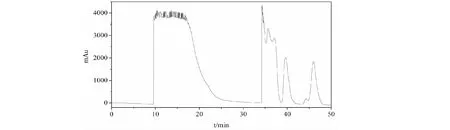
图5 延胡索类组分制备液相色谱图Fig.5 Preparative chromatogram of Rhizoma Corydalis class separation
分别收集10~20 min和34~50 min的馏分,进行HPLC分析,分析结果如图6所示,可以看到两类组分实现了良好的分离,两类生物碱之间无成分交叉。从制备谱图和分析结果看,样品载样量还有比较大的提升空间,但本次实验因为提取物样品量有限,上样量先增加到了填料量的3.3%,在工业化生产过程中样品载样量可以继续增大,适用于大规模样品的生产制备。

图6 制备馏分分析色谱图Fig.6 Analytical chromatograms of preparative fractions
2.3 延胡索类组分的后处理与含量测定
上述制备方法制得的延胡索类组分含有醋酸铵缓冲盐,在工业生产中,可使用纳滤膜浓缩,实现溶剂回收套用,但本次小试的样品量较少,采用固相萃取(SPE)的方式进行同步脱盐和浓缩。实验使用一种耐纯水的亲水性反相填料C18CEX作为SPE固定相,将类组分制备所得馏分经旋蒸浓缩除去乙醇后,分别上样至两个活化平衡好的20 g装SPE柱,水洗3倍柱体积脱盐后,甲醇洗脱,旋蒸,冻干得到固体粉末,其中季铵碱固体粉末0.68 g ,叔胺碱固体粉末1.00 g。
按前述分析方法,以实验室自制的7个已知成分为对照品,建立标准曲线,对所制得的类组分进行含量测定。计算结果显示,在叔胺碱类组分中延胡索乙素含量21.0%,延胡索甲素含量21.0%,海罂粟碱含量42.0%,以该3个主要已知叔胺碱计,叔胺型类组分的生物碱含量达84.0%,而在季铵碱类组分中去氢紫堇碱含量37.0%,巴马汀含量7.7%,去氢紫堇球碱含量5.5%,1,3-甲基去氢紫堇达明碱含量10.5%,以这4种已知对照品计,该类组分种含已知成分的含量达60.7%,两个类组分的已知成分含量总和均超过50%,符合中药有效部位制剂的已知成分含量大于50%的要求。

图7 延胡索类组分含量测定Fig.7 Determination of class components in Rhizoma Corydalis
2.4 延胡索类组分化合物在D2受体上的拮抗作用测试
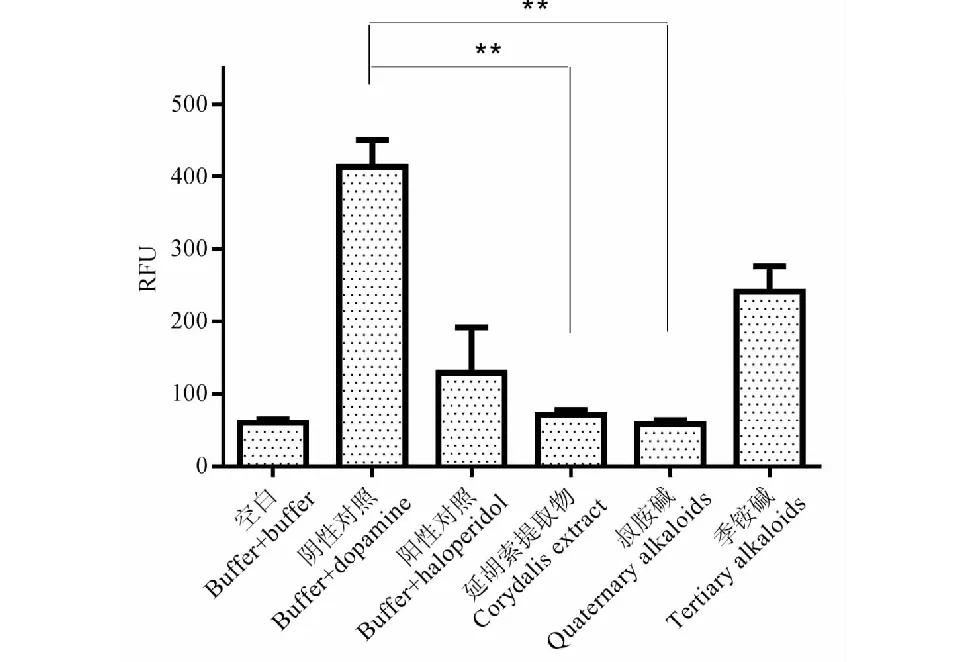
图8 延胡索组分D2受体拮抗活性测试Fig.8 Antagonist activity of Rhizoma Corydalis fractions on D2 receptor注:与阴性对照组(buffer+dopamine)比较,**P < 0.01。Note:Compared with negative control group (buffer+dopamine),**P < 0.01.

图9 不同浓度叔胺碱拮抗活性Fig.9 Antagonistic activity of different concentrations of tertiary alkaloid注:浓度1~3分别为50.00、1.85、0.07 μg/mL。Note:Concentration 1-3 were 50.00,1.85,0.07 μg/mL,respectively.
现代药理学研究表明,延胡索的镇痛、安定作用是通过多巴胺受体系统发挥作用的,尤其是对多巴胺D2受体的拮抗作用[21]。将制备的季铵碱和叔胺碱类组分与延胡索提取物在Fliper实验平台上进行了多巴胺D2拮抗作用的活性对比,结果如图8所示,延胡索提取物对多巴胺D2受体有显著拮抗作用,其作用强度与阴性对照组(dopamine)相比具有显著性差异,且大于阳性对照氟哌啶醇(haloperidol),制备成类组分后,季铵碱类组分的拮抗活性较弱,而叔胺碱的活性强于提取物,这也证明了两类组分在药理活性上的差异。叔胺碱组分在不同浓度下都具有拮抗活性,如图9所示,对叔胺碱样品进行稀释并测定其拮抗活性,结果发现浓度降低至1.85 μg/mL时,叔胺碱组分达到最低抑制浓度,拮抗活性明显,继续降低浓度直至0.07 μg/mL时,拮抗活性明显降低,证明了叔胺碱组分的拮抗活性具有剂量依赖性,这些结果为更有治疗针对性的有效部位制剂开发提供了科学依据。
3 结论
延胡索中叔胺碱和季铵碱两类生物碱在电离状态下保留接近难以区分,但随着流动相pH值升高,叔胺碱的电离更易受到抑制,保留时间显著增强,能与季铵碱组分实现有效分离,从而开发了一种简便的类组分分离方法。通过分离制备得到了两类成分区分明晰、含量较高,且具有不同药理活性的生物碱类组分,通过多巴胺D2受体的拮抗活性测试,也进一步证实延胡索的镇痛相关活性物质主要集中在叔胺碱类组分。这些结果为延胡索生物碱化学成分研究和具有针对性治疗作用的有效部位制剂开发奠定了实验和理论基础。
