Tagitinin D诱导人肝癌HepG2细胞凋亡的作用机制研究
2020-05-16韦睿然陈远志杨杏芝何志旭
杨 珊,韦睿然,陈远志,杨 旭,王 娟,杨杏芝,何志旭*,丁 骁*
1贵州医科大学基础医学院 免疫学教研室组织工程与干细胞中心,贵阳 550004;2中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,昆明 650201
肝癌是临床上最常见的恶性肿瘤之一。近年来,肝癌已成为中国发病率和死亡率较高的癌症,是全球癌症死亡的第三大原因[1,2];肝癌的治疗包括外科手术、介入治疗、化学疗法和肝移植,但治疗效果并不理想[3]。尽管化学疗法极大地提高了患者的生存率,但严重的毒副作用阻碍了抗癌药物的治疗效果[4]。寻找对肿瘤细胞具有抑制作用的天然小分子化合物,是抗癌药物发现的重要来源。
Tagitinin D(图1)属于倍半萜内酯类天然小分子化合物[5],在菊科植物中大量存在。Tagitinin D类化合物具有抗肿瘤[6]、细胞毒性[7]、抗炎[8]、抗菌[9]、抗真菌[10]特性。据报道tagitinin D的类似物tagitinin A和tagitinin C 能减少种子发芽和幼苗生长[11];tagitinin C也具有多种生物活性,包括抗癌作用,且tagitinin C衍生物具有作为癌症治疗的巨大潜力[12]。但是对tagitinin D的生物活性研究较少。本论文用人肝癌HepG2细胞为研究对象,探讨tagitinin D对肝癌细胞的增殖、凋亡的影响,并检测ER stress信号通路相关蛋白的变化,探究其抑制肿瘤的可能机制,为开发利用其药用价值提供科学依据。

图1 Tagitinin D的化学结构Fig.1 The chemical structure of tagitinin D
1 材料与仪器
1.1 受试细胞株
人肝癌HepG2细胞株由中国科学院昆明植物研究所活性筛选中心孔清华老师惠赠。
1.2 主要试剂
Tagitinin D,购于云南西力生物技术有限公司,纯度99%,碘化丙啶PI、溴化四氮唑蓝MTT(Biosharp生物公司),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(四正柏生物),二甲基亚砜DMSO(天津市风船化学试剂科技有限公司),高糖DMEM培养基、胎牛血清、胰蛋白酶、双抗(青霉素10 000 U/mL、链霉素10 mg/mL)(GIBCO),抗体:Actin、PDI、Calnexin、Bip、Ero1-Lα、IRE1α、p-eIF2α(CST)。
1.3 主要仪器
BD FACS Celesta3激光流式细胞仪;成像型微孔板检测仪(BioTek Cytationl);全自动化学发光图像分析系统(tanon5200);立式自动压力蒸汽灭菌器(GR60DR);1300系列Ⅱ级A2型生物安全柜(Thermo);SCILOGEX离心机(CF1524R)。
2 实验方法
2.1 细胞培养
用含10%的FBS(胎牛血清)、1%双抗(青霉素10 000 U/mL、链霉素10 mg/mL)的高糖DMEM培养基培养HepG2细胞,放置在37 ℃、5% CO2培养箱中,取对数生长期且细胞状态良好的细胞用于后续实验。
2.2 检测人肝癌HepG2细胞活力
采用溴化四氮唑蓝(MTT)法检测细胞活力[13]。取对数生长期细胞,胰酶消化后吹打呈单细胞悬液将其接种于96孔板,每孔100 μL,待细胞贴壁后,加入不同浓度tagitinin D,每个浓度作4个复孔,置培养箱中72 h,弃上清,每孔中加入100 μL MTT溶液(5 mg/mL),放入培养箱中继续培养4 h,弃上清后再加入100 μL DMSO,用多功能酶标仪在波长490 nm处测量各孔的吸光度(OD值),按下列公式计算细胞活力:
细胞活力=处理组平均OD值/
对照组平均OD值 × 100%
2.3 克隆形成实验
取对数生长期细胞胰酶消化后呈单细胞悬液,用细胞计数板计数,按300个/mL接种于6孔板中,每孔2 mL,待细胞贴壁后,加入不同浓度的tagitinin D(1和2 μM),继续培养12天,弃培养基,PBS洗三遍,每孔加入考马斯亮蓝R250(2.5 mg/mL)1 mL染色2 h,弃染色液,PBS洗三遍,拍照。
2.4 细胞周期检测
取对数生长期细胞胰酶消化后呈单细胞悬液,接种于6孔板,待细胞长到80%左右,加入不同浓度tagitinin D处理12 h,收集细胞制成单细胞悬液,70%乙醇4 ℃过夜,PBS洗一遍,加入500 μL PBS重悬细胞,加入20 μL RNase,放37 ℃孵育30 min,再加入50 μL PI,冰上放置30 min,流式细胞仪检测细胞周期。
2.5 细胞凋亡检测
取对数生长期细胞制呈单细胞悬液,接种于6孔板,待细胞长到80%左右,加入tagitinin D 20 μM处理不同时间(24、48、72 h),收集细胞制成单细胞悬液,PBS洗一遍,按凋亡试剂盒说明书加入试剂,用流式细胞仪检测细胞凋亡率。
2.6 检测活性氧的变化
取对数生长期细胞制呈单细胞悬液,接种于6孔板,待细胞长到80%左右,加入不同浓度tagitinin D处理12 h,弃培养基,加入无血清培养基2 mL,再加入DCFH-DA(20 μM),室温孵育15 min,弃培养基,加入PBS洗三遍,拍照,再收集细胞用流式细胞仪检测荧光强度。
2.7 Western blot检测ER stress相关蛋白表达
取对数生长期细胞制呈单细胞悬液,接种于6孔板,待细胞长到80%左右,加入tagitinin D 6 μM处理不同时间(12、24、36 h),收集细胞制作蛋白样本。10%聚丙烯酰胺SDS凝胶电泳后转至PVDF膜上,5%脱脂牛奶封闭2 h,加入一抗4 ℃孵育过夜,二抗室温2 h,PBST洗涤3次,加化学发光液放入全自动化学发光图像分析系统中曝光。
2.8 统计学分析
实验重复3次且每组至少3个复孔,用GraphPad Prism 7软件进行统计分析处理,结果以均值±标准差表示,用t检验进行组间差异比较。P<0.05差异具有统计学意义。
3 结果与分析
3.1 Tagitinin D对人肝癌HepG2细胞活力的影响
用MTT法检测tagitinin D对HepG2细胞活力的影响,加入不同浓度tagitinin D处理细胞72 h,用酶标仪检测吸光度值,计算出tagitinin D作用于HepG2细胞的活力及IC50值= 7.79 ± 0.58 μM,如图2所示,说明tagitinin D能抑制HepG2细胞活力。
3.2 Tagitinin D对HepG2细胞体外成瘤能力的抑制

图2 Tagitinin D抑制HepG2细胞活力Fig.2 Tagitinin D inhibited cell viability of HepG2 cells
Tagitinin D不同浓度(1和2 μM)作用于HepG2细胞12天后,两个处理组克隆球的数量和大小明显低于对照组(图3A),说明tagitinin D能显著抑制肿瘤细胞体外成瘤能力。

图3 Tagitinin D对HepG2细胞体外成瘤能力的影响Fig.3 Tagitinin D inhibited the colony formation ability of HepG2 cells
3.3 Tagitinin D使人肝癌HepG2细胞周期阻滞在G2/M期
用流式细胞仪检测tagitinin D对HepG2细胞周期的影响,如图4A所示:tagitinin D处理组细胞的S期比例由26.1%下降到17.2%,G2/M期比例由28.9%升高至42.8%,说明tagitinin D处理可将大部分细胞阻滞在G2/M期。

图4 Tagitinin D对HepG2细胞周期的影响Fig.4 Tagitinin D induced cell cycle arrest at the G2/M phase in HepG2 cells
3.4 Tagitinin D诱导人肝癌HepG2细胞凋亡
用流式细胞仪检测tagitinin D诱导人肝癌HepG2细胞凋亡,如图5A所示,当处理浓度为20 μM,处理时间为24、48、72 h细胞凋亡率(早期凋亡+晚期凋亡)分别为22%、59.7%、96.6%;说明tagitinin D促进细胞凋亡是时间依赖的。
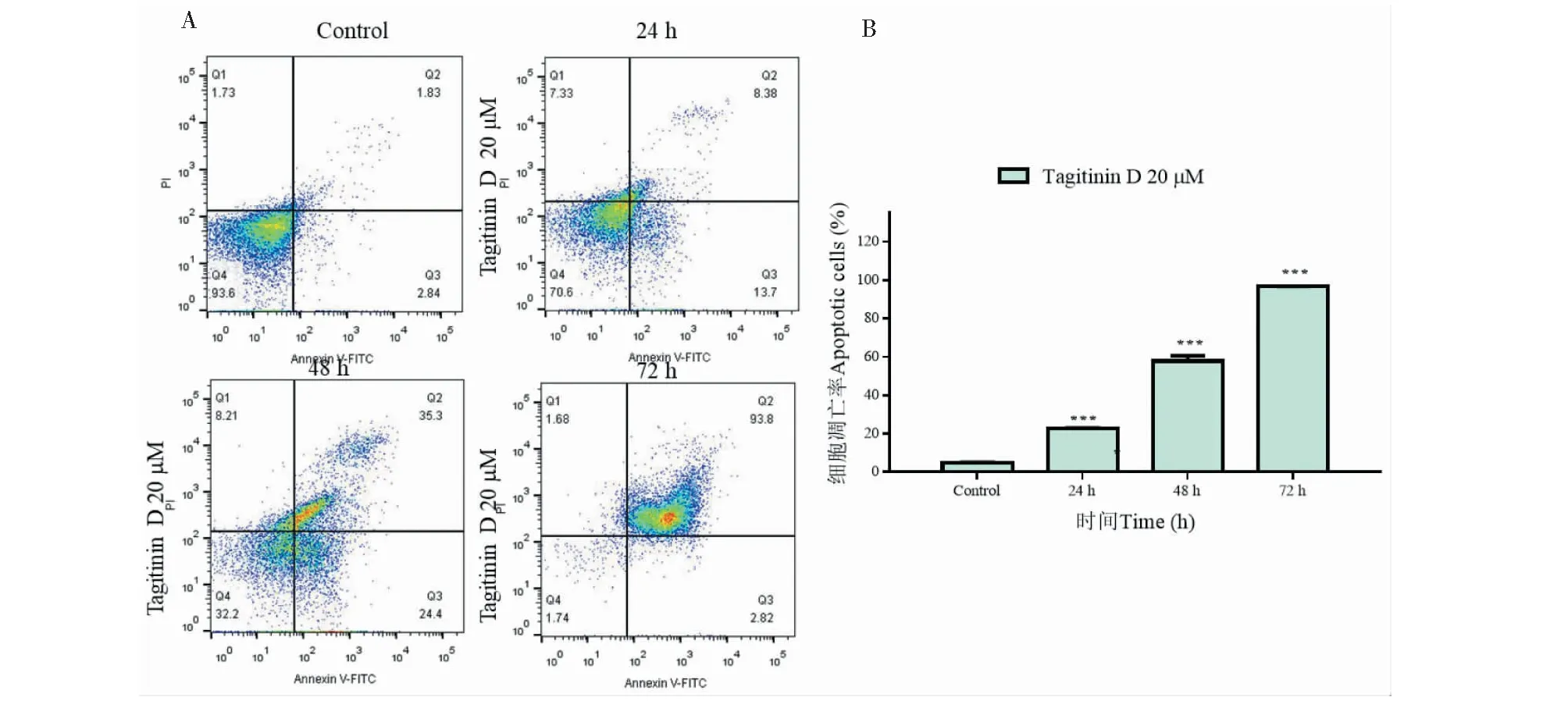
图5 Tagitinin D促进HepG2细胞凋亡Fig.5 Tagitinin D induced apoptosis of HepG2 cells in a time-dependent manner
3.5 Tagitinin D增加人肝癌HepG2细胞内活性氧
3.5.1 Tagitinin D和NAC联用使人肝癌HepG2细胞活力回复
为研究tagitinin D诱导人肝癌HepG2细胞凋亡的作用途径,加入活性氧(reactive oxygen species,ROS)清除剂NAC和泛caspases抑制剂Z-VAD-FMK与tagitinin D联合处理,如图6所示:加入Z-VAD-FMK,细胞活力没有回复;加入NAC后,细胞活力明显回复。以上结果说明tagitinin D降低肿瘤细胞活力是依赖于ROS途径的。

图6 Tagitinin D和NAC联用使人肝癌HepG2细胞活力回复Fig.6 The cell death induced by tagitinin D can be rescued by the ROS scavenger,NAC
3.5.2 DCFH-DA检测人肝癌HepG2细胞内活性氧变化
用探针DCFH-DA检测细胞内源活性氧的累积。如图7所示,随着tagitinin D处理浓度增加,荧光强度逐渐增强(图7A)及平均荧光强度增加(图7B);加NAC后,荧光强度有所回复;说明tagitinin D能显著引起细胞内源性ROS的增加。
3.6 Tagitinin D对人肝癌HepG2细胞ER stress 相关蛋白的影响
ER stress作为ROS的下游,并且持续、强烈的ER stress能显著促进细胞凋亡。既然tagitinin D促进细胞凋亡依赖于ROS,且不依赖于caspases途径,因此检测tagitinin D对ER stress的影响是必要的。如图8所示,tagitinin D处理组浓度6 μM,随着处理时间的变化,ER stress相关蛋白PDI、Ero1-Lα、Calnexin、Bip、IRE1α、p-eIF2α表达水平升高,表明tagitinin D是通过增加ROS引起ER stress并激活IRE1α和PERK信号通路进而诱导细胞凋亡。

图7 Tagitinin D使HepG2细胞内源活性氧增加Fig.7 Tagitinin D increased the endogenous ROS levels in HepG2 cells

图8 Tagitinin D激活ER stressFig.8 Tagitinin D activated the ER stress signaling pathway in HepG2 cells
4 讨论与结论
近年来,由于抗癌药物的局限性,天然小分子化合物为新药的研发起到促进作用,有报道抗癌药物中一半来源于天然产物及其衍生物[14,15],天然产物因具有广泛的不同化学结构从而其生物学活性也有区别,包括抗菌、免疫抑制、抗癌、抗炎等[16]。因此,发现更多天然产物的药用价值以期为临床研究提供依据是必不可少的。本文主要从周期阻滞、诱导细胞凋亡及ER stress信号通路的影响研究tagitinin D促进人肝癌HepG2细胞凋亡的作用机制。
本实验中,我们首先用MTT法检测tagitinin D对人肝癌HepG2细胞活力的影响,实验结果显示随着药物处理浓度的增加,HepG2细胞活力显著降低;通过克隆形成实验表明,与对照组相比,随着药物处理浓度的增加,处理组克隆球形成变小且数量减少;用流式细胞仪检测细胞周期,发现经过tagitinin D处理后且随着浓度的增加,G2/M期比例逐渐升高,以上结果说明tagitinin D能显著抑制HepG2细胞的活力和成瘤能力,并且将大部分细胞阻滞在G2/M期。
内质网途径是细胞凋亡途径之一[17],越来越多的证据表明,内质网应激可能与ROS产生有关,并诱导细胞凋亡[18,19]。ROS是指超氧化物、过氧化氢、过氧亚硝酸盐和羟自由基,他们是不稳定的分子种类,可以破坏细胞内的蛋白质和脂质,并激活细胞内信号传导级联[20]。有研究表明,雷公藤甲素能增加细胞内ROS诱导内质网应激使细胞凋亡[21]。本研究通过凋亡和ROS检测实验结果发现,tagitinin D诱导HepG2细胞凋亡且细胞内ROS增加,说明tagitinin D通过依赖于ROS诱导细胞凋亡。
内质网应激由多种因素引起,如钙离子失调、ROS积累等造成大量未折叠蛋白和错误折叠蛋白聚集,引发ER stress[22]。一旦产生这种应激时间过长,内质网稳态失衡,就会激活内质网凋亡信号,引起细胞凋亡。为进一步探讨tagitinin D是否通过细胞内ROS积累激活ER stress信号通路或caspases途径引起细胞凋亡。加入ROS清除剂NAC和泛caspases抑制剂Z-VAD-FMK后,明显看到加NAC后细胞活力回复;用探针DCFH-DA检测到细胞内ROS的增加;Western blot结果可得:PDI、Ero1-Lα、Calnexin、Bip、IRE1α、p-eIF2α蛋白表达增加;说明tagitinin D通过细胞内ROS增加,激活ER stress信号通路诱导细胞凋亡。
综上所述,tagitinin D抑制人肝癌HepG2细胞活力和体外成瘤能力;通过阻滞细胞在G2/M期影响细胞增殖;同时使细胞内ROS的增加激活ER stress信号通路诱导细胞凋亡。
