针刺加亚低温对MCAO大鼠缺血侧海马组织miRNA归属通路及mir-34c-5p表达的影响
2020-05-16何灏龙郑慧娥高音来陈楚淘田浩梅
何灏龙,郑慧娥,高音来,陈楚淘,田浩梅
针刺加亚低温对MCAO大鼠缺血侧海马组织miRNA归属通路及mir-34c-5p表达的影响
何灏龙,郑慧娥,高音来,陈楚淘,田浩梅
湖南中医药大学,湖南 长沙 410208
观察针刺加亚低温对脑缺血再灌注损伤(CIRI)大鼠缺血侧海马组织miRNA归属通路及mir-34c-5p表达的影响,探讨mir-34c-5p在CIRI中的作用机制。将60只SPF级健康SD大鼠随机分为正常组、假手术组、模型组、针穴组、亚低温组和针刺加亚低温组,每组10只。采用线栓法制备大鼠大脑中动脉闭塞(MCAO)模型,造模成功后约2 h且大鼠生命体征稳定后进行干预。针穴组选取“人中”“百会”“大椎”进行针刺,1次/12 h,共6次;亚低温组连续72 h放入低温代谢笼中,保持肛温(33±1)℃、鼓膜温度(31±1)℃;针刺加亚低温组同时采用针刺与亚低温进行干预。实验结束后,观察大鼠神经功能缺损评分和脑梗死面积,采用miRNA微阵列芯片技术筛选出组间差异基因并归纳信号传导通路,实时定量PCR检测缺血侧海马组织mir-34c-5p的表达。与正常组、假手术组比较,模型组大鼠神经功能缺损评分升高,脑梗死面积比明显增加(<0.01),差异表达miRNA数量分别为4、5个,且主要归属MAPK、p53、Calcium、Jak-STAT及Neurotrophin信号通路,mir-34c-5p表达量明显降低(<0.05);与模型组比较,各干预组大鼠神经功能缺损评分降低,脑梗死面积比明显减少(<0.05,<0.01),但干预组间比较差异无统计学意义(>0.05),针穴组、亚低温组、针刺加亚低温组差异表达miRNA数量分别为16、7、23个,且主要归属MAPK、p53、Calcium、Jak-STAT及Neurotrophin信号通路,各干预组上调mir-34c-5p表达趋势较明显(<0.01);与针穴组、亚低温组比较,针刺加亚低温组大鼠mir-34c-5p表达量明显增加(<0.05)。针刺加亚低温可降低CIRI大鼠神经功能缺损评分,减少脑梗死面积,其机制可能是针刺加亚低温可靶向多条信号转导通路,从多途径、多网络调控CIRI,并与上调mir-34c-5p的表达量有关,从而发挥神经保护作用。
针刺;亚低温;脑缺血再灌注损伤;信号通路;mir-34c-5p;大鼠
脑血管疾病是威胁人类健康的主要疾病之一,国外研究指出缺血性脑卒中占所有脑血管意外疾病的87%[1]。在脑缺血恢复血流供应后,可导致病理损害加剧或产生不可逆的脑组织损伤,即脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)[2]。有研究表明,miRNA在CIRI中存在差异性表达,miRNA可能成为CIRI的重要治疗方向[3]。前期研究发现,针刺可有效抗CIRI[4],亚低温亦可抑制脑缺血再灌注后神经元凋亡[5-6],而针刺加亚低温治疗CIRI的研究却鲜有报道。mir-34c分布在大脑皮质、小脑皮质、嗅球以及海马中[7],其过度表达可导致细胞凋亡和细胞周期停滞[8-9],加剧缺血性脑卒中的神经细胞死亡,形成不可逆性脑损伤,然而亦有部分研究认为,mir-34c过表达可上调抗凋亡基因Bcl2,降低促凋亡基因Bax与Caspase 3,从而实现抑制细胞凋亡的作用[10]。因此,本实验通过观察针刺结合亚低温对CIRI大鼠缺血侧海马组织差异miRNA的表达并归属通路,探讨其高表达的mir-34c-5p在CIRI中的表达影响,为miRNA靶向治疗CIRI提供实验依据和新的临床治疗思路。
1 材料与方法
1.1 动物
SPF级健康SD大鼠60只,雄性,体质量250~280 g,湖南中医药大学实验动物中心提供,动物质量合格证号SCXK(湘)2013-0004。饲养于SPF级动物房,自由摄食饮水。
1.2 主要试剂与仪器
miRNAs芯片(miRCURYTM芯片,Exiqon公司),4%多聚甲醛(长沙维尔生物科技有限公司),10%水合氯醛(长沙维尔生物科技有限公司),Trizol试剂(赛默飞生物技术公司),DEPC(美国Sigma公司),反转录试剂盒(北京康为世纪生物科技有限公司),PBS(长沙维尔生物科技有限公司),TTC溶液(长沙维尔生物科技有限公司),引物(上海生物工程技术服务有限公司)。微血管电凝器(上海医用激光仪器厂),IMS-100全自动雪花制冰机(上海锦玟仪器设备有限公司),水浴箱(恒丰HH-W600),超低温冰箱(美菱),肛温温度计,高分辨率芯片扫描仪(美国Affymetrix公司),单丝尼龙栓线(北京西浓科技有限公司),荧光定量PCR仪(美国Thermo公司),一次性0.25 mm×13 mm华佗牌针灸针(苏州医疗用品厂有限公司)。
1.3 分组及造模
实验大鼠常规适应性饲养7 d,采用随机数字法选取20只分为正常组、假手术组,剩余大鼠随机分为模型组、针穴组、亚低温组、针刺加亚低温组,每组10只。正常组不做任何处理。参照Zea Longa[11]线栓法并进一步改进操作步骤,制备大脑中动脉闭塞(MCAO)模型大鼠。实验前禁食不禁水24 h,10%水合氯醛腹腔注射麻醉(0.3 mL/100 g),仰卧位固定,于颈前正中线剪毛消毒后作一小切口,充分暴露颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),将ECA及ECA与ICA之间的交通支电凝,永久性结扎CCA下端,用弯镊把CCA和ICA撑起拉直,暂时结扎阻断ICA,用眼科剪在距ECA与ICA分叉近心端3 mm处CCA向上剪一斜形小口,夹持前端包被多聚赖氨酸的MCAO栓线从切口处插入,并解开ICA处活结,把栓线沿ICA方向推进约18~20 mm后遇阻力即停,从而栓塞右侧大脑中动脉,再逐层缝合创面并用细线固定MCAO栓线在体外的部分,确保线栓不从切口处脱出。在脑组织缺血约120 min后,用弯镊夹持栓线尾端向外缓慢拔出约10 mm,从而实现CIRI模型。假手术组只从切口处将MCAO栓线插入约8~10 mm,不栓塞大脑中动脉,其余操作同造模组。造模后120 min,待大鼠生命体征稳定,进行神经功能缺损评分[11],无神经功能缺损表现为0分,提尾时脑缺血对侧前肢不能伸直为1分,爬行时向脑缺血对侧旋转为2分,爬行时向脑缺血对侧倾倒为3分,无法自由活动、意识丧失为4分,评分在l~3分者纳入实验。剔除0分和4分大鼠,按相同造模步骤补足造模大鼠数量,本实验动物死亡率约30%。
1.4 干预方法
造模大鼠于麻醉清醒后(造模后120 min)进行干预。正常组常规饲养不作任何干预,假手术组和模型组只捆绑固定不针刺,每次捆绑30 min,1次/12 h。针穴组根据《实验针灸学》[12]及大鼠实验图谱[13]并模拟人体腧穴骨度分寸法进行取穴:“百会”位于大鼠顶骨正中,平刺2 mm;“大椎”位于大鼠第7颈椎与第1胸椎间,后背正中线上,直刺3 mm;“人中”位于大鼠鼻尖下1 mm正中处,向鼻中隔直刺2 mm。行捻转手法1 min,频率90次/min,15 min后捻转1次,留针30 min,1次/12 h,共6次。亚低温组参照舒鑫[14]改良亚低温方法:大鼠置于带有冰块的低温代谢笼中,维持鼓膜温度(31±1)℃、肛温(33±1)℃,持续干预72 h。针刺加亚低温组则同时使用针刺与亚低温干预72 h。
1.5 检测指标
1.5.1 神经功能缺损评分
参照Zea Longa[11]方法在大鼠造模麻醉清醒后与干预治疗72 h后进行神经功能缺损5分制评分。
1.5.2 脑梗死面积比
干预72 h后,每组随机选取5只大鼠,迅速麻醉取脑后放入超低温冰箱内冷冻20 min。去嗅球、小脑和低位脑干,每隔2 mm,然后连续切5个冠状脑切片,将切片浸没在2%TTC染色液中,于37 ℃水浴箱中避光孵育30 min,期间摇晃数次,使切片染色均匀。染色结束后,4%多聚甲醛溶液将脑切片固定24 h,肉眼观察脑梗死部位,用数码相机拍摄并将照片输入电脑。筛选出缺血梗死面积最大的一片,采用图像分析系统扫描获取脑损伤对侧总面积(S1)、脑损伤侧非梗死面积(Sr)的数据,参考Swanson[15]公式计算脑梗死面积比,即IS(%)=(S1-Sr)÷2S1×100%。
1.5.3 差异miRNA筛选
每组随机抽取3只大鼠快速断头取脑,提取缺血侧大脑海马总RNA,用紫外分光光度计测定浓度,用变性琼脂糖凝胶电泳检测RNA的完整性,按照试剂盒的顺序标记合格RNA后,再与miRNA芯片进行杂交,再洗脱、离心,得到干燥芯片。使用高分辨率芯片扫描仪采集图像,Genepix Pro 6.0分析数据输出至Excel中,使用局部回归方法扣除背景值,LOWESS方法[16]进行数据归一化处理,取荧光信号比值>2者为上调,<0.5者为下调,采用平均连接和欧氏距离的层级法进行聚类分析,后进行靶基因预测及GO和Pathway富集分析。
1.5.4 缺血侧海马mir-34c-5p表达
将剩余大鼠进行腹腔麻醉,在大脑变软融化前快速取出缺血侧海马组织,置于冻存管内,放入液氮罐中低温保存。提取海马组织总RNA,用紫外分光光度计测定浓度,取2 μL RNA与loading buffer premix按1∶5比例混匀后,进行RNA变性琼脂糖凝胶电泳,在凝胶成像系统中观察;按反转录试剂盒说明书操作步骤合成cDNA,用引物(上海生工提供)建立PCR反应体系,进行实时定量PCR与定量PCR扩增程序。
1.6 统计学方法
2 结果
2.1 针刺加亚低温对模型大鼠神经功能缺损评分的影响
与正常组、假手术组比较,模型组大鼠神经功能缺损评分较高,差异有统计学意义(<0.01);各造模组神经功能缺损评分比较,差异无统计学意义(>0.05);与模型组比较,针穴组、亚低温组、针刺加亚低温组大鼠神经功能缺损评分显著降低,差异有统计学意义(<0.05,<0.01);组内治疗前后比较,针穴组、亚低温组、针刺加亚低温组治疗后大鼠神经功能缺损评分均降低,差异有统计学意义(<0.01);针穴组、亚低温组、针刺加亚低温组组间比较,大鼠神经功能缺损评分差异无统计学意义(>0.05)。结果见表1。
表1 各组大鼠干预前后神经功能缺损评分比较[M(QR),分]
组别只数干预前干预后 正常组100.0(0)0.0(0) 假手术组100.0(0)0.0(0) 模型组101.5(1)**##1.5(1)**## 针穴组101.4(1)**##0.8(0)▲▲**##& 亚低温组101.5(1)**##0.8(0)▲▲**##& 针刺加亚低温组101.4(1)**##0.4(1)▲▲&&

2.2 针刺加亚低温对模型大鼠脑梗死面积比的影响
经切片、TTC染色后,显示红色为正常大脑组织,白色为缺血梗死灶。正常组和假手术组均未观察到梗死灶。与正常组和假手术组比较,其余4组大鼠脑组织均出现不同程度的白色梗死灶(<0.01);与模型组比较,针穴组、亚低温组、针刺加亚低温组大鼠脑梗死面积均明显缩小(<0.05,<0.01);与亚低温组比较,针刺加亚低温组大鼠脑梗死面积明显减少(<0.05)。结果见图1、表2。
2.3 针刺加亚低温对模型大鼠缺血侧海马组织miRNA表达谱的影响
通过随机方差模型对每个miRNA的显著性水平(即值)进行计算,再按照<0.05筛选差异表达miRNA,共62个。详见图2。
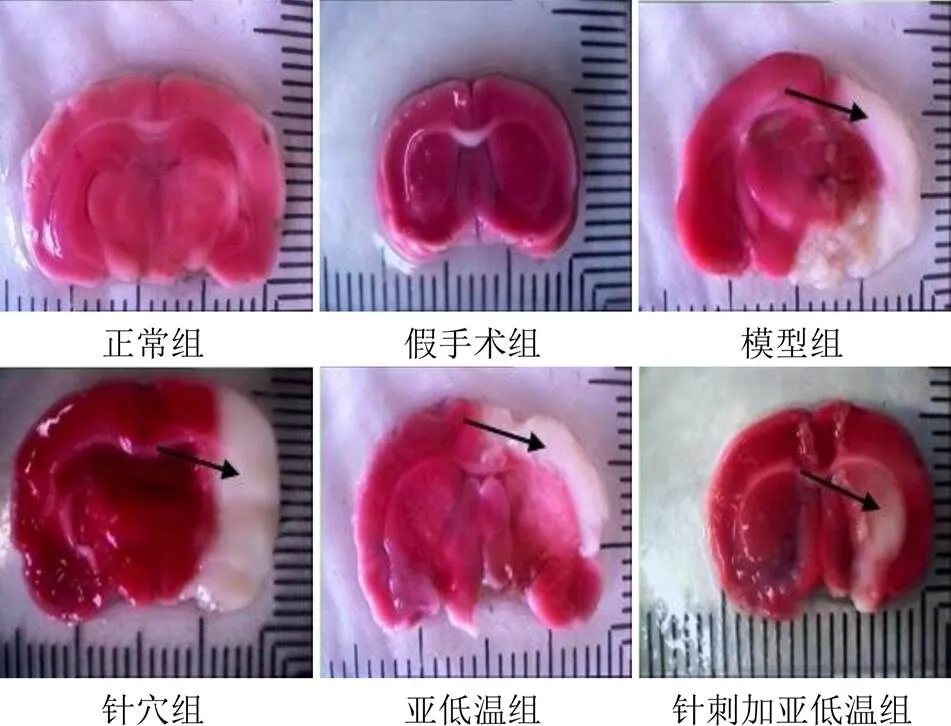
图1 各组大鼠脑梗死面积(TTC染色)
表2 各组大鼠缺血侧脑梗死面积比比较[M(QR)]
组别只数脑梗死面积比 正常组5 0.00(0.00) 假手术组5 0.00(0.00) 模型组533.46(9.00)**## 针穴组519.79(18.18)**##& 亚低温组521.77(9.55)**##&& 针刺加亚低温组5 8.91(13.39)**##&△
注:与正常组比较,**<0.01;与假手术组比较,##<0.01;与模型组比较,&<0.05,&&<0.01;与亚低温组比较,△<0.05
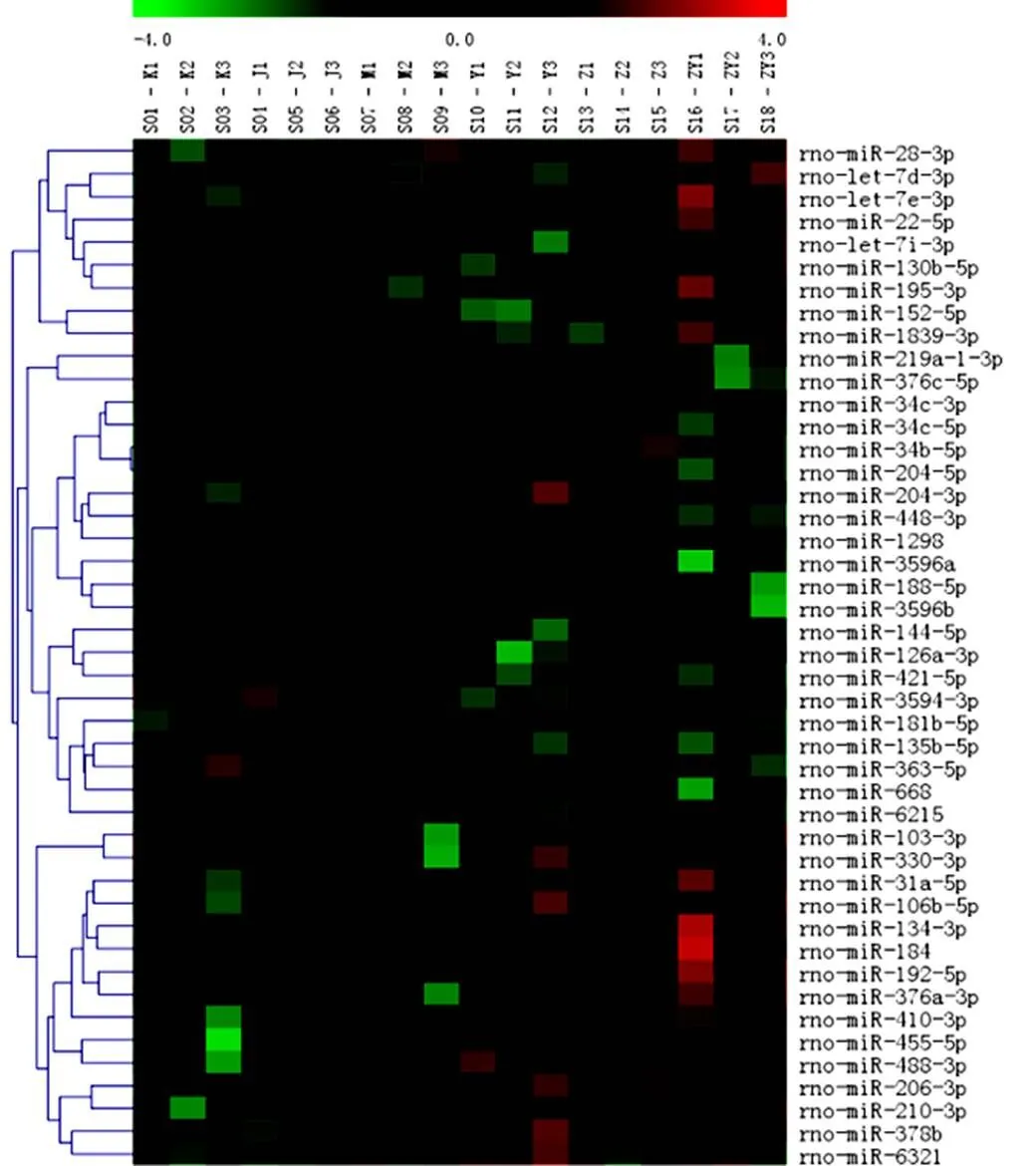
注:横坐标代表各组样本(K.正常组;J.假手术组;M.模型组;Z.针穴组;Y.亚低温组;ZY.针刺加亚低温组);纵坐标表示差异miRNA;红色表示高表达,绿色表示低表达
2.4 针刺加亚低温对模型大鼠缺血侧海马组织差异基因表达数量的影响
与正常组比较,模型组有4个miRNA表达有差异;与假手术组比较,模型组有5个miRNA表达有差异;与模型组比较,针穴组有16个miRNA表达有差异,亚低温组有7个miRNA表达有差异。针刺加亚低温组有23个miRNA表达有差异。针刺加亚低温组差异表达数量最多,恰好是针穴组与亚低温组数量之和。
2.5 针刺加亚低温对模型大鼠缺血侧海马组织差异miRNA归属信号通路的影响
与正常组比较,模型组差异miRNA主要归属MAPK、p53、Calcium、Neurotrophin信号通路;与假手术组比较,模型组归属MAPK、p53、Calcium、Jak-STAT、Neurotrophin信号通路;与模型组比较,针穴组归属MAPK、p53、Calcium、Jak-STAT、Neurotrophin信号通路;亚低温组归属MAPK、p53、Calcium、Jak-STAT、Neurotrophin信号通路;针刺加亚低温组归属MAPK、p53、Calcium、Jak-STAT、Neurotrophin信号通路,且针刺加亚低温组差异miRNA数量及其调控的信号转导通路最为丰富。结果见表3。
表3 各组与模型组间差异miRNA数量及miRNA主要归属信号通路(条)
组别MAPK信号通路p53信号通路Calcium信号通路Jak-STAT信号通路Neurotrophin信号通路 正常组 21 102 假手术组 12 222 针穴组 751285 亚低温组 31 213 针刺加亚低温组1561169
2.6 针刺加亚低温对模型大鼠缺血侧海马组织mir-34c-5p表达的影响
与正常组和假手术组比较,模型组大鼠脑组织海马mir-34c-5p表达量明显降低(<0.05);与模型组比较,各治疗组mir-34c-5p表达量明显增加(<0.01);与针穴组比较,亚低温组大鼠脑组织海马mir-34c-5p表达量明显增加(<0.05),针刺加亚低温组mir-34c-5p表达量进一步增加(<0.05);与亚低温组比较,针刺加亚低温组大鼠脑海马mir-34c-5p表达量明显增加(<0.05)。结果见表4。
表4 各组大鼠海马mir-34c-5p相对表达量比较(±s)

3 讨论
局限性脑缺血是临床常见脑血管疾病,属中医学“中风病”范畴。临床研究表明,针刺可有效改善脑缺血后神经功能[17]。本实验根据经络腧穴理论,选取督脉上具有熄风、醒脑、开窍等作用的“百会”“大椎”“人中”。《普济方》提到“治中风,气塞涎上,不语昏危者,百会、风池、大椎、肩井、曲池、间使、三里等七穴”。另《玉龙歌》云:“中风之病症非轻……先补后泻如无应,再刺人中立便轻。”现代实验研究发现,针刺督脉“百会”“大椎”“人中”可有效促进MCAO模型大鼠神经功能缺损的恢复,改善神经元超微结构的病理变化,促进血管新生,减少脑梗死面积,从而达到一定程度的脑保护作用[18-20]。有研究显示,亚低温治疗可明显减轻CIRI,促进神经功能恢复,其机制可能是通过调控相关的凋亡因子,抑制CIRI后神经元凋亡的发生,起到对神经元的保护作用[21-23]。
miRNAs是一种非编码单链小RNA分子,作为基因表达的负调控因子,miRNA控制大脑疾病不同方面,可改变缺血再灌注损伤的反应,调控细胞存活与凋亡过程中多种关键因子的表达[3]。mir-34c-5p与mir-34c-3p分别是mir-34c家族中一个成熟的miRNA,在细胞死亡、凋亡、迁移和侵袭中有着不可或缺的作用,且mir-34c-3p主导阻滞细胞周期并诱导细胞凋亡,而mir-34c-5p的作用却有别于mir-34c-3p[24]。有研究发现,mir-34c-5p可通过激活JAK2/STAT3信号通路直接抑制细胞凋亡[25];此外,mir-34c-5p亦可通过靶向抗凋亡蛋白Bcl2的表达从而发挥抗凋亡作用[26]。本实验通过采用基因微阵列技术,筛选出CIRI大鼠差异表达的miRNA中包括mir-34c-5p,且mir-34c-5p可能通过调控其靶基因的表达,在局部脑缺血损伤的MCAO大鼠中发挥重要的脑保护作用[27]。
在本实验研究中,造模后大鼠出现不同程度神经功能缺损状态,脑梗死面积明显扩大,提示造模成功。针刺、亚低温及针刺加亚低温干预均可降低CIRI大鼠神经功能缺损评分,减少脑梗死面积,说明3种不同干预方法均有效,且与亚低温组比较,针刺加亚低温组在改善神经功能与脑梗死面积方面效果更好,这可能与针刺和亚低温的叠加效应有关。与模型组比较,针穴组、亚低温组和针刺加亚低温组差异miRNA的主要归属信号通路包括MAPK信号通路、p53信号通路、Calcium信号通路、Jak-STAT信号通路及Neurotrophin信号通路,且3组差异miRNA数量均不相等,而针刺加亚低温组数量最多,说明在CIRI过程中针刺结合亚低温可激活更多miRNA的表达,靶向多条信号通路,从多途径、多网络调控CIRI。造模后,MCAO大鼠脑内mir-34c-5p表达有下降趋势,而经干预后,针穴组、亚低温组及针刺加亚低温组mir-34c-5p表达量显著增加,推测mir-34c-5p是修复CIRI所致脑组织损伤的表达基因。综上,针刺加亚低温疗法可降低MCAO大鼠神经功能缺损评分,减少脑梗死面积,其机制可能是针刺加亚低温疗法可靶向多条信号转导通路,从多途径、多网络调控CIRI,以及与上调mir-34c-5p的表达量有关,从而发挥重要的神经保护作用。
[1] BENJAMIN E J, BLAHA M J, CHIUVE S E, et al. Heart disease and stroke statistics-2017 Update:a report from the American Heart Association[J]. Circulation,2017,135(10):e146-e203.
[2] ELTZSCHIG H K, ECKLE T.Ischemia and reperfusion-from mechanism to translation[J]. Nat Med,2011,17(11):1391-1401.
[3] DI Y, LEI Y, YU F, et al. MicroRNAs expression and function in cerebral ischemia reperfusion injury[J]. Journal of Molecular Neuroscience,2014,53(2):242-250.
[4] 张晨蕾,李永峰,惠建荣,等.针刺调控不同信号通路防治缺血性脑血管病的研究进展[J].针刺研究,2018,43(8):531-536.
[5] 黄杰,李丽茹,张斌.亚低温对大鼠局灶性脑缺血再灌注后凋亡相关蛋白表达的影响及保护作用[J].中国老年学杂志,2016,36(17):4153-4154.
[6] 林亚平,刘琴,陈楚淘,等.针刺联合亚低温对脑缺血再灌注损伤大鼠脑组织MAPK/ERK通路及凋亡相关因子的影响[J].中南大学学报:医学版,2017,42(4):380-388.
[7] TIAN H M, HE P, ZHANG Y C, et al. Effects of acupuncture on the number of associated protein phosphorylation in brain tissues of MCAO rats based on protein microarray technique[J]. J Acupunct Tuina Sci,2017,15(2):74-80.
[8] HE L, HE X, LIM L P, et al. A microRNA component of the p53 tumour suppressor network[J]. Nature,2007,447(7148):1130-1134.
[9] TARASOV V, JUNG P, VERDOODT B, et al. Differential regulation of microRNAs by p53 revealed by massively parallel sequencing:miR-34a is a p53 target that induces apoptosis and G1-arrest[J]. Cell Cycle,2007,6(13):1586-1593.
[10] LIU X D, ZHANG L Y, ZHU T C, et al. Overexpression of miR-34c inhibits high glucose-induced apoptosis in podocytes by targeting Notch signaling pathways[J]. International Journal of Clinical and Experimental Pathology,2015,8(5):4525-4534.
[11] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[12] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2007:1-31.
[13] 华兴邦,周浩良.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5.
[14] 舒鑫.亚低温对脑出血大鼠HIF-1α、SOCS-3、Caspase-3表达影响的实验研究[D].泸州:泸州医学院,2013.
[15] SWANSON R A. A Semiautomated method for measuring brain infarct volurne[J]. J Ceveb Blood Flow Metab,1990,10(2):293-295.
[16] BOLSTAD B M, IRIZARRY R A, ASTRAND M, et al. A comparison of normalization methods for high density oligonucleotide array data based on variance and bias[J]. Bioinformatics,2003,19(2):185- 193.
[17] 刘雪珂,李梦,祝金豹,等.针灸治疗缺血性脑卒中研究进展[J].山西中医学院学报,2018,19(4):76-79.
[18]邓容,皮敏,杨卓欣,等.电针任督脉对脑缺血再灌注大鼠应激-损伤-修复相关信号的影响(英文)[J].世界针灸杂志:英文版,2016,26(3):22-30.
[19] 贺平,颜虹,蒋素容,等.针刺大椎、人中、百会穴对脑缺血再灌注损伤大鼠脑线粒体超微结构的影响[J].湖南中医药大学学报,2018,38(1):55-58.
[20] 蒋素容,武姿含,高音来,等.针刺大椎、百会、人中穴对脑缺血再灌注损伤大鼠脑组织p-VEGF蛋白表达的影响[J].湖南中医药大学学报, 2018,38(11):1262-1266.
[21] 邹瑜,周迎,高玮.浅低温联合艾芬地尔对大鼠全脑缺血再灌注后凋亡诱导因子的影响[J].中华医学杂志,2014,94(17):1353-1356.
[22] YU D, WANG X, ZHOU F, et al. Mild hypothermia modulates the expression of nestin and caspase-3 in the sub-granular zone and improves neurological outcomes in rats with ischemic stroke[J]. Oncotarget,2017,8(65):109191-109200.
[23] 陈楚淘,陈文,林亚平,等.针刺联合亚低温对脑缺血再灌注损伤大鼠脑组织相关miRNA功能表达的影响[J].中国中西医结合杂志,2018, 38(5):574-578.
[24] WU Z, WU Y, TIAN Y, et al. Differential effects of miR-34c-3p and miR-34c-5p on the proliferation, apoptosis and invasion of glioma cells[J]. Oncology Letters,2013,6(5):1447-1452.
[25] NING L, DONG M, YANSHA C, et al. Downregulation of SIRT6 by miR-34c-5p is associated with poor prognosis and promotes colon cancer proliferation through inhibiting apoptosis via the JAK2/STAT3 signaling pathway[J]. International Journal of Oncology,2018,52(5):1515-1527.
[26] CATUOGNO S, CERCHIA L, ROMANO G, et al. miR-34c may protect lung cancer cells from paclitaxel-induced apoptosis[J]. Oncogene,2013,32(3):341-351.
[27] 张淑艺,秦红亚,商溪溪,等.miR-34c在大鼠局灶性脑缺血模型中的表达[J].济宁医学院学报,2017,40(1):72-76.
Effects of Acupuncture Plus Mild Hypothermia on miRNA Belonged Pathway and Expression of mir-34c-5p in Ischemic Hippocampal Tissues of MCAO Rats
HE Haolong, ZHENG Huie, GAO Yinlai, CHEN Chutao, TIAN Haomei
To observe the effects of acupuncture plus mild hypothermia on the miRNA attribution pathway and mir-34c-5p expression in the ischemic hippocampal tissue of rats with cerebral ischemia reperfusion injury (CIRI); To explore the mechanism of action of mir-34c-5p in CIRI.Totally 60 healthy SPF SD rats were randomly divided into normal group, sham-operation group, model group, acupuncture group, mild hypothermia group, acupuncture plus mild hypothermia group (A+MH group), with 10 rats in each group. Middle cerebral artery occlusion (MCAO) model was established by suture method. The model was successfully constructed for about 2 h and the vital signs of the rats were stable for intervention. The acupuncture group received acupuncture treatment at the acupoints of Renzhong, Baihui, and Dazhui, once per 12 hours, a total of 6 times. The mild hypothermia group were put into the cryogenic metabolic cage and maintained the rectal temperature at (33±1)℃and tympanic temperature at (31±1)℃ for 72 hours. The A+MH group adopted both acupuncture and mild hypothermia intervention. After the treatment, neurological function deficit score and cerebral infarct area were observed. miRNA microarray chip technology was used to screen out differentially expressed genes and signal transduction pathways. Real-time quantitative PCR was used to detect the expression level of mir-34c-5p in the hippocampal tissue of the ischemic side.Compared with the normal group and the sham-operation group, neurological function deficit score and cerebral infarct area ratio in the model group significantly increased (<0.01). The number of differentially expressed miRNAs was 4 and 5, respectively, and mainly belonged to MAPK, p53, Calcium, Jak-STAT and Neurotrophin signaling pathways, and the expression of mir-34c-5p significantly decreased (<0.05). Compared with the model group, the acupuncture group, the mild hypothermia group, the A+MH group had significantly reduced neurological function deficit score and cerebral infarct area ratio (<0.05,<0.01). However, there was no statistical significance among the treatment groups. The number of differentially expressed miRNAs was 16, 7 and 23 in acupuncture group, the mild hypothermia group, the A+MH group, respectively, and mainly belonged to MAPK, p53, Calcium, Jak-STAT and Neurotrophin signaling pathways, and the expression of mir-34c-5p significantly increased significantly (<0.05). Compared with acupuncture group and mild hypothermia group, mir-34c-5p expression increased significantly in A+MH group (<0.05).Acupuncture plus mild hypothermia therapy can reduce the neurological function deficit score and cerebral infarction area of CIRI rats, possibly by targeting multiple signal transduction pathways and regulating CIRI from multiple channels and networks, and is related to the up-regulation of mir-34c-5p expression, so as to play an important neuroprotective role.
acupuncture; mild hypothermia; cerebral ischemia reperfusion injury; signaling pathway; mir-34c-5p; rats

R245
A
1005-5304(2020)05-0042-06
10.3969/j.issn.1005-5304.201910008
国家自然科学基金(81874508、81303051);湖南省大学生研究性学习和创新性实验计划(2017-287);湖南省中医药管理局课题(201961)
田浩梅,E-mail:451358104@qq.com
(2019-10-02)
(2019-10-27;编辑:华强)
