阿司匹林联合治疗腔隙性脑梗死的疗效研究
2020-05-15马艳菊
马艳菊


【摘要】目的:探讨阿司匹林联合治疗腔隙性脑梗死的疗效。方法:选取2016年1月-2018年7月某院收治的腔隙性脑梗死患者62例,随机数字表法分为两组,对照组应用阿司匹林治疗,研究组应用阿司匹林联合西洛他唑治疗。比较两组血液流变学指标水平、疗效。结果:研究组相对血液黏度切变率、血浆黏度、全血黏度切变率、纤维蛋白原均低于对照組(P<0.05);研究组临床疗效优于对照组(P<0.05)。结论:腔隙性脑梗死的治疗过程当中,阿司匹林的治疗效果理想,可增加其疗效,临床上应当进一步推广应用。
【关键词】阿司匹林;腔隙性脑梗死;NIHSS评分;血液流变学
【中图分类号】
R249 【文献标识码】
B【文章编号】2095-6851(2020)05-067-01
腔隙性脑梗死主要发生在丘脑、脑桥、脑深部白质等位置,发生梗死灶的直径大多数为2-4cm,属于特殊缺血性卒中,但是由于疾病恢复时期,慢性愈合会引起不规则的陷窝、腔隙,所以在临床中被称之为腔隙性脑梗死。一般发生在中老年人群中,高血糖、高血压等疾病都会导致此疾病的发生[1]。腔隙性脑梗死早期症状并不明显,所以及其容易被忽视,促使患者在诊断时疾病已处于严重状态,并且大部分也会伴有血管性痴呆等障碍,给患者的家庭和生活都带来一定的困扰。目前临床中对于腔隙性脑梗死没有确切的治疗方式,只能参考其他的缺血性脑血管疾病[2]。使用最多的为阿司匹林防止疾病复发,但是效果一般,在本次研究中,联合西洛他唑共同治疗,属于一种新型的选择性磷酸二酯酶抑制剂,并具有一定的抗血小板凝聚效果,保护血管内皮和扩张脑血管等有一定的效果,所以使用阿司匹林联合西洛他唑治疗,可以改善患者的血液流变学,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月-2018年7月某院收治的腔隙性脑梗死患者62例,随机数字表法分为两组,对照组31例,男19例,女12例,年龄62-79岁,平均年龄(70.1±0.3)岁;研究组31例,男21例,女10例,年龄60-77岁,平均年龄(68.4±0.6)岁。两组患者均知情本研究,资料有对比性(P>0.05),此次研究经过某院伦理委员会批准。
1.2 方法
两组患者均进行调脂、稳定血管斑块、降低血液黏稠等治疗,并对运动、日常饮食进行有效的指导。
1.2.1 对照组 使用阿司匹林(国药准字H51021475,四川太平洋药业有限责任公司),1次/d,0.1g/次,温水口服,连续治疗12周。
1.2.2 研究组 在对照组的基础上加用西洛他唑(国药准字H20113551,山西邦仕得药业有限公司)2次/d,50mg/次,温水口服,连续治疗12周。
1.3 观察指标
(1)比较两组血液流变学指标水平。其中包含的内容有:相对血液黏度切变率、全血黏度切变率、纤维蛋白原、血浆黏度。
(2)比较两组疗效。显效:最终NIHSS评分的减分率>46%;有效:NIHSS评分的减分率>19%;无效:NIHSS评分的减分率≤19%。总有效率=(显效+有效)/总例数×100%。
1.4 统计学方法
数据应用SPSS18.0进行分析,其中计数进行X2(%)检验,计量进行t检测(x±s)检验, P<0.05提示有显著差异。
2 结果
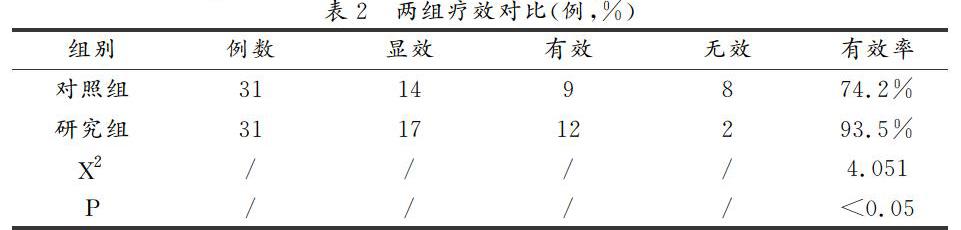
2.1 研究组相对血液黏度切变率、血浆黏度、全血黏度切变率、纤维蛋白原均低于对照组(P<0.05),具体见表2。
2.2 研究组临床疗效优于对照组(P<0.05),具体见表2。
3 讨论
腔隙性脑梗死在早期没有较为明显的症状,较多患者意识到就诊时已经处于晚期,死亡率和致残率和其他缺血性脑血管疾病进行对比结果较低,但是在治疗后容易不断反复,对家庭和患者来说生活均受到影响,为了帮助患者解决其烦恼,本研究使用阿司匹林联合西洛他唑治疗[3]。
阿司匹林是通过和环氧化酶中的COX-1活性部位多肽链30位丝氨酸残基的羟基进行乙酰化,促使环氧化酶失去活性,之后阻断了花生四烯酸转成血栓烷A2,并降低血小板凝聚[4]。西洛他唑的原理是阻碍磷酸二酯酶合成,减少血栓素的形成,提高环磷酸腺苷水平,促使抗血小板凝聚的作用更加优异,同时帮助血管扩张。这种药物还可以增加血流量、调节血脂、松弛血管平滑肌、减少血管壁受损、减轻血管闭塞程度、减少血管内斑块形成、保护内皮细胞等,所以结果显示:研究组相对血液黏度切变率、血浆黏度、全血黏度切变率、纤维蛋白原均低于对照组(P<0.05)说明两种药物联合使用,可以有效的保证脑部血运通畅,消除和缓解脑血管闭塞,改善脑组织血供情况,这是因为两种药物均具有抗血小板凝聚作用。研究组临床疗效优于对照组(P<0.05),这是因为阿司匹林联合西洛他唑可以改善或者的生活质量和神经功能,增加治疗效果。
综上所述,腔隙性脑梗死的治疗过程当中,阿司匹林的治疗效果理想,可增加其疗效,临床上应当进一步推广应用。
参考文献:
[1] 李霞, 王炜, 赵仕琪等. 脑梗死患者COX-1及COX-2基因多态性与阿司匹林抵抗的相关性分析[J]. 中风与神经疾病杂志, 2019,164(6):488-492.
[2] 方翔, 唐斌, 陈光等. 急性腔隙性脑梗死患者肾功能减退与脑微出血进展的相关性研究[J]. 中华神经医学杂志, 2017, 16(01):28-34.
[3] 李亚南, 刘祥, 杨淑红等. 尼莫地平对老年腔隙性脑梗死患者术后谵妄的影响[J]. 中华麻醉学杂志, 2018, 38(3):262-265.
[4] 王飛, 杨卓璇, 费敏等. 急性腔隙性脑梗死患者血管周围间隙扩大程度的影响因素研究[J]. 中华神经医学杂志, 2018, 17(1):29-33.
[4] 乔丽丽,李冬娥. 血清同行半胱氨酸与2型糖尿病肾病的关系[J]. 中华全科医学,2011,09(06):874-875.
[5] Gomez-Marcos MA, Recio-Rodriguez JI, Patino-Alonso MC, et al. Evolution of target organ damage and haemodynamic parameters over 4 years in patients with increased insulin resistance: the LOD-DIABETES prospective observational study[J]. BMJ Open,2016,6(6):104-109.
[6] Desposito D, Waeckel L, Potier L, et al. Kallikrein(K1)-kinin-kininase (ACE) and end-organ damage in ischemia and diabetes: therapeutic implications[J]. Biol Chem,2016,12(9):993-999.
[7] Kawada T. Cardiovascular and all-cause mortality in patients with type 2 diabetes mellitus and chronic kidney disease[J]. J Diabetes Complications,2016,19(9):233-241.
[8] Zhong J, Wang Y, Wang X, et al. Significance of CAVI, hs-CRPand homocysteine in subclinical arteriosclerosis among a healthy population in China[J]. Clin Invest Med,2013,36(2):81-86.
[9] Mao S, Xiang W, Huang S, et al. Association between homocysteine status and the risk of nephropathy in type 2 diabetes mellitus[J]. Clin Chim Acta,2014,431(43):206-210.
[10] Xi H, Zhang Y, Xu Y, et al. Caspase-1 Inflammasome Activation Mediates Homocysteine-Induced Pyrop-Apoptosis in Endothelial Cells[J]. Circ Res,2016,118(10):1525-1539.
[11] Diaz-Santiago E, Rodriguez-Caso L, Cardenas C, et al. Homocysteine pre-treatment increases redox capacity in both endothelial and tumor cells[J]. Redox Rep,2016,65(12):1-7.
[12] Darendelioglu E, Aykutoglu G, Tartik M, et al. Turkish propolis protects human endothelial cells in vitro from homocysteine-induced apoptosis[J]. Acta Histochem,2016,118(4):369-376.
[13] Sen U, Mishra PK, Tyagi N, et al. Homocysteine to hydrogen sulfide or hypertension[J]. Cell Biochem Biophys,2010,57(2-3):49-58.
[14] Sun L, Sun S, Li Y, et al. Potential biomarkers predicting risk of pulmonary hypertension in congenital heart disease: the role of homocysteine and hydrogen sulfide[J]. Chin Med J (Engl),2014,127(5):893-899.
[15] Weber GJ, Pushpakumar S, Tyagi SC, et al. Homocysteine and hydrogen sulfide in epigenetic, metabolic and microbiota related renovascular hypertension. Pharmacol Res,2016,113(Pt A):300-312.
[16] Wiernicki I, Millo B, Safranow K, et al. MMP-9, homocysteine and CRPcirculating levels are associated with intraluminal thrombus thickness of abdominal aortic aneurysms: new implication of the old biomarkers[J]. Dis Markers,2011,31(2):67-74.
