双源CT 门静脉成像对TIPS 术后分流道障碍的评估价值
2020-05-15胡伟郑波徐燕能袁罡斯光晏
胡伟,郑波,徐燕能,袁罡,斯光晏
(西南医科大学附属中医医院,四川 泸州)
0 引言
经颈静脉肝内门体分流术(TIPS)已成为肝硬化门静脉高压患者难治性食管胃底静脉曲张破裂出血和顽固性腹水的有效治疗方式[1]。早期使用裸支架行肝门静脉分流,随访结果并不满意,两年内分流道功能障碍高达80%[2]。为了解决这一问题,近年覆膜支架的运用提高了通畅率,但分流道障碍仍然是一个不可避免的并发症,术后2 年内再出血的患者占20%左右[3]。我科对2015-2017 年3 年内122 例患者进行随访,再出血患者22 例,与文献报道术后出血复发率相似[4]。再次上消化道出血的的原因主要是分流道障碍,其次还有胃粘膜病变、胃溃疡等。对于分流道的监测,多普勒超声被推荐为分流道监测的常用手段,但对于术后再次出血患者,由于腹水、肠气干扰等多因素影响,多普勒超声表现不足以准确评估分流道障碍。为了术前有效的评估分流道情况,分析再出血原因,寻求直观、准确及有效的术前评估,我科运用双源CT门静脉成像对TIPS 术后再出血患者分流道进行术前评估,了解分流道情况,指导下一步治疗有着极大的价值,具体报道如下。
1 资料与方法
1.1 临床资料
收集2015 年1 月至2017 年12 月我院收治的TIPS 术后再出血患者43 例,男25 例,女18 例,年龄42~69 岁,平均58.6 岁。43 例患者均使用8mm 直径Fluency 覆膜支架,13 例患者加用了ELUMILEX 裸支架。术后再发生出血时间0~4 年,平均1.5 年,其中术后首次出血5 例,2 次及2 次以上出血的17 例。Child-Pugh肝功能分级:A 级4 例,B 级10 例,C 级8 例。43 例患者全部行CT 门静脉成像检查和介入手术证实。
1.2 CT 检查
采用西门子Somatom Definition Flash 二代双源CT,扫描前口服清水500-1000mL,充盈胃肠道,应用非离子碘对比剂(优维显,370mgI/mL),扫描范围从膈顶至髂嵴水平。患者先行小剂量预注射试验Test Bolus,15mL,4-5mL/s)获取门静脉时间密度曲线(TDC),以门静脉的峰值时间作为门静脉扫描成像时间。扫描参数:球管转数0.28s/r,螺距0.8,矩阵512×512,重建层厚0.75mm,层距0.6mm,扫描条件:管电压100kV;管电流根据实时动态随机曝光剂量调节(CAREDose4D),范围260-350mAs。对比剂用量:120mL,流速4-5mL/s;随后追加注射流速4-5mL/s 生理盐水40mL。门静脉期薄层重建图像传到Syngo.via 工作站,采用最大密度投影(MIP)、多平面重建(MPR)、容积再现(VR)等后处理技术进行观察。
1.3 介入治疗
采 用AXIOM-Artist 型DSA 系 统(德 国Siemens 公 司) 行 经颈静脉分流道造影及分流道成形术,具体方法如下:穿刺右颈静脉,置入6F 血管鞘,如下情况判断分流道障碍类型:(1)使用导丝5F 单弯导管或者Cobra 导管在引流肝静脉造影,观察肝静脉端支架是否盖帽,尝试通过支架上端,反复尝试仍不能通过者,使用RUPS-100 穿刺套件穿刺原支架肝内段行分流道重建或平行支架重建,门静脉造影结合肝静脉造影确定为肝静脉端盖帽。(2)导管能顺利到达支架内到达门静脉,门静脉端盖帽导丝一般能通过。
造影确定是否存在支架狭窄、门静脉端盖帽、支架严重成角。治疗给予球囊扩张、支架置入、栓塞冠状静脉。术前术后测门静脉压力评估治疗效果。
1.4 诊断评定标准
肉眼观察CT 薄层断层图像及最大密度投影(MIP)、多平面重建(MPR)、容积再现(VR),由两位副主任职称以上介入放射科医师分别观察CT 图像做出诊断,并有两位副主任职称以上行介入手术治疗。
2 结果
重建结果显示,43 例存在中31 例分流道障碍:支架狭窄5 例、肝静脉段盖帽15 例、门静脉端盖帽6 例、支架严重成角3 例、支架内血栓形成2 例。43 例患者经过再次介入治疗,术中诊断与术前增强CT 诊断完全相符。31 例患者手术成功率100%,术后均止血,手术时间51±25 分钟,门静脉压力由术前的(53.4±11.2)cm H2O下降到术后的(21.3±7.6)cmH2O。其中3 例支架内狭窄经球囊扩张;15 例肝静脉端盖帽中10 例不完全盖帽,导丝能通过支架,再植入一枚裸支架衔接至下腔静脉内再行球囊后扩,5 例完全盖帽支架内无血栓形成,导丝无法通过支架顶端,经穿刺原覆膜支架肝内段后,球囊破膜后置入覆膜支架延伸至下腔静脉内(见图1);6 例门静脉端盖帽置入裸支架将门静脉端延伸再行球囊后扩;3 例支架严重成角中2 例通过置入覆膜支架再行后扩得以修正,1 例经上述处理后门静脉压力无改善,通过重新穿刺建立平行支架后门静脉压力下降(见图2);1 例支架内血栓形成重新建立分流道。对20 例患者随访1 年,1 例发生消化道出血,超声随访测支架内血流速度为85±15cm/s。
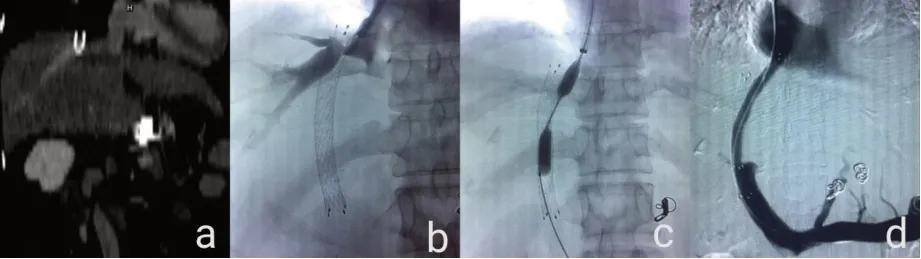
图1

图2

图3
3 讨论
胃底食管静脉曲张破裂出血(EGVB)是肝硬化门静脉高压症的严重并发症,也是肝硬化患者最常见的死亡原因之一。经颈静脉肝内门体分流术(TIPS)是缺乏外科手术指针且内镜下治疗失败的肝硬化食管胃底静脉曲张破裂出血(EGVB)的有效治疗选择[5]。但随访过程中仍有患者再次发生上消化道大出血,胥莹[6]等对126 例使用Fluency 覆膜支架TIPS 术后两年内再出血发生率为17.2%。再出血作为TIPS 治疗肝硬化门静脉高压症重要预后评价之一,如何降低再出血及如何有效处理再出血是提高TIPS远期疗效的关键。近年来国内外多项研究表明TIPS 术后分流道障碍是导致再出血的主要原因[7-8]。分流道障碍是指支架因各种原因(盖帽、狭窄、闭塞等) 流量减少,门静脉压力仍处于高压状态,食管胃底静脉曲张再次开放导致再出血。引起分流道障碍的主要原因有:支架内血栓形成、支架两端盖帽、支架内狭窄等。虽然覆膜支架的运用减少了肝实质内组织增生及胆汁渗漏等因素导致的支架狭窄、闭塞,但分流道失功不可避免,导致再出血仍需要解决。TIPS 术后再出血的介入治疗与首次TIPS 比较,治疗的难度更大,手术成功率低。所以术前能够有效的评估分流道情况,全面分析患者出血原因,是提高诊断与治疗的关键。
国内外专家都认可的诊断分流道障碍的金标准是DSA,但其为有创性检查,且直接行DSA 因缺乏术前评估导致手术难度增加和手术耗时长,不能得到优化的治疗方式[9]。超声检查优点是可测量支架内血流速的的变化,但声波不能穿透金属支架,产生金属伪影阻碍支架内血栓的观察,判断支架狭窄及闭塞不准确,特别是对于支架两端是否盖帽的诊断准确率极低[10]。双源CT 门静脉血管成像使用多排探测器,能在较短时间内进行较长范围内的扫描,获得高质量的重建图像。本研究的22 例患者中MIP 重建可清晰显示肝静脉、门静脉和支架的形态结构,MPR 重建能明显减少背景干扰及周围血管重叠,VR 可通过调节阈值范围和伪彩,清晰地显示出三者的空间关系和支架的走向和空间关系,同时通过三维重建图像,为分流道功能障碍提供较直观的依据。
本研究通过上述几种后处理技术,评估分流道障碍原因及曲张静脉严重程度有了较为清晰的认识,为再次介入手术提供术中指导及预判。20 例CT 和DSA 显示分流道情况完全一致,其中肝静脉端盖帽占40%,门静脉端盖帽18%,支架严重成角13%,支架内血栓形成5%。可以看出,覆膜支架的应用后,支架完全闭塞和狭窄的发生率明显减少,而支架盖帽和支架严重成角的发生率增加。笔者认为有以下几点原因:(1)解剖关系,门静脉和肝静脉在位置上是前下与后上关系,由于覆膜支架硬度大,植入后难以纠正这种位置关系导致支架贴壁。(2)由于呼吸运动导致支架释放难度增加,往往不能准确定位,肝静脉端需完全覆盖肝静脉到达腔静脉内,门静脉端需顺应门静脉血管走形。即使这样,随着时间的推移,因为呼吸运动和肝脏的缩小,支架仍有盖帽的可能。(3)穿刺门脉右支导致支架角度过大而成角。我们通过术前CT 指导,对于患者肝内支架情况有了初步了解,并以此为根据确定手术方案。本中心认为通过CT 门静脉成像的评估,在术中可以很快明确分流到失功的原因,以此为目的行介入开通分流道,可以大大的缩短手术时间及提高手术疗效。
通过43 例患者门静脉CT 成像诊断分流道失功及通过介入再次修复分流道,我们认为,随着覆膜支架的运用,支架内狭窄及支架内血栓形成导致分流道障碍的发生率减少,而肝静脉端及门静脉端盖帽导致分流道障碍增加。由于目前我国多使用Fluence 覆膜支架建立分流道,这款支架存在径向支撑力较强,所以如果穿刺路径角度大支架容易成角,两端容易盖帽[11]。为解决这一问题,根据我中心经验认为:尽量穿刺门静脉左支,支架不易成角[12];释放支架时,支架近端应覆盖完肝静脉到达下腔静脉,门静脉端应接裸支架延伸顺应门静脉走形。近年来专用于TIPS 的Viatorr 支架的应用,由于其柔顺性好和裸段的设计,一定程度上解决了肝静脉盖帽、门静脉盖帽和支架成角问题,分流道通畅率得到明显提高[13]。
综上所述,对于TIPS 术后再出血患者,门静脉CT 检查能准确找出分流道障碍原因,并能为介入手术提供有效的术前参考数据和准确定位,节约手术时间,提高手术疗效。同时我们可以通过分流道障碍的CT 门静脉共同特征,总结出初次TIPS 手术中不足,并指导和改进TIPS 手术,提高分流道远期通常率。
